В рибосомах содержится какая рнк
Биоинженеры разработали гибридные рибосомы, в состав которых вместо двух длинных цепочек рРНК входит единая молекула, обеспечивающая «неделимость» органеллы. Такие рибосомы могут поддерживать синтез всех необходимых для бактериальной клетки белков, хотя инициация трансляции у них происходит намного медленнее, чем у обычных рибосом.
Рибосомы — молекулярные машины для синтеза белка — у всех известных организмов устроены похоже. У рибосомы всегда есть малая субъединица, которая связывается с молекулой матричной РНК (мРНК), а также большая субъединица, которая присоединяется к ним позже. Функции субъединиц отличаются: задача малой — опознать подходящую РНК и место на ней, с которого нужно начать синтез белка, а большая субъединица, содержащая каталитический центр, присоединяется ко всей конструкции, когда всё уже готово — завершая создание рабочей рибосомы. Преждевременное соединение половин рибосомы настолько нежелательно, что в клетке даже есть специальные белковые факторы, которые этому препятствуют.
То, что рибосома состоит из двух отдельных половин, важно и для продолжения синтеза полипептида. Повороты субъединиц друг относительно друга протаскивают мРНК сквозь активный центр, так что все ее участки, которые должны быть прочитаны, своевременно в него попадают*. Наконец, разъединение субъединиц, считавших всю кодирующую часть цепочки РНК, знаменует окончание синтеза белковой молекулы.
И всё же биоинженерам очень хотелось получить рибосомы, в которых субъединицы были бы объединены в одну молекулу и, несмотря на это, могли проводить все стадии трансляции. Субъединицы таких «машин» не смешивались бы с пулом обычных рибосом клетки, поэтому на них можно было бы экспериментировать, не влияя на обычные процессы синтеза клеточных белков. Такой отдельный набор рибосом можно было бы подстраивать под наработку необычных пептидов: например, перестраивать выходной туннель рибосомы, чтобы его могли покидать крупные молекулы, или модифицировать ее активный центр под специфические реакции.
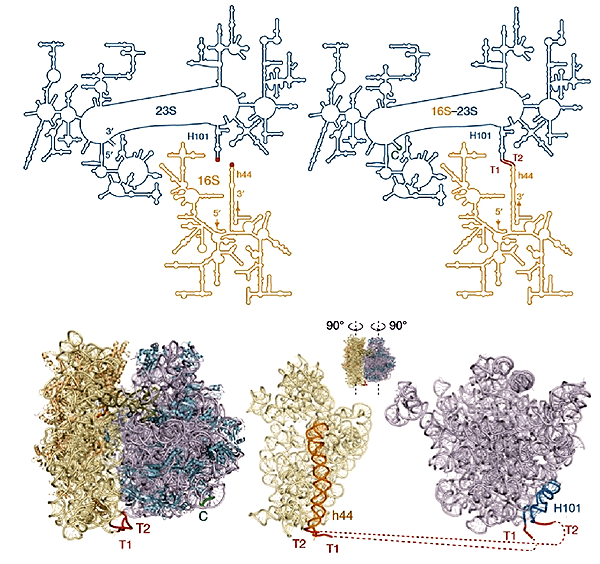
Молекулы РНК служат каркасами рибосомных субъединиц. Поэтому скрепить субъединицы между собой можно, получив единую протяженную молекулу рибосомной РНК (рРНК), включающую в себя каркасы для обеих субъединиц. При этом новая РНК должна как можно меньше отличаться от суммы исходных, чтобы клеточные системы контроля ошибок не распознали новую молекулу как ошибочно синтезированную или чужеродную*. Проще всего было бы соединить концы рибосомных РНК цепочками нуклеотидов. Но концы рРНК большой и малой субъединиц природных рибосом располагаются далеко друг от друга. Зато два конца РНК большой субъединицы сближены. Поэтому их можно сшить, а новые концы сделать в другом месте. Получившиеся варианты называются циркулярными пермутантами РНК большой субъединицы.
Ученым пришлось получить большую коллекцию таких мутантов, потому что не было известно, в каком месте рРНК лучше делать новые концы [3, 4]. По случайности один из невредных разрывов в РНК большой субъединицы 70S рибосомы располагался там, где большая субъединица контактирует с частью малой, которая, по данным прошлых исследований, к модификациям относится спокойно. Поэтому ученые решили соединить РНК в этом месте. Им пришлось еще и подбирать правильную длину рибонуклеиновых связок: они должны были быть не слишком короткими, чтобы связанные половины рибосомы могли двигаться друг относительно друга, но и не слишком длинными, чтобы к малой субъединице на старте синтеза белка не могла пристроиться одна из свободных клеточных больших субъединиц. Опыт показал, что подходящая длина линкеров — восемь и девять нуклеотидов.

Рисунок 1. Соединение двух рРНК для получения единой и неделимой рибосомы Ribo-T. Вверху — Вторичная структура нативных рРНК (слева) и их гибрида. Природные концы 16S и 23S рРНК располагаются в субъединицах рибосомы таким образом, что сшивать их не удобно (концы РНК отмечены как 3’ и 5’). Поэтому ученым пришлось соединить концы РНК большой субъединицы (справа вверху место сшивки (С) 23S рРНК отмечено зеленым) и сделать новые концы там, где их будет удобно подсоединить к 16S рРНК. Для сшивки использовали короткие цепочки РНК — линкеры Т1 и Т2 (отмечены красным). Внизу — Модели обычной бактериальной рибосомы (слева) и синтетической Ribo-T. Рисунок из [3].
Получившимися гибридными рибосомами Ribo-T (от англ. tethered — связанный) (рис. 1) ученые снабдили штаммы бактерий, не нарабатывающие обычных рибосом. Оказалось, что гибриды вполне способны поддерживать жизнь бактерий и синтезировать все необходимые для них белки. Правда, скорость роста бактерий, несущих лишь гибридные рибосомы, была в два раза меньше, чем у бактерий с обычными рибосомами. И даже такой скорости удалось добиться только клеткам с мутацией в гене одного из рибосомных белков и нарушенным синтезом предполагаемого транспортера ионов магния и кобальта. Как и скорость роста, скорость синтеза белков у бактерий, несущих гибридные рибосомы, оказалась в два раза меньше нормальной.
Ученые решили выяснить, почему гибридные рибосомы медленнее синтезируют белок. Оказалось, что рибосомы со скрепленными субъединицами тормозят сразу после распознавания стартового кодона. То есть основная проблема для них — правильная инициация трансляции. Ученые выяснили, что эта проблема не связана с худшим взаимодействием гибридных рибосом с факторами инициации, так как их добавление не компенсировало стартовое торможение. Так что новый вариант рибосом еще предстоит подробнее исследовать и усовершенствовать.
Гибридные рибосомы хоть и не очень быстро, но делали свое дело, так что ученые решили испытать их пригодность к работе в качестве независимой популяции рибосом. Во-первых, рибосомы отдельной популяции можно задействовать для чтения мРНК с необычными стартовыми сигналами. Для этого получили гибридные рибосомы с модифицированным участком, узнающим последовательность Шайна-Дальгарно — стартовую точку посадки бактериальных рибосом на РНК. РНК с измененной последовательностью Шайна-Дальгарно обычные клеточные рибосомы не распознавали, однако ее продукт обнаруживался в цитоплазме клеток, несущих особым образом модифицированные гибридные рибосомы. Значит, синтезом белка на такой матрице занимались только гибридные рибосомы, и трансляцию РНК со специфическими сигналами можно будет исследовать, не влияя на трансляцию остальных мРНК клетки.
Еще ученые получили модификацию гибридных рибосом, зависимую от антибиотика. Такие рибосомы будут работать, если добавить в среду антибиотик, блокирующий обычные рибосомы клетки. Антибиотик в такой системе служит переключателем, определяющим, какой набор рибосом будет активным. Так что клетки можно будет поддерживать либо в природном режиме жизни, либо в условиях, когда всю наработку белка берут на себя синтетические рибосомы. Манипулируя свойствами отдельной популяции рибосом, можно будет узнать о процессе синтеза белка гораздо больше.
- Рибосома за работой;
- Как избавиться от РНК за несколько минут;
- Orelle C., Carlson E.D., Szal T., Florin T., Jewett M.C., Mankin A.S. (2015). Protein synthesis by ribosomes with tethered subunits. Nature. 524, 119–124;
- Io S.B. and Gy L.O. (2015). Synthetic biology: Ribosomal ties that bind. Nature. 524, 45–46..
Матеріал з Вікіпедії — вільної енциклопедії.
Схема зв’язуючих РНК ділянок рибосоми. Буквами позначені ділянки зв’язування тРНК. А — аміноацил-тРНК-зв’язуюча ділянка, Р — пептидил-тРНК-зв’язуюча ділянка, Е — ділянка виходу тРНК (від англ. exit).
Рибосома (ribosome) є немембранною органелою клітини, що складається з рРНК та рибосомних білків (протеїнів). Рибосома здійснює біосинтез білків транслюючи з мРНК поліпептидний ланцюг. Таким чином, рибосому можна вважати фабрикою, що виготовляє білки, базуючись на наявній генетичній інформації. В клітині дозрілі рибосоми знаходяться переважно в компартментах, для активного білкового синтезу. Вони можуть вільно плавати в цитоплазмі або бути прикріпленими до цитоплазматичного боку мембран ендоплазматичного ретикулуму чи ядра. Активні (ті що є в процесі трансляції) рибосоми знаходяться переважно у вигляді полісом. Існує ряд свідчень, які вказують на те, що рибосома є рибозимом.
Історичний огляд[ред. | ред. код]
Рибосоми було виявлено на початку 1950-тих років. Перше глибоке дослідження та опис рибосом, як клітинних органел, було здійснене Джорджем Паладе. За іменем дослідника, рибосоми були названі «частинками Паладе», але згодом, в 1958 році, їх було перейменовано в «рибосоми» з огляду на високий вміст РНК. Роль рибосом в біосинтезі білків було встановлено більш ніж десятиліттям пізніше.
Синтетична рибосома[ред. | ред. код]
Після від’єднання від мРНК і початком нового раунду трансляції рибосомальні мала і велика субодиниці відділяються одна від одної. Тому, створення синтетичної рибосоми було технічно складним, оскільки синтетичні та наявні у клітині субодиниці змішувалися від раунду до раунду трансляції[1].
Починаючи з кінця 90х років 20 століття вдалося згенерувати декілька видів мутантних малих субодиниць рибосоми (див. пункт Будова рибосоми), які мали специфічну послідовність у 16S рРНК і з’єднувалися з мРНК, у якої Послідовність Шайна — Дальгарно була специфічно синтезована для взаємодії з модифікованою 16S рРНК. Це дозволило виконувати відбір мутованих малих субодиниць РНК від нативних і інтрудукувати декілька мутацій для вивчення властивостей синтезу білка[1].
Проте велика рибосомальна субодиниця презентувала проблеми, оскільки при створенні синтетичного варіанту не було можливості змусити його не відділятися від мРНК чи від малої субодиниці після завершення одного раунду трансляції[1]. Велика субодиниця містить важливі для вивчення структури, такі як канал для виходу синтезованого білка та сайт PTC (англ. peptidyl transferase centre), в якому відбувається з’єднання амінокислоти, що приєднана до тРНК, яка знаходяться на А-сайті рибосоми, до пептидильного ланцюга, що з’єднаний до молекули тРНК, яка знаходиться на P-сайі рибосоми (див. пункт «Центри зв’язування РНК»)
У липні 2015 року вдалося синтезувати першу повністю синтетичну рибосому. Для того, щоб велика і мала субодиниці не від’єднувались, їх було зв’язано в одну молекулу шляхом синтезу 16S-23S конструкту (Ribo-T). Така синтетична рибосома успішно виконувала синтез білка не лише in vitro, але і підтримувала ріст E.coli при вимушеній відсутності нативних рибосом[1].
Будова рибосоми[ред. | ред. код]
Загальна будова[ред. | ред. код]
Атомарна модель будови 50S рибосоми Haloarcula marismortui
Атомарна модель будови 30S рибосоми Thermus thermophilus
Рибосоми прокаріотів та еукаріотів є дуже подібними за будовою та функцією, але відрізняються розміром. Вони складаються з двох субодиниць: однієї великої та однієї малої. Для процесу трансляції необхідна злагоджена взаємодія обох субодиниць, що разом становлять комплекс із молекулярною масою декілька мільйонів дальтон (Da). Субодиниці рибосом за звичай позначаються одиницями Сведберга (S), що є мірою швидкості седиментації під час центрифугування і залежать від маси, розміру та форми частинки. Позначені в цих одиницях, велика субодиниця є 50S або 60S (прокаріотичні або еукаріотичні, відповідно), мала є 30S або 40S, і ціла рибосома (комплекс малої разом з великою) 70S або 80S.
Молекулярний склад[ред. | ред. код]
Молекулярний склад рибосом є доволі складним. Для прикладу, рибосома дріжджів ‘Saccharomyces cerevisiae’ складається із 79 рибосомних білків та 4 різних молекул рРНК. Біогенез рибосом є також надзвичайно складним і багатоступеневим процесом, що відбувається в ядрі та ядерці еукаріотичної клітини.
Атомна структура великої субодиниці (50S) організму Haloarcula marismortui була опублікована N. Ban et al. в журналі Science 11 Серпня 2000 року. Невдовзі після цього, 21шого Вересня 2000 року, B.T. Wimberly, et al., опублікували в журналі Nature структуру 30S субодиниці організму Thermus thermophilus. Використовуючи ці координати, M.M. Yusupov, et al. зуміли реконструювати цілу 70S частинку Thermus thermophilus і опублікувати її в журналі Science, в Травні 2001. У 2009 році професор Джордж Чьорч (George Church) та колеги з Гарварду створили повністю функціональну штучну рибосому в звичайних умовах, які присутні в клітинному середовищі. Як конструкційні елементи використовувались молекули з розщепленої за допомогою ензимів кишкової палички. Створена рибосома успішно синтезує білок, що відповідає за біолюмінесценцію.
Центри зв’язування РНК[ред. | ред. код]
Рибосома містить чотири сайти зв’язування для молекул РНК: один для мРНК і три для тРНК. Перший сайт зв’язування тРНК називається сайтом ‘аміноацил-тРНК’, або ‘А-сайтом’. В цьому сайті міститься молекула тРНК „заряджена” „наступною” амінокислотою. Другий сайт, ‘пептидил-тРНК’ зв’язуючий, або ‘P-сайт’, містить молекулу тРНК, що зв’язує ростучий кінець поліпептидного ланцюга. Третій сайт, це ‘сайт виходу’, або ‘E-сайт’. В цей сайт потрапляє порожня тРНК яка позбулась ростучого кінця поліпептида, після його взаємодії з наступною „зарядженою” амінокислотою в пептидильному сайті. Сайт зв’язування мРНК знаходиться в малій субодиниці. Він утримує рибосому „нанизаною” на мРНК котру рибосома транслює.
Функція[ред. | ред. код]
Схематичне зображення рибосоми в процесі трансляції. Мала субодиниця зв’язує мРНК, а велика субодиниця направляє аміноацил-тРНК та пептидил-тРНК до матричної РНК, контролюючи правильне парування відповідних триплетів
Рибосома є органелою, на якій відбувається трансляція генетичної інформації, закодованої в мРНК. Ця інформація втілюється в синтезований тут-же поліпептидний ланцюг. Рибосома несе двояку функцію: є структурною платформою для процесу декодування генетичної інформації з РНК, та володіє каталітичним центром відповідальним за формування пептидного зв’язку, так званим ‘пептидил-трансферазним центром’. Вважається що пептидил-трансферазна активність асоціюється з рРНК, і тому рибосома є рибозимом.
Локалізація рибосом[ред. | ред. код]
Рибосоми класифікуються як вільні (перебувають у гіалоплазмі) та невільні або прикріплені (пов’язані з мембранами ендоплазматичної мережі).
Вільні та прикріплені рибосоми відрізняються тільки локалізацією, але вони є структурно ідентичні. Рибосому називають вільною або прикріпленою в залежності від того чи білок який синтезується має ЕР-націлену сигнальну послідовність, тому індивідуальна рибосома може бути прикріпленою створюючи один білок, але вільною в цитозолі коли створює інший білок.
Рибосоми іноді називають органелами, але використання терміну органела обмежується субклітинними компонентами які мають фосфоліпідну мембрану, а рибосома(being entirely particulate) такою не є. Тому рибосоми іноді описують як «немембранні органелли».
Загальна інформація[ред. | ред. код]
В еукаріотичних організмах рибосоми можна знайти не лише в цитоплазмі, а й всередині в деяких великих мембранних органелах, зокрема міторибосоми в мітохондріях та специфічні рибосоми хлоропластів. Будова та молекулярний склад цих рибосом відрізняється від складу загально-клітинних рибосом, і є ближчим до складу рибосом прокаріотів. Такі рибосоми синтезують органело-специфічні білки, транслюючи органело-специфічну мРНК.
В еукаріотичних клітинах довгий час вважалося, що рибосоми, прикріплені до ендоплазматичного ретикулуму виконують синтез білків, які будуть секретовані назовні або трансмембранних чи інших сигнальних білків, приєднаних до плазмалеми. Рибонуклеопротеїн SRP[en] (англ. Signal recognition particle) виконує розпізнавання тих білків в процесі синтезу, які повинні бути трансмембранними і приєднує рибосому до ендоплазматичного ретикулуму. Проте останнім часом дослідження вказують, що 50-75% рибосом можуть бути прикріплені до ЕПР через не до кінця з’ясовані механізми і більшість білків в клітині проходить синтез у рибосомах, які прилягають до ЕПР. Так, у клітинної лінії HEK-293 75% мРНК відповідяє цитозольним білкам, проте до 50% рибосом зв’язані з ЕПР[2].
Хвороби[ред. | ред. код]
Вважається, що генетичні дефекти рибосомних білків та факторів біогенезу рибосом є летальними на ранніх ембріональних стадіях розвитку вищих організмів. Експериментальний мутагенез рибосомних білків в Drosophila melanogaster (мутації minute) викликає спільний фенотип: занижена швидкість мітозу, зменшений розмір тіла, занижена фертильність, короткі війки. Існує ряд свідчень що пов’язують ракову трансформацію клітин ссавців з розладами трансляційної системи загалом та розладами системи біогенезу рибосом зокрема.
Див. також[ред. | ред. код]
- Експресія генів
- РНК інтерференція
Примітки[ред. | ред. код]
Використана література[ред. | ред. код]
- Alberts, B. 1994. Molecular Biology of the Cell. Garland Pub., New York. xliii, 1294, 67 p.
- Nissen, P., J. Hansen, N. Ban, P.B. Moore, and T.A. Steitz. 2000. The structural basis of ribosome activity in peptide bond synthesis. Science. 289:920-30.
- Ruggero, D., and P.P. Pandolfi. 2003. Does the ribosome translate cancer? Nat Rev Cancer. 3:179-92.
- Sydorskyy, Y. 2005. Identification and characterization of novel ribosome biogenesis factors. Doctoral Thesis, Department of Cell Biology, University of Alberta. Edmonton, Canada.
- Uechi, T., T. Tanaka, and N. Kenmochi. 2001. A complete map of the human ribosomal protein genes: assignment of 80 genes to the cytogenetic map and implications for human disorders. Genomics. 72:223-30.
- Venema, J., and D. Tollervey. 1999. Ribosome synthesis in Saccharomyces cerevisiae. Annu Rev Genet. 33:261-311.
РИБОСО́МНЫЕ РИБОНУКЛЕИ́НОВЫЕ КИСЛО́ТЫ (рРНК), основные функциональные и структурные компоненты рибосом, составляющие от 50 до 70% их массы и более 80% массы всех клеточных РНК. Они определяют размеры и форму рибосомных субъединиц, формируют структурный каркас для специфич. размещения рибосомных белков в рибосоме, играют ключевую роль в её функционировании как молекулярной белоксинтезирующей машины. Для обозначения разл. типов рРНК, также как и для рибосомных субчастиц, используются единицы Сведберга – S, характеризующие их размеры и форму на основании скорости седиментации при ультрацентрифугировании. Каждая малая субъединица рибосомы – 30S у прокариот и 40S у эукариот – содержит одну молекулу высокомолекулярной рРНК, которая обозначается соответственно как 16S рРНК и 18S-подобная рРНК. Их длина составляет от 600 (у рибосом митохондрий некоторых организмов) до 1900 (у эукариот) нуклеотидных остатков (н. о.). Большая рибосомная субъединица (50S у прокариот и 60S у эукариот) содержит высокомолекулярную рРНК, называемую соответственно 23S рРНК и 28S-подобной рРНК (их длина колеблется от 2000 до 4800 н. о.), а также низкомолекулярную 5S рРНК длиной ок. 120 н. о. Кроме того, у эукариот рРНК большой субъединицы ассоциирована также с т. н. 5,8S рРНК. Большинство рРНК представляют собой непрерывные полинуклеотидные цепи; лишь в рибосомах митохондрий некоторых видов простейших содержатся фрагментированные молекулы рРНК.
Гл. источник информации о первичной структуре рРНК – нуклеотидные последовательности (н. п.) генов, в которых они кодированы. При этом если геномы прокариот содержат от одного до 6–7 оперонов рРНК с практически идентичной н. п., то в хромосомах эукариот их число может достигать нескольких десятков тысяч. Транскрипция генов рРНК у бактерий осуществляется универсальными РНК-полимеразами (РНК-П.); у эукариот РНК-П. I транскрибирует гены высокополимерных рРНК, а РНК-П. III – гены 5S рРНК. У всех организмов рРНК первоначально синтезируется в виде предшественника, который затем подвергается процессингу и сплайсингу (при наличии интронов) с образованием «зрелой» рРНК. В ядрах эукариот активно транскрибируемые участки хромосом, содержащие гены рРНК, образуют специализир. субклеточные структуры, называемые ядрышками. Уровень синтеза рРНК в клетке является её важнейшим физиологич. параметром и тонко регулируется на транскрипционном и посттранскрипционном уровнях.
рРНК формирует все функциональные центры рибосомы и участки связывания с рибосомой факторов трансляции. В частности, рРНК малой субъединицы напрямую участвуют в процессе декодирования, т. е. в кодон-антикодоновом взаимодействии мРНК и тРНК; рРНК большой субъединицы формирует её пептидилтрансферазный центр (ПТЦ), а также туннель, по которому из рибосомы выходит растущая полипептидная цепь синтезируемого белка. При этом ПТЦ рибосомы организован исключительно из н. о. рРНК, что позволяет считать её рибозимом. Функциональные н. о. рРНК исключительно консервативны в эволюции и практически идентичны у всех рибосом – от цианобактерий до высших эукариот. Предполагается, что древняя прорибосома могла состоять только из РНК. См. также Рибонуклеиновые кислоты.
