Укажите какой раствор содержится в пробирке

Дан раствор сульфата меди(II), а также набор следующих реактивов:
карбонат кальция, соляная кислота, растворы нитрата калия, гидроксида
натрия, хлорида бария.
Проведите химические реакции между сульфатом меди(II) и выбранными
веществами в соответствии с составленными уравнениями реакции,
соблюдая правила техники безопасности, приведённые в инструкции
к заданию.
Опишите изменения, происходящие с веществами в ходе
проведённых реакций.
Подготовьте лабораторное оборудование, необходимое для проведения
эксперимента.
Задание выполняйте только под наблюдением учителя.
Инструкция по выполнению задания
Внимание! В случае ухудшения самочувствия перед началом опытов
или во время их выполнения обязательно сообщите об этом
организатору в аудитории.
1. Вы приступаете к выполнению эксперимента. Для этого получите лоток
с лабораторным оборудованием и реактивами у специалиста по
обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданию, и убедитесь (по формулам в этикетках) в том, что на выданном лотке
находятся пять перечисленных в перечне реактивов.
3. Перед началом выполнения эксперимента
осмотрите ёмкости
с реактивами и определите способ работы с ними. При этом обратите
внимание на рекомендации, которым Вы должны следовать.
3.1. В склянке находится пипетка. Это означает, что отбор жидкости и
переливание её в пробирку для проведения реакции необходимо
проводить только с помощью пипетки. Для проведения опытов
отбирают 7–10 капель реактива.
3.2. Пипетка в склянке с жидкостью отсутствует. В этом случае
переливание раствора осуществляют через край склянки, которую
располагают так,
(«этикетку — в ладонь!»). Склянку медленно наклоняют над
пробиркой, пока нужный объём раствора не перельётся в неё. Объём
перелитого раствора должен составлять 1–2 мл (1–2 см).
3.3. Для проведения опыта требуется порошкообразное (сыпучее)
вещество.
Отбор порошкообразного вещества из ёмкости
осуществляют только с помощью ложечки или шпателя.
3.4. При отборе исходного реактива взят его излишек. Возврат
излишка реактива в исходную ёмкость категорически запрещён. Его
помещают в отдельную, резервную пробирку.
3.5. Сосуд с исходным реактивом (жидкостью или порошком)
обязательно закрывается крышкой (пробкой) от этой же ёмкости.
3.6. При растворении в воде порошкообразного вещества или при
перемешивании реактивов следует слегка ударять пальцем по дну
пробирки.
3.7. Для определения запаха вещества взмахом руки над горлышком
сосуда с веществом направлять на себя пары этого вещества.
3.8. Для проведения нагревания пробирки с реактивами на пламени
спиртовки необходимо:
- снять колпачок спиртовки и поднести зажжённую спичку к её фитилю;
- закрепить пробирку в пробиркодержателе на расстоянии 1–2 см от горлышка пробирки;
- внести пробирку в пламя спиртовки и некоторое время передвигать её в пламени вверх и вниз так, чтобы содержимое пробирки прогрелось равномерно;
- далее следует нагревать только ту часть пробирки, где находятся вещества, при этом пробирку удерживать в слегка наклонном положении;
- открытый конец пробирки следует отводить от себя и других людей;
- после нагревания жидкости пробиркодержатель с пробиркой поместить в штатив для пробирок;
- фитиль спиртовки закрыть колпачком.
3.9. Если реактивы попали на рабочий стол, их удаляют
с поверхности стола с помощью салфетки.
3.10. Если реактив попал на кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению
лабораторных работ в аудитории.
4. Вы готовы к выполнению эксперимента. Поднимите руку и пригласите
организатора в аудитории, который пригласит экспертов предметной
комиссии для оценивания проводимого Вами эксперимента.
5. Начинайте выполнять опыт. Записывайте в черновик свои наблюдения
за изменениями, происходящими с веществами.
6. Вы завершили эксперимент.
1) Различить вещества: а) MgCl2; б) NaOH; в) Na2CO3; г) NaNO3;
а)
Действия
: Ко всем веществам добавляем р-р соляной кислоты.
Наблюдения
: В одной из пробирок выделяется газ.
Уравнения реакции:

Выводы:
В данной пробирке содержится карбонат натрия, т.к. протекает качественная реакция на карбонат-ион. б)
Действия
: Оставшиеся вещества растворяем в воде и к полученным растворам добавляем фенолфталеин.
Наблюдения
: В одной из пробирок раствор розовеет.
Уравнения реакции:

Выводы:
Раствор фенолфталеина розовеет в щелочной среде (под действиям ионов OH- ), поэтому в данной пробирке находится гидроксид натрия. в)
Действия
: К оставшимся растворам добавляем раствор нитрата серебра (I).
Наблюдения
: В одной из пробирок образовался белый осадок.
Уравнения реакции:

Выводы:
Эта реакция качественная на хлорид-ион, значит, в данной пробирке находится хлорид магния. г)
Действия
: К оставшемуся раствору добавляем концентрированную серную кислоту и кусочек меди. Нагреваем.
Наблюдения
: Выделяется газ бурого цвета, медь растворяется, а раствор становится голубого цвета.
Уравнения реакции:

Выводы:
Реакция является качественной на нитрат-ион, следовательно, в данной пробирке находится нитрат натрия.
2) Различить вещества: а) CaCO3; б) Ba(NO3)2; в) Na2SO4; г) Na2S
а)
Действия
: Ко всем веществам добавляем р-р соляной кислоты.
Наблюдения
: В одной из пробирок выделяется газ без запаха, а в другой — с неприятным запахом.
Уравнения реакции:

Выводы:
В пробирке, в которой выделялся газ без запаха, содержится

т. к. это качественная реакция на карбонат-ион. Там, где выделялся газ с неприятным запахом

содержится сульфид натрия. б)
Действия
: После растворения оставшихся веществ в воде добавляем раствор сульфата натрия.
Наблюдения
: В одной из пробирок образовался белый осадок.
Уравнения реакции:

Выводы:
Качественная реакция на ион бария, значит, в данной пробирке — нитрат бария. в)
Действия
: К оставшемуся р-ру добавляем р-р хлорида бария.
Наблюдения
: Образовался белый осадок.
Уравнения реакции:

Выводы:
Это качественная реакция на сульфат-ион, следовательно, в данной пробирке — сульфат натрия.
3) Доказать, что выданное вещество — сульфат алюминия Al2(SO4)3
а)
Действия
: К выданному в-ву добавляем раствор хлорида бария.
Наблюдения
: Выпал белый осадок.
Уравнения реакции:

Выводы:
Это качественная реакция на сульфат-ион. б)
Действия
: К небольшому количеству раствора щелочи добавляем раствор выданного вещества.
Наблюдения
: Образовался белый студенистый осадок.
Уравнения реакции:

Выводы:
В результате происходит образование нерастворимого основания

за счет связывания ионов

Значит, в исследуемом веществе содержится ион алюминия. в)
Действия
: Добавляем избыток щелочи.
Наблюдения
: В избытке щелочи осадок растворяется.
Уравнения реакции:

Выводы:
Гидроксид обладает амфотерными свойствами: образуется матааллюминат натрия. Это еще раз доказывает, что выданное вещество содержит ион алюминия.
4) Различить растворы: NaCL, BaCl2, AlCl3
а)
Действия
: Ко всем растворам добавляем р-р сульфата натрия.
Наблюдения
: В одной из пробирок выпадает белый осадок.
Уравнения реакции:

Выводы:
В данной пробирке содержится хлорид бария, т.к. эта реакция — качественная на ионы бария. б)
Действия
: К двум оставшимся растворам добавляем немного раствора щелочи.
Наблюдения
: В одной из пробирок образовался белый студенистый осадок.
Уравнения реакции:

Выводы:
В данной пробирке — хлорид алюминия. в)
Действия
: Несколько капель оставшегося раствора вносим в пламя спиртовки на нихромовой проволоке.
Наблюдения
: Пламя окрашивается в желтый цвет.
Выводы:
В данной пробирке — хлорид натрия, т.к. в желтый цвет пламя окрашивают ионы натрия.
5) Доказать, что кристаллы FeSO4 частично окислились и содержат примеси ионов Fe3+
Действия
: Растворяем кристаллы в воде и добавляем р-р

Наблюдения
: Образуется зеленый и бурый осадки.
Уравнения реакции:
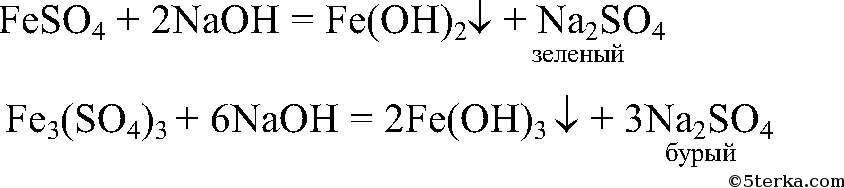
Выводы:
Бурый осадок — нерастворимое основание


имеет зеленый цвет. Значит, в исходном

содержались окислившиеся ионы

6) В двух склянках дана вода. В одной из них вода содержит MgSO4, а в другой — Ca(HCO3)2. Проделать опыты, при помощи которых можно устранить постоянную и временную жесткость.
а)
Действия
: В воду, содержащую

добавляем р-р

Наблюдения
: Образуется белый осадок.
Уравнения реакции:

Выводы:
Ионы

обуславливают постоянную жесткость воды. Такую воду можно умягчить, добавив раствор карбоната натрия, т. к. при этом происходит связывание ионов

б)
Действия
: В воду, содержащую

добавляем: раствор

известковое молоко, т.е. насыщенный раствор

кипятим ее.
Наблюдения
: Образуется белый осадок.
Уравнения реакции:

Выводы:
Присутствие

обуславливает временную жесткость воды. Эту воду можно умягчить добавлением известкового молока, соды или кипячением, т.к. все эти процессы сопровождаются образованием

7) Осуществить превращения:
а) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe(NO3)3
1.
Действия
: К порошку железа добавляем соляную кислоту.
Уравнения реакции:

2.
Действия
: После прекращения выделения газа добавляем раствор щелочи.
Уравнения реакции:

3.
Действия
: К осадку добавляем немного р-ра перекиси водорода.
Уравнения реакции:
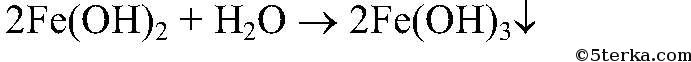
4.
Действия
: К осадку добавляем раствор азотной кислоты
Уравнения реакции:

б) Al → Al(SO4)3 → Al(OH)3 → NaAlO2
1.
Действия
: К нескольким гранулам

добавляем р-р

Уравнения реакции:

2.
Действия
: После выделения газа добавляем щелочь (по каплям).
Уравнения реакции:

3.
Действия
: К осадку добавляем избыток щелочи.
Уравнения реакции:

Ñîðîêèí
Â.Â., Çàãîðñêèé Â.Â., Ñâèòàíüêî È.Â.Çàäà÷è õèìè÷åñêèõ îëèìïèàä.
§5. Îïðåäåëåíèå îäíîãî èëè íåñêîëüêèõ âåùåñòâ íà îñíîâàíèè êà÷åñòâåííûõ ðåàêöèé
Ðåøåíèå êà÷åñòâåííûõ çàäà÷ ïî
îïðåäåëåíèþ âåùåñòâ, íàõîäÿùèõñÿ â ñêëÿíêàõ áåç
ýòèêåòîê, ïðåäïîëàãàåò ïðîâåäåíèå ðÿäà îïåðàöèé,
ïî ðåçóëüòàòàì êîòîðûõ ìîæíî îïðåäåëèòü, êàêîå
âåùåñòâî íàõîäèòñÿ â òîé èëè èíîé ñêëÿíêå.
Ïåðâûì ýòàïîì ðåøåíèÿ ÿâëÿåòñÿ
ìûñëåííûé ýêñïåðèìåíò, ïðåäñòàâëÿþùèé ñîáîé
ïëàí äåéñòâèé è èõ ïðåäïîëàãàåìûå ðåçóëüòàòû.
Äëÿ çàïèñè ìûñëåííîãî ýêñïåðèìåíòà èñïîëüçóåòñÿ
ñïåöèàëüíàÿ òàáëèöà-ìàòðèöà, â íåé îáîçíà÷åíû
ôîðìóëû îïðåäåëÿåìûõ âåùåñòâ ïî ãîðèçîíòàëè è
âåðòèêàëè.  ìåñòàõ ïåðåñå÷åíèÿ ôîðìóë
âçàèìîäåéñòâóþùèõ âåùåñòâ çàïèñûâàþòñÿ
ïðåäïîëàãàåìûå ðåçóëüòàòû íàáëþäåíèé: — âûäåëåíèå
ãàçà, —
âûïàäåíèå îñàäêà, óêàçûâàþòñÿ èçìåíåíèÿ öâåòà,
çàïàõà èëè îòñóòñòâèå âèäèìûõ èçìåíåíèé. Åñëè ïî
óñëîâèþ çàäà÷è âîçìîæíî ïðèìåíåíèå
äîïîëíèòåëüíûõ ðåàêòèâîâ, òî ðåçóëüòàòû èõ
èñïîëüçîâàíèÿ ëó÷øå çàïèñàòü ïåðåä ñîñòàâëåíèåì
òàáëèöû — ÷èñëî îïðåäåëÿåìûõ âåùåñòâ â òàáëèöå
ìîæåò áûòü òàêèì îáðàçîì ñîêðàùåíî.
Ðåøåíèå çàäà÷è áóäåò, ñëåäîâàòåëüíî, ñîñòîÿòü èç
ñëåäóþùèõ ýòàïîâ:
— ïðåäâàðèòåëüíîå îáñóæäåíèå îòäåëüíûõ ðåàêöèé è
âíåøíèõ õàðàêòåðèñòèê âåùåñòâ;
— çàïèñü ôîðìóë è ïðåäïîëàãàåìûõ ðåçóëüòàòîâ
ïîïàðíûõ ðåàêöèé â òàáëèöó,
— ïðîâåäåíèå ýêñïåðèìåíòà â ñîîòâåòñòâèè ñ
òàáëèöåé (â ñëó÷àå ýêñïåðèìåíòàëüíîé çàäà÷è);
— àíàëèç ðåçóëüòàòîâ ðåàêöèé è ñîîòíåñåíèå èõ ñ
êîíêðåòíûìè âåùåñòâàìè;
— ôîðìóëèðîâêà îòâåòà çàäà÷è.
Íåîáõîäèìî ïîä÷åðêíóòü, ÷òî ìûñëåííûé
ýêñïåðèìåíò è ðåàëüíîñòü íå âñåãäà ïîëíîñòüþ
ñîâïàäàþò, òàê êàê ðåàëüíûå ðåàêöèè
îñóùåñòâëÿþòñÿ ïðè îïðåäåëåííûõ êîíöåíòðàöèè,
òåìïåðàòóðå, îñâåùåíèè (íàïðèìåð, ïðè
ýëåêòðè÷åñêîì ñâåòå AgCl è AgBr èäåíòè÷íû). Ìûñëåííûé
ýêñïåðèìåíò ÷àñòî íå ó÷èòûâàåò ìíîãèõ ìåëî÷åé. Ê
ïðèìåðó, Br2/aq ïðåêðàñíî îáåñöâå÷èâàåòñÿ
ðàñòâîðàìè Na2CO3, Íà2SiO3, CH3COONa;
îáðàçîâàíèå îñàäêà Ag3PO4 íå èäåò â
ñèëüíîêèñëîé ñðåäå, òàê êàê ñàìà êèñëîòà íå äàåò
ýòîé ðåàêöèè; ãëèöåðèí îáðàçóåò êîìïëåêñ ñ Ñu (ÎÍ) 2,
íî íå îáðàçóåò ñ (CuOH)2SO4, åñëè íåò
èçáûòêà ùåëî÷è, è ò. ä. Ðåàëüíàÿ ñèòóàöèÿ íå
âñåãäà ñîãëàñóåòñÿ ñ òåîðåòè÷åñêèì ïðîãíîçîì, è
â ýòîé ãëàâå òàáëèöû-ìàòðèöû»èäåàëà» è
«ðåàëüíîñòè» èíîãäà áóäóò îòëè÷àòüñÿ. À
÷òîáû ðàçáèðàòüñÿ â òîì, ÷òî æå ïðîèñõîäèò íà
ñàìîì äåëå, èùèòå âñÿêóþ âîçìîæíîñòü ðàáîòàòü
ðóêàìè ýêñïåðèìåíòàëüíî íà óðîêå èëè
ôàêóëüòàòèâå (ïîìíèòå ïðè ýòîì î òðåáîâàíèÿõ
òåõíèêè áåçîïàñíîñòè).
Ïðèìåð 1. Â ïðîíóìåðîâàííûõ
ñêëÿíêàõ ñîäåðæàòñÿ ðàñòâîðû ñëåäóþùèõ âåùåñòâ:
íèòðàòà ñåðåáðà, ñîëÿíîé êèñëîòû, ñóëüôàòà
ñåðåáðà, íèòðàòà ñâèíöà, àììèàêà è ãèäðîêñèäà
íàòðèÿ. Íå èñïîëüçóÿ äðóãèõ ðåàêòèâîâ,
îïðåäåëèòå, â êàêîé ñêëÿíêå ðàñòâîð êàêîãî
âåùåñòâà íàõîäèòñÿ.
Ðåøåíèå. Äëÿ ðåøåíèÿ çàäà÷è
ñîñòàâèì òàáëèöó-ìàòðèöó, â êîòîðóþ áóäåì
çàíîñèòü â ñîîòâåòñòâóþùèå êâàäðàòèêè íèæå
ïåðåñåêàþùåé åå äèàãîíàëè äàííûå íàáëþäåíèÿ
ðåçóëüòàòîâ ñëèâàíèÿ âåùåñòâ îäíèõ ïðîáèðîê ñ
äðóãèìè.
Íàáëþäåíèå ðåçóëüòàòîâ
ïîñëåäîâàòåëüíîãî ïðèëèâàíèÿ ñîäåðæèìîãî îäíèõ
ïðîíóìåðîâàííûõ ïðîáèðîê êî âñåì äðóãèì:
1 + 2 âûïàäàåò áåëûé îñàäîê; ;
1 + 3 âèäèìûõ èçìåíåíèé íå íàáëþäàåòñÿ;
1 + 4 â çàâèñèìîñòè îò ïîðÿäêà ñëèâàíèÿ
ðàñòâîðîâ ìîæåò âûïàñòü îñàäîê;
1 + 5 âûïàäàåò îñàäîê áóðîãî öâåòà;
2+3 âûïàäàåò îñàäîê áåëîãî öâåòà;
2+4 âèäèìûõ èçìåíåíèé íå íàáëþäàåòñÿ;
2+5 âèäèìûõ èçìåíåíèé íå íàáëþäàåòñÿ;
3+4 íàáëþäàåòñÿ ïîìóòíåíèå;
3+5 âûïàäàåò áåëûé îñàäîê;
4+5 âèäèìûõ èçìåíåíèé íå íàáëþäàåòñÿ.
Çàïèøåì äàëåå óðàâíåíèÿ ïðîòåêàþùèõ
ðåàêöèé â òåõ ñëó÷àÿõ, êîãäà íàáëþäàþòñÿ
èçìåíåíèÿ â ðåàêöèîííîé ñèñòåìå (âûäåëåíèå ãàçà,
îñàäêà, èçìåíåíèå öâåòà) è çàíåñåì ôîðìóëó
íàáëþäàåìîãî âåùåñòâà è ñîîòâåòñòâóþùèé
êâàäðàòèê òàáëèöû-ìàòðèöû âûøå ïåðåñåêàþùåé åå
äèàãîíàëè:
(ïðè ïðèëèâàíèè íèòðàòà ñâèíöà â èçáûòîê ùåëî÷è
îñàäîê ìîæåò ñðàçó ðàñòâîðèòüñÿ).
Òàêèì îáðàçîì, íà îñíîâàíèè ïÿòè îïûòîâ
ðàçëè÷àåì âåùåñòâà, íàõîäÿùèåñÿ â
ïðîíóìåðîâàííûõ ïðîáèðêàõ.
Ïðèìåð 2. Â âîñüìè ïðîíóìåðîâàííûõ
ïðîáèðêàõ (îò 1 äî 8) áåç íàäïèñåé ñîäåðæàòñÿ ñóõèå
âåùåñòâà: íèòðàò ñåðåáðà (1), õëîðèä àëþìèíèÿ (2),
ñóëüôèä íàòðèÿ (3), õëîðèä áàðèÿ (4), íèòðàò êàëèÿ (5),
ôîñôàò êàëèÿ (6), à òàêæå ðàñòâîðû ñåðíîé (7) è
ñîëÿíîé (8) êèñëîò. Êàê, íå èìåÿ íèêàêèõ
äîïîëíèòåëüíûõ ðåàêòèâîâ, êðîìå âîäû, ðàçëè÷èòü
ýòè âåùåñòâà?
Ðåøåíèå. Ïðåæäå âñåãî ðàñòâîðèì
òâåðäûå âåùåñòâà â âîäå è îòìåòèì ïðîáèðêè, ãäå
îíè îêàçàëèñü. Ñîñòàâèì òàáëèöó-ìàòðèöó (êàê â
ïðåäûäóùåì ïðèìåðå), â êîòîðóþ áóäåì çàíîñèòü
äàííûå íàáëþäåíèÿ ðåçóëüòàòîâ ñëèâàíèÿ âåùåñòâ
îäíèõ ïðîáèðîê ñ äðóãèìè íèæå è âûøå
ïåðåñåêàþùåé åå äèàãîíàëè.  ïðàâîé ÷àñòè
òàáëèöû ââåäåì äîïîëíèòåëüíóþ ãðàôó»îáùèé
ðåçóëüòàò íàáëþäåíèÿ», êîòîðóþ çàïîëíèì ïîñëå
îêîí÷àíèÿ âñåõ îïûòîâ è ñóììèðîâàíèÿ èòîãîâ
íàáëþäåíèé ïî ãîðèçîíòàëè ñëåâà íàïðàâî (ñì.,
íàïðèìåð, ñ. 178).
Âèäèìûõ èçìåíåíèé íå ïðîèñõîäèò
òîëüêî ñ íèòðàòîì êàëèÿ.
Ïî òîìó, ñêîëüêî ðàç âûïàäàåò îñàäîê è
âûäåëÿåòñÿ ãàç, îäíîçíà÷íî îïðåäåëÿþòñÿ âñå
ðåàãåíòû. Êðîìå òîãî, ÂàÑ12 è Ê3ÐÎ4
ðàçëè÷àþò ïî öâåòó âûïàâøåãî îñàäêà ñ AgNO3:
AgCl áåëûé, a Ag3PO4 æåëòûé. Â äàííîé
çàäà÷å ðåøåíèå ìîæåò áûòü áîëåå ïðîñòûì ëþáîé
èç ðàñòâîðîâ êèñëîò ïîçâîëÿåò ñðàçó âûäåëèòü
ñóëüôèä íàòðèÿ, èì îïðåäåëÿþòñÿ íèòðàò ñåðåáðà è
õëîðèä àëþìèíèÿ. Íèòðàòîì ñåðåáðà îïðåäåëÿþòñÿ
ñðåäè îñòàâøèõñÿ òðåõ òâåðäûõ âåùåñòâ õëîðèä
áàðèÿ è ôîñôàò êàëèÿ, õëîðèäîì áàðèÿ ðàçëè÷àþò
ñîëÿíóþ è ñåðíóþ êèñëîòû.
Ïðèìåð 3.  ÷åòûðåõ ïðîáèðêàõ áåç
ýòèêåòîê íàõîäÿòñÿ áåíçîë, õëîðãåêñàí, ãåêñàí è
ãåêñåí. Èñïîëüçóÿ ìèíèìàëüíûå êîëè÷åñòâà è ÷èñëî
ðåàêòèâîâ, ïðåäëîæèòå ìåòîä îïðåäåëåíèÿ êàæäîãî
èç óêàçàííûõ âåùåñòâ.
Ðåøåíèå. Îïðåäåëÿåìûå âåùåñòâà
ìåæäó ñîáîé íå ðåàãèðóþò, òàáëèöó ïîïàðíûõ
ðåàêöèé íåò ñìûñëà ñîñòàâëÿòü.
Ñóùåñòâóåò íåñêîëüêî ìåòîäîâ îïðåäåëåíèÿ äàííûõ
âåùåñòâ, íèæå ïðèâåäåí îäèí èç íèõ.
Áðîìíóþ âîäó îáåñöâå÷èâàåò ñðàçó òîëüêî ãåêñåí:
Ñ6Í12 + Âr2 = Ñ6Í12Âr2.
Õëîðãåêñàí ìîæíî îòëè÷èòü îò ãåêñàíà,
ïðîïóñêàÿ ïðîäóêòû èõ ñãîðàíèÿ ÷åðåç ðàñòâîð
íèòðàòà ñåðåáðà (â ñëó÷àå õëîðãåêñàíà âûïàäàåò
áåëûé îñàäîê õëîðèäà ñåðåáðà, íåðàñòâîðèìûé â
àçîòíîé êèñëîòå, â îòëè÷èå îò êàðáîíàòà ñåðåáðà):
2Ñ6Í14+ 19O2= 12ÑO2+ 14Í2Î;
Ñ6Í13Ñl + 9O2 = 6ÑO2 + 6Í2O +
ÍÑ1;
HCl + AgNO3 = AgCl + HNO3.
Áåíçîë îòëè÷àåòñÿ îò ãåêñàíà ïî
çàìåðçàíèþ â ëåäÿíîé âîäå (ó Ñ6Í6 ò.
ïë.= +5,5°Ñ, à ó Ñ6Í14ò. ïë. = -95,3°Ñ).
Çàäà÷è
1.  äâà îäèíàêîâûõ õèìè÷åñêèõ
ñòàêàíà íàëèòû ðàâíûå îáúåìû: â îäèí âîäû, â
äðóãîé ðàçáàâëåííîãî ðàñòâîðà ñåðíîé êèñëîòû.
Êàê, íå èìåÿ ïîä ðóêîé íèêàêèõ õèìè÷åñêèõ
ðåàêòèâîâ, ðàçëè÷èòü ýòè æèäêîñòè (ïðîáîâàòü
ðàñòâîðû íà âêóñ íåëüçÿ)?
2.  ÷åòûðåõ ïðîáèðêàõ
íàõîäÿòñÿ ïîðîøêè îêñèäà ìåäè(II), îêñèäà æåëåçà
(III), ñåðåáðà, æåëåçà. Êàê ðàñïîçíàòü ýòè âåùåñòâà,
èñïîëüçóÿ òîëüêî îäèí õèìè÷åñêèé ðåàêòèâ?
Ðàñïîçíàâàíèå ïî âíåøíåìó âèäó èñêëþ÷àåòñÿ.
3.  ÷åòûðåõ ïðîíóìåðîâàííûõ
ïðîáèðêàõ íàõîäÿòñÿ ñóõèå îêñèä ìåäè (II), ñàæà,
õëîðèä íàòðèÿ è õëîðèä áàðèÿ. Êàê, ïîëüçóÿñü
ìèíèìàëüíûì êîëè÷åñòâîì ðåàêòèâîâ, îïðåäåëèòü, â
êàêîé èç ïðîáèðîê íàõîäèòñÿ êàêîå âåùåñòâî?
Îòâåò îáîñíóéòå è ïîäòâåðäèòå óðàâíåíèÿìè
ñîîòâåòñòâóþùèõ õèìè÷åñêèõ ðåàêöèé.
4. Â øåñòè ïðîáèðêàõ áåç
íàäïèñåé íàõîäÿòñÿ áåçâîäíûå ñîåäèíåíèÿ: îêñèä
ôîñôîðà(V), õëîðèä íàòðèÿ, ñóëüôàò ìåäè, õëîðèä
àëþìèíèÿ, ñóëüôèä àëþìèíèÿ, õëîðèä àììîíèÿ. Êàê
ìîæíî îïðåäåëèòü ñîäåðæèìîå êàæäîé ïðîáèðêè,
åñëè èìååòñÿ òîëüêî íàáîð ïóñòûõ ïðîáèðîê, âîäà è
ãîðåëêà? Ïðåäëîæèòå ïëàí àíàëèçà.
5.  ÷åòûðåõ ïðîáèðêàõ áåç
íàäïèñåé íàõîäÿòñÿ âîäíûå ðàñòâîðû ãèäðîêñèäà
íàòðèÿ, ñîëÿíîé êèñëîòû, ïîòàøà è ñóëüôàòà
àëþìèíèÿ. Ïðåäëîæèòå ñïîñîá îïðåäåëåíèÿ
ñîäåðæèìîãî êàæäîé ïðîáèðêè, íå ïðèìåíÿÿ
äîïîëíèòåëüíûõ ðåàêòèâîâ.
6. Â ïðîíóìåðîâàííûõ
ïðîáèðêàõ íàõîäÿòñÿ ðàñòâîðû ãèäðîêñèäà íàòðèÿ,
ñåðíîé êèñëîòû, ñóëüôàòà íàòðèÿ è ôåíîëôòàëåèí.
Êàê ðàçëè÷èòü ýòè ðàñòâîðû, íå ïîëüçóÿñü
äîïîëíèòåëüíûìè ðåàêòèâàìè?
7. Â áàíêàõ áåç ýòèêåòîê
íàõîäÿòñÿ ñëåäóþùèå èíäèâèäóàëüíûå âåùåñòâà:
ïîðîøêè æåëåçà, öèíêà, êàðáîíàòà êàëüöèÿ,
êàðáîíàòà êàëèÿ, ñóëüôàòà íàòðèÿ, õëîðèäà íàòðèÿ,
íèòðàòà íàòðèÿ, à òàêæå ðàñòâîðû ãèäðîêñèäà
íàòðèÿ è ãèäðîêñèäà áàðèÿ. Â Âàøåì ðàñïîðÿæåíèè
íåò íèêàêèõ äðóãèõ õèìè÷åñêèõ ðåàêòèâîâ, â òîì
÷èñëå è âîäû. Ñîñòàâüòå ïëàí îïðåäåëåíèÿ
ñîäåðæèìîãî êàæäîé áàíêè.
8.  ÷åòûðåõ ïðîíóìåðîâàííûõ
áàíêàõ áåç ýòèêåòîê íàõîäÿòñÿ òâåðäûå îêñèä
ôîñôîðà (V) (1), îêñèä êàëüöèÿ (2), íèòðàò ñâèíöà (3),
õëîðèä êàëüöèÿ (4). Îïðåäåëèòü, â êàêîé èç áàíîê
íàõîäèòñÿ êàæäîå èç óêàçàííûõ ñîåäèíåíèé,
åñëè èçâåñòíî, ÷òî âåùåñòâà (1) è (2) áóðíî
ðåàãèðóþò ñ âîäîé, à âåùåñòâà (3) è (4) ðàñòâîðÿþòñÿ
â âîäå, ïðè÷åì ïîëó÷åííûå ðàñòâîðû (1) è (3) ìîãóò
ðåàãèðîâàòü ñî âñåìè îñòàëüíûìè ðàñòâîðàìè ñ
îáðàçîâàíèåì îñàäêîâ.
9. Â ïÿòè ïðîáèðêàõ áåç
ýòèêåòîê íàõîäÿòñÿ ðàñòâîðû ãèäðîêñèäà,
ñóëüôèäà, õëîðèäà, éîäèäà íàòðèÿ è àììèàêà. Êàê
îïðåäåëèòü ýòè âåùåñòâà ïðè ïîìîùè îäíîãî
äîïîëíèòåëüíîãî ðåàêòèâà? Ïðèâåäèòå óðàâíåíèÿ
õèìè÷åñêèõ ðåàêöèé.
10. Êàê ðàñïîçíàòü ðàñòâîðû õëîðèäà
íàòðèÿ, õëîðèäà àììîíèÿ, ãèäðîêñèäà áàðèÿ,
ãèäðîêñèäà íàòðèÿ, íàõîäÿùèåñÿ â ñîñóäàõ áåç
ýòèêåòîê, èñïîëüçóÿ ëèøü ýòè ðàñòâîðû?
11.. Â âîñüìè ïðîíóìåðîâàííûõ
ïðîáèðêàõ íàõîäÿòñÿ âîäíûå ðàñòâîðû ñîëÿíîé
êèñëîòû, ãèäðîêñèäà íàòðèÿ, ñóëüôàòà íàòðèÿ,
êàðáîíàòà íàòðèÿ, õëîðèäà àììîíèÿ, íèòðàòà
ñâèíöà, õëîðèäà áàðèÿ, íèòðàòà ñåðåáðà. Èñïîëüçóÿ
èíäèêàòîðíóþ áóìàãó è ïðîâîäÿ ëþáûå ðåàêöèè
ìåæäó ðàñòâîðàìè â ïðîáèðêàõ, óñòàíîâèòü, êàêîå
âåùåñòâî ñîäåðæèòñÿ â êàæäîé èç íèõ.
12. Â äâóõ ïðîáèðêàõ èìåþòñÿ
ðàñòâîðû ãèäðîêñèäà íàòðèÿ è ñóëüôàòà àëþìèíèÿ.
Êàê èõ ðàçëè÷èòü, ïî âîçìîæíîñòè, áåç
èñïîëüçîâàíèÿ äîïîëíèòåëüíûõ âåùåñòâ, èìåÿ
òîëüêî îäíó ïóñòóþ ïðîáèðêó èëè äàæå áåç íåå?
13. Â ïÿòè ïðîíóìåðîâàííûõ
ïðîáèðêàõ íàõîäÿòñÿ ðàñòâîðû ïåðìàíãàíàòà
êàëèÿ, ñóëüôèäà íàòðèÿ, áðîìíàÿ âîäà, òîëóîë è
áåíçîë. Êàê, èñïîëüçóÿ òîëüêî íàçâàííûå ðåàêòèâû,
ðàçëè÷èòü èõ? Èñïîëüçóéòå äëÿ îáíàðóæåíèÿ
êàæäîãî èç ïÿòè âåùåñòâ èõ õàðàêòåðíûå ïðèçíàêè
(óêàæèòå èõ); äàéòå ïëàí ïðîâåäåíèÿ àíàëèçà.
Íàïèøèòå ñõåìû íåîáõîäèìûõ ðåàêöèé.
14. Â øåñòè ñêëÿíêàõ áåç
íàèìåíîâàíèé íàõîäÿòñÿ ãëèöåðèí, âîäíûé ðàñòâîð
ãëþêîçû, ìàñëÿíûé àëüäåãèä (áóòàíàëü), ãåêñåí-1,
âîäíûé ðàñòâîð àöåòàòà íàòðèÿ è 1,2-äèõëîðýòàí.
Èìåÿ â êà÷åñòâå äîïîëíèòåëüíûõ õèìè÷åñêèõ
ðåàêòèâîâ òîëüêî áåçâîäíûå ãèäðîêñèä íàòðèÿ è
ñóëüôàò ìåäè, îïðåäåëèòå, ÷òî íàõîäèòñÿ â êàæäîé
ñêëÿíêå.
Ðåøåíèÿ
1. Äëÿ îïðåäåëåíèÿ âîäû è
ñåðíîé êèñëîòû ìîæíî èñïîëüçîâàòü ðàçëè÷èå â
ôèçè÷åñêèõ ñâîéñòâàõ: òåìïåðàòóðàõ êèïåíèÿ è
çàìåðçàíèÿ, ïëîòíîñòè, ýëåêòðîïðîâîäíîñòè,
ïîêàçàòåëå ïðåëîìëåíèÿ è ò. ï. Ñàìîå ñèëüíîå
ðàçëè÷èå áóäåò â ýëåêòðîïðîâîäíîñòè.
2. Ïðèëüåì ê ïîðîøêàì â
ïðîáèðêàõ ñîëÿíóþ êèñëîòó. Ñåðåáðî íå
ïðîðåàãèðóåò. Ïðè ðàñòâîðåíèè æåëåçà áóäåò
âûäåëÿòüñÿ ãàç: Fe + 2HCl = FeCl2 + H2
Îêñèä æåëåçà (III) è îêñèä ìåäè (II) ðàñòâîðÿþòñÿ áåç
âûäåëåíèÿ ãàçà, îáðàçóÿ æåëòî-êîðè÷íåâûé è
ñèíå-çåëåíûé ðàñòâîðû: Fe2O3 + 6HCl = 2FeCl3
+ 3H2O; CuO + 2HCl = CuCl2 + H2O.
3. CuO è Ñ ÷åðíîãî öâåòà, NaCl è
ÂàÂr2 — áåëûå. Åäèíñòâåííûì ðåàêòèâîì ìîæåò
áûòü, íàïðèìåð, ðàçáàâëåííàÿ ñåðíàÿ êèñëîòà H2SO4:
CuO + H2SO4 = CuSO4 + H2O (ãîëóáîé
ðàñòâîð); BaCl2 + H2SO4 = BaSO4 + 2HCl (áåëûé
îñàäîê).
Ñ ñàæåé è NaCl ðàçáàâëåííàÿ ñåðíàÿ êèñëîòà íå
âçàèìîäåéñòâóåò.
4. Íåáîëüøîå êîëè÷åñòâî
êàæäîãî èç âåùåñòâ ïîìåùàåì â âîäó:
Äâà âåùåñòâà õëîðèä íàòðèÿ è õëîðèä
àììîíèÿ ðàñòâîðÿþòñÿ, íå ðåàãèðóÿ ñ âîäîé; èõ
ìîæíî ðàçëè÷èòü, íàãðåâàÿ ñóõèå ñîëè (õëîðèä
àììîíèÿ âîçãîíÿåòñÿ áåç îñòàòêà): NH4Cl NH3 + HCl; èëè ïî
îêðàñêå ïëàìåíè ðàñòâîðàìè ýòèõ ñîëåé
(ñîåäèíåíèÿ íàòðèÿ îêðàøèâàþò ïëàìÿ â æåëòûé
öâåò).
5. Ñîñòàâèì òàáëèöó ïîïàðíûõ
âçàèìîäåéñòâèé óêàçàííûõ ðåàãåíòîâ
| Âåùåñòâà | 1. NaOH | 2 ÍÑl | 3. Ê2ÑÎ3 | 4. Àl2(SO4)3 | Îáùèé ðåçóëüòàò íàáëþäåíèÿ |
| 1, NaOH | X | | | Al(OH)3 | 1 îñàäîê |
| 2. ÍÑ1 | _ | X | CO2 | __ | 1 ãàç |
| 3. Ê2ÑÎ3 | | CO2 | X | Al(OH)3 CO2 | 1 îñàäîê è 2 ãàçà |
| 4. Al2(S04)3 | À1(ÎÍ)3 | | À1(ÎÍ)3 CO2 | X | 2 îñàäêà è 1 ãàç |
| NaOH + HCl = NaCl + H2O | |||||
| Ê2ÑO3 + 2HC1 = 2ÊÑ1 + Í2O + ÑO2 | |||||
3K2CO3 + Al2(SO4)3 + 3H2O
= 2 Al(OH)3 + 3CO2 + 3K2SO4;
| Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4 | (íàëè÷èå îñàäêà çàâèñèò îò ïîðÿäêà ñëèâàíèÿ è èçáûòêà è ùåëî÷è) |
| Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2] |
Èñõîäÿ èç ïðåäñòàâëåííîé òàáëèöû ïî
÷èñëó âûïàäåíèÿ îñàäêà è âûäåëåíèÿ ãàçà ìîæíî
îïðåäåëèòü âñå âåùåñòâà.
6. Ïîïàðíî ñìåøèâàþò âñå
ðàñòâîðû Ïàðà ðàñòâîðîâ, äàþùàÿ ìàëèíîâóþ
îêðàñêó, NaOH è ôåíîëôòàëåèí Ìàëèíîâûé ðàñòâîð
ïðèáàâëÿþò â äâå îñòàâøèåñÿ ïðîáèðêè. Òàì, ãäå
îêðàñêà èñ÷åçàåò, ñåðíàÿ êèñëîòà, â äðóãîé
ñóëüôàò íàòðèÿ. Îñòàåòñÿ ðàçëè÷èòü NaOH è
ôåíîëôòàëåèí (ïðîáèðêè 1 è 2).
À. Èç ïðîáèðêè 1 ïðèáàâëÿþò êàïëþ ðàñòâîðà ê
áîëüøîìó êîëè÷åñòâó ðàñòâîðà 2.
Á. Èç ïðîáèðêè 2 êàïëþ ðàñòâîðà ïðèáàâëÿþò ê
áîëüøîìó êîëè÷åñòâó ðàñòâîðà 1.  îáîèõ ñëó÷àÿõ
ìàëèíîâîå îêðàøèâàíèå.
Ê ðàñòâîðàì À è Á ïðèáàâëÿþò ïî 2 êàïëè ðàñòâîðà
ñåðíîé êèñëîòû. Òàì, ãäå îêðàñêà èñ÷åçàåò,
ñîäåðæàëàñü êàïëÿ NaOH. (Åñëè îêðàñêà èñ÷åçàåò â
ðàñòâîðå À, òî NaOH â ïðîáèðêå 1).
7.
| Âåùåñòâà | Fe | Zn | ÑàÑÎ3 | Ê2ÑÎ3 | Na2SO4 | NaCl | NaNO3 |
| Âà(ÎÍ)2 | îñàäîê | îñàäîê | ðàñòâîð | ðàñòâîð | |||
| NaOH | âîçìîæíî âûäåëåíèå âîäîðîäà | ðàñòâîð | ðàñòâîð | ðàñòâîð | ðàñòâîð | ||
| Îñàäêà íåò â ñëó÷àå äâóõ ñîëåé ó Âà(ÎÍ)2 è â ñëó÷àå ÷åòûðåõ ñîëåé Ó NaOH | òåìíûå ïîðîøêè (ðàñòâñâîðÿþùèéñÿ â ùåëî÷àõ — Zn, íåðàñòâîðÿþùèéñÿ â ùåëî÷àõ — Fe) | ÑàÑÎ3 äàåò îñàäîê ñ îáåèìè ùåëî÷àìè | äàþò ïî îäíîìó îñàäêó, ðàçëè÷àþòñÿ ïî îêðàøèâàíèþ ïëàìåíè: Ê+- ôèîëåòîâîå, Na+ — æåëòîå | îñàäêîâ íå äàþò; ðàçëè÷àþòñÿ ïîâåäåíèåì ïðè íàãðåâàíèè (NaNO3 ïëàâèòñÿ, à ïîòîì ðàçëàãàåòñÿ ñ âûäåëåíèåì Î2, çàòåì NÎ2 | |||
8. Áóðíî ðåàãèðóþò ñ âîäîé: Ð2Î5
è ÑàÎ ñ îáðàçîâàíèåì ñîîòâåòñòâåííî H3PO4
è Ñà(ÎÍ)2:
Ð2O5 + 3Í2Î = 2Í3ÐO4,
ÑàÎ + Í2Î = Ñà(ÎÍ)2.
Âåùåñòâà (3) è (4) -Pb(NO3)2 è ÑàÑl2 —
ðàñòâîðÿþòñÿ â âîäå. Ðàñòâîðû ìîãóò ðåàãèðîâàòü
äðóã ñ äðóãîì ñëåäóþùèì îáðàçîì:
Òàêèì îáðàçîì, ðàñòâîð 1 (H3PO4)
îáðàçóåò îñàäêè ñî âñåìè äðóãèìè ðàñòâîðàìè ïðè
âçàèìîäåéñòâèè. Ðàñòâîð 3 Pb(NO3)2
òàêæå îáðàçóåò îñàäêè ñî âñåìè äðóãèìè
ðàñòâîðàìè. Âåùåñòâà: I Ð2O5, II ÑàÎ,
III Pb(NO3)2, IVÑàÑl2.
 îáùåì ñëó÷àå âûïàäåíèå áîëüøèíñòâà îñàäêîâ
áóäåò çàâèñåòü îò ïîðÿäêà ñëèâàíèÿ ðàñòâîðîâ è
èçáûòêà îäíîãî èç íèõ (â áîëüøîì èçáûòêå Í3ÐÎ4
ôîñôàòû ñâèíöà è êàëüöèÿ ðàñòâîðèìû).
9. Çàäà÷à èìååò íåñêîëüêî
ðåøåíèé, äâà èç êîòîðûõ ïðèâåäåíû íèæå.
à. Âî âñå ïðîáèðêè äîáàâëÿåì ðàñòâîð
ìåäíîãî êóïîðîñà:
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 (ãîëóáîé
îñàäîê);
Na2S + CuSO4 = Na2SO4 + CuS (÷åðíûé
îñàäîê);
NaCl + CuSO4 (â ðàçáàâëåííîì ðàñòâîðå èçìåíåíèé
íåò);
4NaI+2CuSO4 = 2Na2SO4 + 2CuI+I2 (êîðè÷íåâûé îñàäîê);
4NH3 + CuSO4 = Cu(NH3)4SO4
(ñèíèé ðàñòâîð èëè ãîëóáîé îñàäîê,
ðàñòâîðèìûé â èçáûòêå ðàñòâîðà àììèàêà).
á. Âî âñå ïðîáèðêè äîáàâëÿåì ðàñòâîð
íèòðàòà ñåðåáðà:
2NaOH + 2AgNO3 = 2NaNO3 + Í2Î + Ag2O
(êîðè÷íåâûé îñàäîê);
Na2S + 2AgNO3 = 2NaNO3 + Ag2S
(÷åðíûé îñàäîê);
NaCl + AgNO3 = NaN03 + AgCl (áåëûé îñàäîê);
NaI + AgNO3 = NaNO3 + AgI(æåëòûé îñàäîê);
2NH3 + 2AgNO3 + H2O = 2NH4NO3 + Ag2O
(êîðè÷íåâûé îñàäîê).
Ag2O ðàñòâîðÿåòñÿ â èçáûòêå ðàñòâîðà
àììèàêà: Ag20 + 4NH3 + H2O = 2[Ag(NH3)2]OH.
10. Äëÿ ðàñïîçíàâàíèÿ ýòèõ âåùåñòâ
ñëåäóåò ïðîâåñòè ðåàêöèè âñåõ ðàñòâîðîâ äðóã ñ
äðóãîì:
NaOH è Âà(ÎÍ)2 ìîæíî ðàçëè÷èòü ïî
ðàçíîìó îêðàøèâàíèþ ïëàìåíè (Na+ îêðàøèâàþò â
æåëòûé öâåò, à Âà2+ â çåëåíûé).
11. Îïðåäåëÿåì êèñëîòíîñòü ðàñòâîðîâ
ñ ïîìîùüþ èíäèêàòîðíîé áóìàãè:
1) êèñëàÿ ñðåäà ÍÑl, NH4C1, Pb(NO3)2;
2) íåéòðàëüíàÿ ñðåäà Na2SO4, ÂàÑ12,
AgNO3;
3) ùåëî÷íàÿ ñðåäà Na2CO3, NaOH.
Ñîñòàâëÿåì òàáëèöó:
12. Â ïóñòóþ ïðîáèðêó íàëèâàþò
îäèí èç ðàñòâîðîâ è ïðèëèâàþò êàïëþ äðóãîãî.
Ñ ë ó ÷ à é ï å ð â û é : îáðàçîâàëñÿ îñàäîê
è ñðàçó ðàñòâîðèëñÿ, èëè âîâñå íå îáðàçîâàëñÿ:
6NaOH + Al2(SO4)3 3Na2SO4 + 2Al(OH)3;
Al(OH)3 + NaOH (èçáûòîê) + 2Í2Î Na[Al(OH)4(H2O)2].
Çíà÷èò, ðàñòâîð (1)NaOH, ðàñòâîð (2) Al2(SO4)3.
Ñ ë ó ÷ à é â ò î ð î é : îñàäîê
îáðàçîâàëñÿ è íå ðàñòâîðèëñÿ. Òîãäà, íàîáîðîò,
ðàñòâîð (1) Al2(SO4)3, à ðàñòâîð
(2)NaOH.
13. Ïî öâåòó îïðåäåëÿþò ÊÌïÎ4
(ðîçîâî-ôèîëåòîâûé) è áðîìíóþ âîäó (æåëòàÿ èëè
êðàñíî-áóðàÿ).
Ðàñòâîð áðîìà â âîäå îïðåäåëèòñÿ ñðàçó ïðè
âçàèìîäåéñòâèè ñ Na2S:
Na2S + Br2 2NaBr+S; (áåëûé èëè ñâåòëî-æåëòûé îñàäîê).
Ðàñòâîð ÊÌnÎ4 îáåñöâå÷èâàåòñÿ Na2S è
òîëóîëîì ïðè êèïÿ÷åíèè:
2KMnO4 + 3Na2S + 4H2O 2MnO2 + 3S + 2KOH + 6NaOH;
| [Î] | ||
| Ñ6Í5ÑÍ3 | Ñ6Í5ÑÎÎÍ. |
Îñòàâøååñÿ âåùåñòâî áåíçîë.
14. Ïðèáàâèì ïîñëåäîâàòåëüíî ñóëüôàò
ìåäè è èçáûòîê ãèäðîêñèäà íàòðèÿ êî âñåì
âåùåñòâàì. Ñ ãåêñåíîì-1, àöåòàòîì íàòðèÿ,
1,2-äèõëîðýòàíîì ðåàêöèÿ èäòè íå áóäåò, íî â âîäíîì
ðàñòâîðå àöåòàòà íàòðèÿ ñóëüôàò ìåäè
ðàñòâîðèòñÿ. Â ïðîáèðêå ñ áó-òàíàëåì ïðè
íàãðåâàíèè âûïàäàåò êðàñíûé îñàäîê îêñèäà
ìåäè(1). Â ïðîáèðêàõ ñ ãëèöåðèíîì è ãëþêîçîé
ïîëó÷èòñÿ òåìíî-ñèíèé ðàñòâîð. Ïðè íàãðåâàíèè
ðàñòâîðà ãëþêîçû ñ äîáàâëåííûìè ðåàãåíòàìè
âûïàäàåò îêñèä ìåäè(1). Îñòàâøèåñÿ âåùåñòâà, íå
ñìåøèâàþùèåñÿ äðóã ñ äðóãîì, ìîæíî ðàçëè÷èòü ïî
ïëîòíîñòè: ãåêñåí-1 èìååò íàèìåíüøóþ ïëîòíîñòü, à
1,2-äèõëîðýòàí íàèáîëüøóþ.
