В какой массе гидроксида натрия содержится столько же эквивалентов
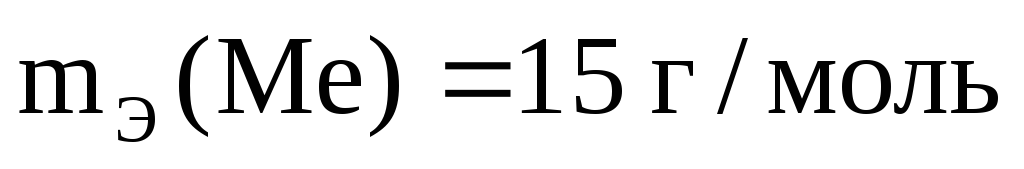
mэ(KOH)
= М(KOH)/кислотность
= 56/1 = 56 г/моль.
Эквивалентную
массы кислоты определим исходя из закона
эквивалентов: m(KOH)/m(кислоты)
=mэ(KOH)/mэ(кислоты)
![]() =
=
![]()
![]() =
=
![]() = 49 г/моль
= 49 г/моль
Пример 4.
Определите
массу металла, вступившего в реакцию с
кислотой, если при этом выделился водород
объёмом 260 мл при нормальных условиях.
Эквивалентная масса металла mэ(Ме)
= 9 г/моль.
Решение.
Согласно
закону эквивалентов массы (объёмы)
реагирующих друг с другом веществ
пропорциональны их эквивалентным массам
(объёмам).
![]() =
=![]() ,
,
где VЭ(H2)
– эквивалентный объём водорода равный
11,2 л.
m(Me)
=
![]()
= 90,26/11,2
= 0,2 г.
Пример 5.
Эквивалентная
масса металла составляет 63,5 г/моль.
Вычислите массовую долю металла
(Ме) в его оксиде.
Решение.
Массовая
доля кислорода в оксиде металла будет
равна
100 −
(Ме). Согласно закону эквивалентов:
![]() .
.
Эквивалентная
масса кислорода mэ(О)
= 16/2 = 8 г/моль.
Из уравнения
выразим массовую долю металла
![]() =
=
![]()
8(Ме)
= 6350 – 63,5 (Ме)
71,5(Ме)
= 6350
(Ме) =
![]() =
=
88,8 %
Пример 6. Из
3,85 г нитрата металла получено 1,60 г его
гидроксида. Вычислите эквивалентную
массу металла.
Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Эквивалент
(эквивалентная масса) гидроксида равен
сумме эквивалентов (эквивалентных масс)
металла и гидроксильной группы.
Эквивалент
(эквивалентная масса) соли равен сумме
эквивалентов (эквивалентных масс)
металла и кислотного остатка.
Согласно закону
эквивалентов:
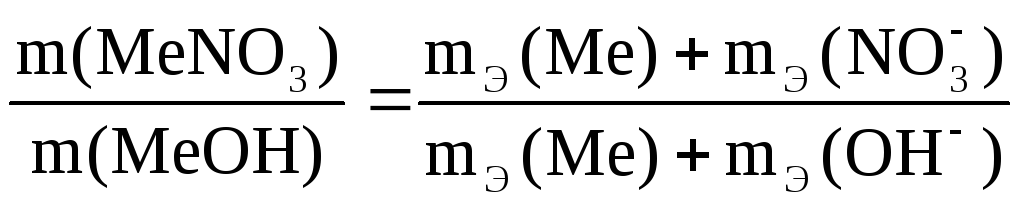
![]()
![]()
![]()
![]()
Вариант 1
Определите
эквивалентную массу металла в следующих
соединениях: Mn2O7,
Ba(OH)2,
Ca3(PO4)2,
FeSO47H2O.При восстановлении
водородом 1,34 г оксида металла до металла
образовалось 0,324 г воды. Определите
эквивалентную массу металла.Алюминий массой
0,752 г при взаимодействии с кислотой
вытеснил водород объёмом 0,936 л (н.у.).
Определите эквивалентную массу алюминия.
Вариант 2
Вычислите
эквивалентную массу гидроксида
висмута(III)
в реакциях взаимодействия с HCl
при получении хлорида висмута и
гидрохлорида висмута.Элемент образует
гидрид, где его массовая доля 75 %.
Определите эквивалентную массу элемента.При растворении
в кислоте металла массой 11,9 г выделился
водород объёмом 2,24 л (н.у.). Определите
эквивалентную массу металла.
Вариант 3
Чему равна
эквивалентная масса ZnSO4
в реакциях со щелочью, идущих с
образованием Zn(OH)2,
(ZnOH)2SO4,
Na2[Zn(OH)4].Для растворения
металла массой 16,86 г потребовалась
серная кислота массой 14,7 г. Вычислите
эквивалентную массу металла.На сжигание 0,5 г
двухвалентного металла требуется 0,23
л кислорода (н.у.). Определите эквивалентную
массу металла, укажите какой это металл.
Вариант 4
Определите
эквивалент и эквивалентную массу серы
в следующих соединениях: H2S,
SO2,
H2SO4.Металл массой
0,150 г вытесняет из раствора никелевой
соли никель массой 0,367 г, а из раствора
кислоты – водород объёмом 140 мл (н.у.).
Определите эквивалентную массу никеля.Оксид марганца
содержит 22,56 % кислорода. Вычислите
эквивалентную массу марганца в оксиде
и составьте его формулу.
Вариант 5
Эквивалентная
масса некоторого элемента равна 24,99
г/моль. Вычислите: а) массовую долю
кислорода в оксиде этого элемента;
б) объём водорода, который потребуется
для восстановления 4,95 г его кислородного
соединения.Вычислите
эквивалентную массу H3PO4
в реакциях взаимодействия с КОН при
получения: а) фосфата калия; б)
дигидрофосфата калия; в) гидрофосфата
калия.На нейтрализацию
1 г основания израсходовано 2,14 г соляной
кислоты. Определите эквивалентную
массу основания.
Вариант 6
Мышьяк образует
два оксида, массовая доля мышьяка в
которых соответственно равна 65,2 и 75,7
%. Рассчитайте эквивалентную массу
мышьяка в этих оксидах.Найдите эквивалентную
массу воды при реакции её а) с металлическим
натрием; б) с оксидом натрия.Вычислите
эквивалентную массу цинка, если 1,168 г
его вытеснили из кислоты 43,8 мл водорода,
измеренного при н.у.
Вариант 7
На нейтрализацию
0,943 г фосфористой кислоты H3PO4
израсходовано 1,291 г гидроксида калия.
Вычислите эквивалентную массу кислоты
и её основность.Вычислите эквивалент
и эквивалентную массу хлорида алюминия
в реакциях:
а)
AlCl3
+
2NaOH = Al(OH)2Cl
+ 2NaCl;
б)
AlCl3
+ 3NaOH = Al(OH)3
+ 3 NaCl.
3. Чему равна
эквивалентная масса металла, если его
навеска массой 20 г вытесняет из кислоты
водород объемом 7,01 л при н.у.
Вариант 8
На осаждение
хлорида, содержащегося в 0,666 г соли,
израсходовано 1,088 г. Вычислите
эквивалентную массу соли.
2. Определите
эквивалент и эквивалентную массу
гидроксида никеля в реакциях:
а)
Ni(OH)2
+ H2SO4
= NiSO4
+ 2H2O;
б)
2Ni(OH)2
+ H2SO4
=
(NiOH)2SO4
+ 2H2O.
3. Эквивалентная
масса металла равна 29,36 г/моль. Сколько
граммов этого металла необходимо для
вытеснения 105 мл водорода (н.у.) из кислоты?
Вариант 9
Определите
эквивалентную массу двухвалентного
металла, если из 48,15 г его оксида можно
получить 88,65 г его нитрата. Укажите,
какой это металл.Вычислите
эквивалентную массу металла в следующих
соединениях: Ag2O,
Al2(SO4)318H2O,
CuCl.Сколько эквивалентных
масс кислорода содержится в 33,6 л его
(н.у.)?
Вариант 10
Массовые доли
галогена в галогениде металла
соответственно равны 64,5 и 15,4 %. Определите
эквивалентную массу металла, массу
металла и объём выделившегося водорода
(н.у.).Для растворения
16,8 г металла потребовалось 14,7 г серной
кислоты. Определите эквивалентную
массу металла и объём выделившегося
водорода (н.у.).В каком количестве
Cr(OH)3
содержится столько же эквивалентов,
сколько в 174,96 г Mg(OH)2?
Вариант 11
Определите
эквивалент и эквивалентную массу
фосфора, кислорода и брома в соединениях
PH3,
H2O,
HBr.При пропускании
H2S
через раствор, содержащий 2,98 г хлорида
некоторого одновалентного металла,
образуется 2,2 г его сульфида. Вычислите
эквивалентную массу металла.Сколько металла,
эквивалентная масса которого 12,16 г/моль,
взаимодействует с 310 см3
кислорода (н.у.).
Вариант12
В состав оксида
серебра входит 93,09 % серебра, а в состав
иодида серебра – 45,95 % серебра. Найдите
эквивалентную массу йода.В какой массе
гидроксида натрия содержится столько
же эквивалентных масс, сколько содержится
в 140 г КОН.На сжигания 1,5 г
двухвалентного металла требуется 0,69
л кислорода (н.у.). Вычислите эквивалентную
массу и атомную массу этого металла.
Вариант 13
Напишите уравнения
реакций Fe(OH)3
с соляной кислотой, при которых
образуется: а) хлорид дигидроксожелеза;
б) хлорид железа (III).
Вычислите эквивалент и эквивалентную
массу Fe(OH)3
в этих реакциях.Определите
эквивалентную массу серы, если 6,48 г
металла образует 6,96 г оксида и 7,44 г
сульфида.При взаимодействии
3,24 г трёхвалентного металла с кислотой
выделяются 4,03 л водорода (н.у.). Вычислите
эквивалентную и атомную массы металла.
Вариант 14
Из 1,35 г оксида
металла получается 3,15 г его нитрата.
Вычислите эквивалентную массу этого
металла.Избытком соляной
кислоты подействовали на растворы: а)
гидрокарбоната кальция; б) дихлорида
гидроксоалюминия. Напишите уравнения
реакций этих веществ с HCl
и определите их эквивалентные массы.Сколько граммов
металла, эквивалентная масса которого
12 г/моль, взаимодействует с 3,1 л кислорода
(н.у.).
Вариант 15
4,086г металла
вытесняют из кислоты 1,4 л водорода,
измеренного при н.у. Эта же масса металла
вытесняет 12,95 г свинца из растворов его
солей. Вычислите эквивалентную массу
свинца.Вычислите эквивалент
и эквивалентную массу бора, хрома и
кальция в соединениях: B2O3;
Cr(OH)3;
Ca3(PO4)2.Сколько эквивалентных
масс содержится в 340 г нитрата серебра?
Вариант 16
При восстановлении
4,34 г оксида марганца алюминием получено
3,4 г оксида алюминия Al2O3.
Вычислите эквивалентную массу марганца,
его валентность и составьте формулу
оксида марганца.При окислении
0,24 г металла израсходовано 112 мл кислорода
(н.у.). Определите эквивалентные массы
металла и его оксида.Эквивалентная
масса элемента составляет 24,99 г/моль.
Вычислите, сколько граммов водорода
требуется для восстановления 4,95 г его
соли.
Вариант 17
Эквивалентная
масса металла равна 56,2 г/моль. Вычислите
процентное содержание этого металла
в его оксиде.
2. Определите
эквивалент и эквивалентную массу
гидроксида алюминия в реакциях:
а)
Al(OH)3
+ HNO3
= AlOH(NO3)2
+ H2O;
б)
Al(OH)3
+ 3HNO3
= Al(NO3)3
+ 3H2O.
3. Одна и та же
масса металла соединяется с 1,591 г галогена
и с 70,2 мл кислорода (н.у.). Вычислите
эквивалент галогена.
Вариант 18
На восстановление
2,33 г хлорида циркония до свободного
израсходовано 0,48 г магния. Эквивалентная
масса магния равна 12 г/моль. Определите
эквивалент циркония и его валентность.Вычислите
эквивалентную массу KHSO4
в следующих реакциях:
а)
KHSO4
+ BaCl2
= BaSO4
+ KCl + HCl;
б)
KHSO4
+ KOH = K2SO4
+ H2O.
3. Элемент образует
оксид, содержащий 31,58 % кислорода.
Вычислите эквивалент элемента.
Вариант 19
Определите
эквивалентные массы следующих кислот:
HClO;
H2SiO3;
HMnO4;
H2SnO3.Вещество содержит
39 % серы, эквивалентная масса которой
16 г/моль и мышьяк. Вычислите эквивалентную
массу и валентность мышьяка, составьте
формулу этого вещества.1 г металла
соединяется с массой хлора, занимающей
объём 336 мл (н.у.). Вычислите эквивалент
металла.
Вариант 20
При сгорании серы
в кислороде образовалось 12,8 г SO2.
Сколько эквивалентов кислорода требуется
на эту реакцию. Чему равны эквиваленты
серы и её оксида.Определите
эквивалентную массу H2SO3
в реакциях образования: а) сульфита
лития; б) гидросульфита лития.0,934 г металла
вытеснили из соляной кислоты 348 мл
водорода (н.у.). Вычислите эквивалент
металла.
Вариант 21
Путём разложения
нагреванием 0,26 г оксида серебра получено
0,243 г металлического серебра. Определите
эквивалентную массу серебра.Вычислите
эквивалентную массу гидроксида меди(II)
в реакциях взаимодействия с HCl
при получении а) хлорида меди; б)
гидроксохлорида меди.Эквивалент металла
равен 8,99. Какой объём водорода (н.у.)
выделится при взаимодействии 0,4495 г
металла с соляной кислотой.
Вариант 22
При взаимодействии
ортофосфорной кислоты со щелочью
образовалось соль Na2HPO4.
Найти для этой реакции эквивалентную
массу ортофосфорной кислоты.В состав метана
входит 25 % водорода и 75 % углерода. Чему
равна эквивалентная масса углерода.Вычислите эквивалент
металла и его оксида, зная, что 0,304 г
металла вытесняет из кислоты 0,282л
кислорода (н.у.).
Вариант 23
Определите
эквивалентную массу гидроксида магния
в реакциях:
а)
Mg(OH)2
+ HBr = MgOHBr +H2O;
б)
Mg(OH)2
+ 2HBr = MgBr2
+ 2 H2O.
2. При восстановлении
1,506 г оксида олова водородом образовалось
0,36 г воды. Определите эквивалентную
массу олова и его валентность. Напишите
формулу оксида олова.
3. Какой объём
водорода (н.у.) выделится при взаимодействии
3,6 г металла с кислотой, эквивалентная
масса которого равна 12 г/моль?
Вариант 24
Определите
эквивалентные массы следующих солей:
NaNO2,
Cr2(SO4)3,
CH3COOH,
MgOHNO3,
LiHSO4.Эквивалентная
масса металла равна 56,2 г/моль. Вычислите
процентное содержание этого металла
в его оксиде.При взаимодействии
3,182 г галогена израсходовано 140,4 мл
кислорода (н.у.). Вычислите эквивалент
галогена и назовите его.
Вариант 25
Эквивалентная
масса металла равна 29,36 г/моль. Сколько
граммов этого металла необходимо для
вытеснения 105 мл водорода (н.у.)?Определите
эквивалент фосфора в соединениях: PH3,
P2O5,
P2O3,
H3PO3.Одна и та же масса
металла соединяется с 1,591 г галогена и
70,2 см3
кислорода при н.у. Вычислите эквивалентную
массу галогена.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
| Элемент или сложное вещество | ЭквивалентЭ, | Молярная масса (М экв.) эквивалента,[г/моль] |
| Элемент Например, Са | Ээл = 1? f =1/В Э (Ca) = 1/2 | Мэкв =M ? f = M/В М(½Ca) = 40/2 = = 20 г/моль |
| Кислота Например, H2S | Э кислоты = 1? f = = 1/основность Э кислоты = 1? f = =1/основность | Мэкв =M ? f = M/основность М(½Н2S).=34 ? 1/2 = = 17 г/моль |
| Основание Например, Са(OH)2 | Эосн = 1? f = = 1/кислотность Э [Ca(OH)2] = 1/2 | Мэкв =M ? f = = M/кислотность М[½Ca(OH)2] = = 74 / 2 = 37 г/моль |
| Соль Например, Al2S3 | Эсоли = 1? f = 1 / n ? В = = Э [Al2S3] = 1/2 ? 3 = 1/6 | Мэкв =M ? f = = M / n ? В М(1/6 Al2S3) = = 150 / 6 = 25 г/моль |
Эквивалент и молярная масса эквивалента сложного вещества определяются конкретной реакцией, в которой участвует данное вещество.
Пример 1.
Чему равен эквивалент и молярная масса эквивалента серной кислоты в реакциях с раствором щелочи, если образуется:
а) NаНSО4 и б) Nа2SО4?
Решение.
А) В реакции с образованием гидросульфата натрия серная кислота нейтрализуется не полностью:
Н2SО4 + NаОН = NаНSO4 + Н2О.
В этой реакции серная кислота проявляет основность равную 1. Из этого следует, что фактор эквивалентности этой кислоты в данной реакции равен 1. Найдем значение эквивалента кислоты в данной реакции:
Э (H2SO4) =1? f = 1/основность = 1.
Найдем значение молярной массы эквивалента кислоты:
Мэкв (H2SO4) =M ? f = M/основность = 98/1 = 98 г/экв,
б) Сульфат натрия образуется при полной нейтрализации кислоты:
Н2SО4 + 2NаОН = Na2SO4 +2Н2О.
В этой реакции основность, проявляемая Н2SO4, равна 2 и значение фактора эквивалентности в этом случае равно 2.
Отсюда:
Э (H2SO4) =1 ? f = 1/основность = 1/2 моль,
Мэкв (½H2SO4) = M/основность = 98/2= 49 г/моль.
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента (Vэкв).
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях. Размерность молярного объема эквивалента [л/моль].
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г.
Пример 2.
Используя следствие из закона Авогадро, рассчитать объем, занимаемый одним эквивалентом водорода.
Решение.
1 моль молекул Н2 имеет массу 2 г и занимает объем 22,4 л, а объем, занимаемый одним эквивалентом водорода (одним моль атомов элемента водорода), который имеет массу 1 г, найдем из пропорции:
2 г Н2 → 22,4 л
1 г Н2 → х л
x = 11,2 л, т.е. Vэкв (H) =11,2 л/моль.
Аналогично можно рассчитать молярный объем эквивалента для кислорода, который будет равен:
Vэкв (½O) = 5,6 л/моль.
Введение в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов: массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:
где m1 и m2 — массы взаимодействующих веществ; Мэкв.1 и Мэкв.2 — молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием «молярный объем эквивалента» и следующей формулировкой закона эквивалентов: объемы реагирующих друг с другом газообразных веществ пропорциональны молярным объемам их эквивалентов.
V1/V2 = Vэкв1/Vэкв2 , где
V1 и V2 — объемы реагирующих газообразных веществ,
Vэкв1 и Vэкв2 — молярные объемы их эквивалентов.
Пример 3.
Выразите в молях:
а) 6,02·1021 молекул СО2;
б) 1,20·1024 атомов кислорода;
в) 2,00·1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02·1023). Отсюда
а) 6,02·1021, т.е. 0,01 моль;
б) 1,20·1024, т.е. 2 моль;
в) 2,00·1023, т.е. 1 /З моль.
Масса моля вещества выражается в г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а.е.м., то их мольные (молярные) массы равны:
а) 44 г/моль;
б) 18г/моль;
в) 16 г/моль.
Пример 4.
Вычислите значение грамм-эквивалента серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
ЭH2SO4 =МH2SO4 /2=98/2=49г
ЭСа(OH)2 =МСа(OH)2 /2=74/2=37г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Пример 5.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Решение.
Нормальные условия по Международной системе единиц (СИ): давление 1,013·105 Па (760 мм Т. Ст., 1 атм), температура 273 К или 0°С.
Согласно закону эквивалентов
m1/Мэ(1) = m2/Мэ(2)
m(МеО)/Мэ(МеО) = m(Н2)/Мэ(Н2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (мл, л, м 3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. Отношение mH2 /МЭ(Н2) заменяем равным ему отношением VH2 /VЭ(Н2), где VH2 – объем водорода, VЭ(Н2) эквивалентный объем водорода:
m(МеО)/Мэ(МеО) = V(Н2)/Vэ(Н2)
Находим эквивалентную массу оксида металла МЭ(МеО)
7,09/МЭ(МеО) = 2,24/11,2; МЭ(МеО) = 7,09·11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов МЭ(МeO) = МЭ(Мe) + МЭ(O2),
отсюда МЭ(Мe) = МЭ(МeО) – МЭ(O2) = 35,45 – 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения:
МЭ = А/В,
где: МЭ – эквивалентная масса, г/моль
А – мольная масса металла, г/моль
В – валентность элемента;
А = Мэ·В = 27,45•2 = 54,9 г/моль.
Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 6.
При 25 0С и давлении93 кПа. (745 мм Т. Ст.) некоторое количество газа занимает объем 152 мл. Найти, какой объем займет это же количество газа при 0 0С и давлении 101,33 кПа.
Решение.
Подставляя данные задачи в последнее уравнение, получаем:
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. 0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля. Ответ: 29,35 г/моль
2. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида. Ответ: Al2O3 ; 17 г/моль.
3. Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
H2SO4 + 2NaOH = Na2SO4 + 2H2O Ответ: 49 г/моль
2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O Ответ: 98 г/моль
Al(OH)3 + 3NaCl = AlCl3 + 3NaOH Ответ: = 26 г/моль
Zn(OH)2 + NaCl = ZnOHCl + NaOH Ответ: 99,4 г/моль
4. На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции. Ответ: 136,1 г/моль
5. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ(Ме)). Ответ: 15 г/моль.
6. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312г А1(ОН)3? Ответ: 444г.
7. Вычислите абсолютную массу молекулы серной кислоты в граммах. Ответ: 1,63* 10-22
8. На восстановление 3,6 г оксида двухвалентного металла израсходовано 1,7 л водорода (н.у.). Вычислить молярные массы эквивалента оксида и металла. Ответ: 15,72 г.
9. Объемное содержание углекислого газа в воздухе составляет 0,03% (н.у.). Найти количество (моль) и массу (г) СО2, содержащегося в 0,5 м3 воздуха. Ответ: 0,295 г.
10. Масса колбы вместимостью 750 мл, наполненной при 27°С кислородом, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода в колбе. Ответ: 124,65 кПа.
11. При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл. Ответ: 27 г.
12. 0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его. Ответ: галоген – I.
13. Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл. Ответ: металл – Mg.
14. 0,200 г двухвалентного металла вытеснили 197 см3 водорода, который был собран под водой и измерен при 20ºС и 780 мм Hg. Давление насыщенных паров воды при этих условиях составляет 17,4 мм Hg. Определите, какой это металл. Ответ: металл – Mg.
15. 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80 %? Ответ: 10,2 г.
16. Определите эквивалент и эквивалентные массы элементов в соединениях с водородом: H2O, HCl, PH3. Ответ: 8 г/моль, 35,5 г/моль, 10,3 г/моль.
17. Определите эквивалентные массы следующих соединений: CO2, H2SO4, Cu(OH)2, MgCl2.Ответ: 11 г/моль, 49 г/моль, 49 г/моль, 47,5 г/моль.
18. На нейтрализацию кислоты массой 2,18 г израсходовано KOH массой 2,49 г. Определите эквивалентную массу кислоты. Ответ: 49 г/моль.
19. Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл при нормальных условиях. Эквивалентная масса металла mэ(Ме) = 9 г/моль. Ответ: 0,2 г.
20. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла. Ответ: 15 г/моль.
21. При взаимодействии магния с кислородом образуется оксид магния. Определите массу магния, необходимую для реакции с кислородом массой 64 г, а также массу образующегося при этом оксида. Ответ: m (Мg) = 96 г, m (MgO) = 160г.
22. Чему равны массы цинка и серы, необходимые для получения сульфида цинка массой 485 г? Ответ: m (MgO) = 325 г, m (S) = 160 г.
23. Определите массу хлорида калия, образующегося при взаимодействии хлористого водорода массой 219 г с раствором, содержащим гидроксид калия массой 224 г. Ответ: 298 г.
24. При 25°С и давлении 745 мм Т. Ст. некоторое количество газа занимает объем 152 мл. Вычислить, какой объем займет это же количество газа при нормальных условиях. Ответ: 136,5 мл.
25. Чему равны значения а) относительной плотности хлора по воздуху, б) массы 1 л хлора (при н.у.), в) объема 1 л хлора (при н.у.). Ответ: а) 2,45; б) 3,17 г; в) 0,3 л.
26. При растворении металла массой 0,0548 г в избытке раствора кислоты выделялся водород объемом 50,4 мл (н.у.). Вычислите значение молярной массы эквивалента металла. Ответ: 12,17 г/моль.
27. Вычислить эквивалент и молярную массу эквивалента ортофосфорной кислоты в реакциях: а) с магнием, б) с гидроксидом калия, если при этом образуется кислая соль K2HPO4. Ответ: а) 32,67 г/моль; б) 49 г/моль.
28. При окислении металла массой 8,43 г образовался оксид массой 9,63 г. Вычислите значения молярных масс эквивалентов металла и его оксида. Ответ: 64,2 г/экв.
29. Вычислите значения относительной атомной массы и молярной массы эквивалента некоторого элемента, зная, что массовая доля данного элемента в его оксиде составляет 46,74 % и что на один атом его в оксиде приходится два атома кислорода. Ответ: 28,08 г/моль.
30. Масса 0,327 ·10-3 м3 газа, при 13 оС и давлении 1,04 ·105 Па равна 0,828 ·10-3 кг. Вычислить молярную массу газа. Ответ: 57,8 * 10-3 кг/моль.
