Свойства каких паров ближе к свойствам газов

Физические законы и параметры газов являются основополагающими для создания вакуумных систем. Даже при крайне низких значениях давлений, используемых в вакуумной технике, физические процессы, протекающие в газах, подчиняются общим газовым законам. Необходимость создания вакуума обычно связана с потребностью уменьшения концентрации молекул газа или частоты их столкновений с поверхностью сосуда. Газовые процессы в вакуумных системах можно, как правило, рассматривать с точки зрения законов идеального газа, а некоторые общие физические процессы вакуумных систем могут быть описаны с помощью статических и динамических свойств газов. Физические процессы, протекающие в газах при низком давлении, а также различные параметры и свойства газового потока рассмотрены ниже.
Параметры состояния газа
Если взять образец газа, то для описания его состояния достаточно знать три из четырех параметров. Этими параметрами являются давление, объем, температура и количество газа.
Давление — это сила, с которой газ воздействует на единицу площади поверхности сосуда. В СИ единицей измерения давления является паскаль, или ньютон на квадратный метр (Н/м2). В вакуумной технике также используется единица измерения миллиметр ртутного столба, или Торр: 1 мм рт. ст. = 133 Па (1 Па = 7,5 мм рт. ст.).
Объем — мера пространства, которое занимает газ; обычно он задается размерами сосуда. Единицей объема в СИ является кубический метр (м3), однако для обозначения быстроты откачки и потока газа, а также других величин широко используются литры.
Температура газа при давлении ниже 1 Торр главным образом определяется температурой поверхностей, с которыми он соприкасается. Как правило, газ находится при комнатной температуре. При выводе уравнений, описывающих состояние газов, для измерения температуры используют Кельвины (К).
Количество газа в данном объеме измеряется в молях.
Моль — число граммов газа (или любого вещества), равное его молекулярной массе. Моль содержит 6,02 х 1023 молекул. Один моль любого газа при 0 °С и давлении 760 Торр занимает объем, равный 22,4 л. Масса 1 моля газа равна его молекулярной массе в граммах.
Молярный объем является универсальной постоянной. Экспериментально установлено, что он составляет 22,414 л при 760 Торр и 0 °С. Поскольку 1 моль любого газа при температуре 0 °С и давлении 760 Торр занимает объем 22,4 л, из этого соотношения можно рассчитать молекулярную концентрацию любого объема газа, если известны его температура и давление. Например, 1 см3 воздуха при 760 Торр и 0 °С содержит 2,7 x 1019 молекул; в то время как при давлении 1 Торр и температуре 0 °С 1 см3 воздуха содержит 3,54 x 1016 молекул.
Газовые законы
Газовые законы устанавливают соотношения между физическими параметрами состояния газа (давление, объем, температура и количество газа) при постоянном значении одного из параметров. Эти законы справедливы для идеального газа в котором объем всех молекул является незначительным по сравнению с объемом газа, и энергия притяжения между молекулами является незначительной по сравнению с их средней тепловой энергией. Это означает, что данное вещество (в данном случае газ) находится в газообразном состоянии при температуре, которая достаточно высока для его конденсации. К газам, по своим свойствам близким к идеальным при комнатной температуре, относятся 02, Ne, Аг, СО, Н2 и NO.
Ниже приведены общие формулировки газовых законов.
Закон Бойля — произведение давления на объем рУ, где р — давление газа, V — его объем, является постоянной величиной для данной массы газа при постоянной температуре.
Закон Гей-Люссака — величина V/T, где Т- абсолютная температура газа, является постоянной для данной массы газа при постоянном давлении.
Закон Авогадро — равные объемы различных газов при одинаковых температуре и давлении содержат одно и то же количество молекул. Из этого закона можно получить важное соотношение между числом молей газа и давлением, которое создает газ.
Основное уравнение состояния идеального газа (уравнение Клапейрона) устанавливает зависимость между давлением, объемом и температурой для данной массы газа, т. е. теми параметрами, которые необходимы для описания состояния газа:
$$pV=MRT, (1.1)$$
где R — универсальная газовая постоянная данного газа, R = 8,31 ДжДмоль К) (62,4 Торр-л/(моль x К)); М — это число молей в объеме V
Данный закон будет справедлив и для большинства газов, которые при низких давлениях ведут себя как идеальные газы.
Закон парциальных давлений Дальтона — общее давление, создаваемое смесью газов, равняется сумме парциальных давлений, создаваемых отдельными компонентами смеси.
Парциальное давление, создаваемое одним компонентом смеси газов, — это давление, создаваемое этим компонентом, если бы он занимал весь объем.
Закон Авогадро — равные объемы идеального газа при постоянных температуре и давлении содержат одно и то же количество молекул.
Число Авогадро — число молекул в 1 моле газа или любого вещества, является универсальной постоянной и составляет 6,023 • 1023.
Число Лошмидта — число молекул в кубическом сантиметре газа при атмосферном давлении и температуре 0 °С. Это универсальная постоянная, равная 2,637 x 1019.
Для 1 моля газа при атмосферном давлении и температуре 0 °С (273,2 К), занимающего объем V = 22,414 л, R= 8.31 Дж/(моль x К) или в тепловых единицах R/J= 1,99 кал/К (У — механический эквивалент теплоты, J = 4,182 Дж кал). Следовательно, количество теплоты 1,99 кал будет повышать температуру 1 моля любого идеального газа на 1 К, или после повышения температуры 1 моля любого идеального газа на 1 К увеличение энергии газа составит 8,31 Дж.
Неидеальные газы
Примерами некоторых распространенных неидеальных газов являются аммиак, этан, бензол, диоксид углерода (углекислый газ), пары ртути, SO и S02. Газовые законы должны описывать физические процессы, протекающие в любом газе при температуре выше критической. При критической температуре, Тс, газ начинает конденсироваться. Ниже этой критической температуры имеет место давление паров над жидким конденсатом, которое называется давлением пара. Если газ конденсируется (его объем уменьшается), давление изменяться не будет, но большее количество газа будет переходить в жидкую фазу. По мере снижения температуры над жидкостью будет присутствовать меньшее количество молекул, при этом давление паров также будет снижаться.
Плавление — процесс перехода вещества из кристаллического (твердого) состояния в жидкое. Для большинства тел (объем при плавлении возрастает) плавление происходит при постоянной, возрастающей с ростом внешнего давления, температуре (точке) плавления Тпл. Если при плавлении объем вещества уменьшается, то понижается с увеличением давления.
Кристаллизация (отвердевание) — процесс перехода вещества вследствие его охлаждения из жидкого состояния в твердое.
Удельная теплота плавления — количество теплоты, необходимое для плавления единицы массы тела при его температуре плавления:

Единица удельной теплоты плавления: джоуль на килограмм (Дж/кг).
Вещество при кристаллизации выделяет такое же количество теплоты, которое поглощалось при его плавлении, причем температуры кристаллизации и плавления равны (рис. 3.8).
Парообразование — процесс перехода вещества из жидкого состояния в газообразное. Существует два способа перехода жидкости в парообразное состояние: испарение и кипение.
Испарение — парообразование, происходящее при любой температуре со свободной поверхности жидкости. Испарение твердых тел называют возгонкой или сублимацией. При испарении температура жидкости понижается.
Скорость испарения зависит от рода (состава), температуры и площади поверхности жидкости. Движение и давление гаON
Таблица 3.1
Процесс | Условие процесса | P,V- диаграмма | Первое начало термодинамики | AU | Работа |
Изотермическое расширение | Т = const, т = const, ц = const | lb, 0 V, V2V | Q = A (Q > 0) | AU = 0 | m , V2 A = —RPln— M Vj |
Изохорное нагревание | V = const, т = const, р = const | p P2 —-|2 Pi —-ll 0 V | 1 m Q = AU ——RAT = 2 M m i = —CVAT= -V(P2-Pj) M 2 | AU = 0 (.AU > 0) | A = 0 |
Изобарное расширение | Р = const, т = const, p = const | P
| m Q = AU + A = Cp—AT = M 1 m m =—RAT + —RAT, 2M M i + 2 где CP = —-—R | AU = Q-A (AU > 0) | A = P( V2-Vl) = = -r(t2-to M (A > 0) |
Адиабатное расширение | m = const, p = const |
| Q = 0; A = -AU | AU =-A | A = -AU = i m , = -2 M(r2″Tl) |

Рис. 3.8
за над испаряющейся поверхностью также влияет на скорость испарения.
Кипение — парообразование во всем объеме жидкости при постоянной, зависящей от давления, температуре кипения Тк. С ростом внешнего давления температура кипения возрастает, и наоборот. В процессе кипения Гк остается постоянной (рис. 3.9).

Рис. 3.9
Конденсация — процесс перехода вещества вследствие его охлаждения или сжатия из газообразного состояния в жидкое.
Удельная теплота парообразования — количество теплоты, необходимое для превращения единицы массы жидкости в пар при постоянной температуре:

Единица удельной теплоты парообразования: джоуль на килограмм (Дж/кг).
При парообразовании вещество поглощает такое же количество теплоты, которое выделялось при его конденсации. Заметим, что время выкипания данной массы жидкости равно времени ее конденсации (рис. 3.9).
Удельная теплота сгорания — количество теплоты, выделенное при полном сгорании единицы массы топлива при постоянной температуре горения:

Единица удельной теплоты сгорания: джоуль на килограмм (Дж/кг).
Кривая нагрева — зависимость температуры вещества от количества подводимого к нему тепла (энергии).
В качестве иллюстрации на рис. 3.10 приведена кривая нагрева воды.

Рис. ЗЛО
При осуществлении теплообмена между телами, образующими изолированную термодинамическую систему, механическая работа внутри системы не совершается (А = 0). В данном случае согласно закону сохранения энергии алгебраическая сумма изменений внутренней энергии тел равна нулю:

где ДП, — внутренняя энергия г-го тела, участвующего в теплообмене.
Уравнение теплового баланса: алгебраическая сумма количества теплоты, отданного телами (внутренняя энергия тел при этом уменьшается), и количества теплоты, полученного телами (внутренняя энергия тел увеличивается), для изолированной системы тел равна нулю: бб

п п
где X Q; получ» X Qi отд — соответственно количество теплоты,
i=i i=i
полученное и отданное телами в результате теплообмена.
Теплоту, полученную телом, считают положительной, теплоту, отданную телом — отрицательной.
Следствие из уравнения теплового баланса: при теплообмене количество теплоты Q0Tfl, отданное одним телом, равно по модулю количеству теплоты получ, полученному другим телом:

Расчет количества теплоты:
а) при нагревании знак «+», охлаждении знак «-»

б) плавлении знак «+», кристаллизации знак «-»

в) парообразовании знак «+», конденсации знак «-»

г) сгорании вещества

В приведенных формулах: С, с — соответственно теплоемкость и удельная теплоемкость тел (связь: С = cm); X — удельная теплота плавления; г — удельная теплота парообразования; q — удельная теплота сгорания; т — масса тела; АТ — изменение температуры (АТ = Тк — Гн; Гн, Гк — соответственно начальная и конечная температура тела).
Насыщенный пар — газ, находящийся в динамическом равновесии со своей жидкостью. Насыщенный пар имеет максимальные плотность и давление при заданной температуре, а концентрация его молекул не зависит от его объема при этой температуре.
Зависимость давления для насыщенного пара (кривая 1) и для идеального газа (кривая 2) от температуры при изохор- ном нагревании представлена на рис. 3.11. В определенном интервале температур (участок АВ) насыщенный пар с достаточ-

Рис. 3.11
ной степенью точности подчиняется уравнению состояния идеального газа (Р = пкТ). Давление пара растет (участок ВС) как вследствие повышения температуры Т, так и из-за возрастания концентрации п молекул пара (т. е. Р ~ пТ). Когда вся жидкость испаряется (участок CD), пар перестает быть насыщенным и его давление возрастает в соответствии с законом Шарля.
Абсолютная влажность — плотность водяного пара при данных условиях, чаще всего выражаемая в г/м3. В метрологии абсолютная влажность оценивается по давлению Р водяного пара, выраженного в мм рт.ст.
Точка росы — температура, при которой находящийся в воздухе пар становится насыщенным.
Относительная влажность — отношение парциального давления Р водяного пара, содержащегося в воздухе при данной температуре (абсолютная влажность), к давлению Рн насыщенного пара при той же температуре:

Параметры состояния насыщенного пара приближенно описываются уравнением Клапейрона — Менделеева в условиях, близких к нормальным.
Абсолютную влажность (плотность р) и давление пара Р можно связать с применением уравнения Клапейрона — Менделеева:

Если р/(РТ) = const, то относительная влажность прямо пропорциональна плотности пара:

где р0 — плотность насыщенного пара.
Насыщенные и ненасыщенные пары.
Рассмотрим процессы, происходящие в закрытом сосуде:
- процесс испарения, скорость которого постепенно уменьшается
- конденсации, скорость которого постепенно возрастает
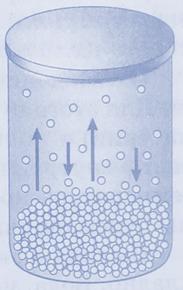
С течением времени в сосуде закрытом крышкой между жидкостью и её паром устанавливается состояние динамического (подвижного) равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, то есть когда скорости процессов испарения и конденсации одинаковы. Такую систему называютдвухфазной.
Пар, находящийся в динамическом равновесии со своей жидкостью, называютнасыщенным.
Название «насыщенный» подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
Ненасыщенный пар – это пар, не достигший динамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
Рассмотрим некоторые свойства насыщенного пара:
1. Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Если уменьшить объем насыщенного пара, то сначала концентрация его молекул увеличится и из газа в жидкость начнет переходить больше молекул до тех пор, пока опять на установится динамическое равновесие.
2. Давление насыщенного пара при постоянной температуре не зависит от его объёма.
p = n*k*T, т.к. n не зависит от V , то и р не зависит от V.
Независимое от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара. Это наибольшее давление, которое может иметь пар при данной температуре.
3. Давление насыщенного пара зависит от температуры. Чем выше будет температура жидкости, тем больше молекул будет испаряться, динамическое равновесие нарушится, но концентрация молекул пара будет расти до тех пор, пока равновесие не установится опять, а значит, больше станет и давление насыщенного пара. С увеличением температуры давление насыщенных паров возрастает.
В атмосферном воздухе всегда присутствуют пары воды, которая испаряется с поверхности морей, рек, океанов и т.п.
Воздух, содержащий водяной пар, называют влажным.
Влажность воздуха оказывает огромное влияние на многие процессы на Земле: на развитие флоры и фауны, на урожай сельхоз. культур, на продуктивность животноводства и т.д. Влажность воздуха имеет большое значение для здоровья людей, т.к. от неё зависит теплообмен организма человека с окружающей средой. При низкой влажности происходит быстрое испарение с поверхности и высыхание слизистой оболочки носа, гортани, что приводит к ухудшению состояния.
Значит, влажность воздуха надо уметь измерять. Для количественной оценки влажности воздуха используют понятия абсолютной и относительной влажности.
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха. Она равна парциальному давлению пара при данной температуре.
Парциальное давление пара – это давление, которое оказывал бы водяной пар, находящийся в воздух , если бы все остальные газы отсутствовали.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
Если воздух не содержит паров воды, то его абсолютная и относительная влажность равны 0.
Если влажный воздух охлаждать, то находящийся в нем пар можно довести до насыщения, и далее он будет конденсироваться.
Примеры:
выпадение росы под утро,

запотевание холодного стекла, если на него подышать,

образование капли воды на холодной водопроводной трубе,

сырость в подвалах домов.

Точка росы – это температура, при которой водяной пар, содержащийся в воздухе, становится насыщенным.
Точка росы также характеризует влажность воздуха.
C° | Точка россы при относительной влажности воздуха в % | |||||||||||||
30% | 35% | 40% | 45% | 50% | 55% | 60% | 65% | 70% | 75% | 80% | 85% | 90% | 95% | |
30 | 10,5 | 12,9 | 14,9 | 16,8 | 18,4 | 20 | 21,4 | 22,7 | 23,9 | 25,1 | 26,2 | 27,2 | 28,2 | 29,1 |
29 | 9,7 | 12 | 14 | 15,9 | 17,5 | 19 | 20,4 | 21,7 | 23 | 24,1 | 25,2 | 26,2 | 27,2 | 28,1 |
28 | 8,8 | 11,1 | 13,1 | 15 | 16,6 | 18,1 | 19,5 | 20,8 | 22 | 23,2 | 24,2 | 25,2 | 26,2 | 27,1 |
27 | 8 | 10,2 | 12,2 | 14,1 | 15,7 | 17,2 | 18,6 | 19,9 | 21,1 | 22,2 | 23,3 | 24,3 | 25,2 | 26,1 |
26 | 7,1 | 9,4 | 11,4 | 13,2 | 14,8 | 16,3 | 17,6 | 18,9 | 20,1 | 21,2 | 22,3 | 23,3 | 24,2 | 25,1 |
25 | 6,2 | 8,5 | 10,5 | 12,2 | 13,9 | 15,3 | 16,7 | 18 | 19,1 | 20,3 | 21,3 | 22,3 | 23,2 | 24,1 |
24 | 5,4 | 7,6 | 9,6 | 11,3 | 12,9 | 14,4 | 15,8 | 17 | 18,2 | 19,3 | 20,3 | 21,3 | 22,3 | 23,1 |
23 | 4,5 | 6,7 | 8,7 | 10,4 | 12 | 13,5 | 14,8 | 16,1 | 17,2 | 18,3 | 19,4 | 20,3 | 21,3 | 22,2 |
22 | 3,6 | 5,9 | 7,8 | 9,5 | 11,1 | 12,5 | 13,9 | 15,1 | 16,3 | 17,4 | 18,4 | 19,4 | 20,3 | 21,1 |
21 | 2,8 | 5 | 6,9 | 8,6 | 10,2 | 11,6 | 12,9 | 14,2 | 15,3 | 16,4 | 17,4 | 18,4 | 19,3 | 20,2 |
20 | 1,9 | 4,1 | 6 | 7,7 | 9,3 | 10,7 | 12 | 13,2 | 14,4 | 15,4 | 16,4 | 17,4 | 18,3 | 19,2 |
19 | 1 | 3,2 | 5,1 | 6,8 | 8,3 | 9,8 | 11,1 | 12,3 | 13,4 | 14,5 | 15,3 | 16,4 | 17,3 | 18,2 |
18 | 0,2 | 2,3 | 4,2 | 5,9 | 7,4 | 8,8 | 10,1 | 11,3 | 12,5 | 13,5 | 14,5 | 15,4 | 16,3 | 17,2 |
17 | -0,6 | 1,4 | 3,3 | 5 | 6,5 | 7,9 | 9,2 | 10,4 | 11,5 | 12,5 | 13,5 | 14,5 | 15,3 | 16,2 |
16 | -1,4 | 0,5 | 2,4 | 4,1 | 5,6 | 7 | 8,2 | 9,4 | 10,5 | 11,6 | 12,6 | 13,5 | 14,4 | 15,2 |
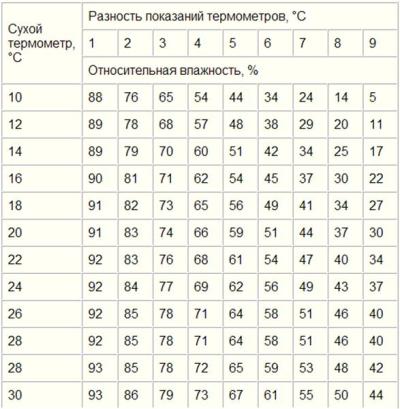
Для измерения влажности воздуха используют приборы гигрометры и психрометры.
1. Конденсационный гигрометр.

Состоит из укрепленной на подставке металлической круглой коробочки с отполированной плоской поверхностью. В коробочке сверху имеются два отверстия. Через одно из них в коробочку наливают эфир и вставляют термометр, а другое соединяют с резиновой грушей. Действие конденсационного гигрометра основано на определении точки росы.
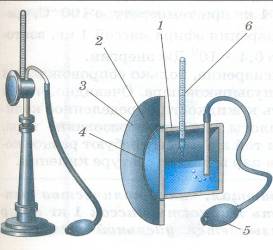
Продувают воздух через эфир (с помощью резиновой груши), при этом эфир быстро испаряется и охлаждает коробочку. При определенной температуре на отполированной поверхности коробочки появляются капельки воды (роса). По термометру определяют эту температуру, это и будет точка росы. В специальной таблице по точке росы находят абсолютную влажность.
Чтобы найти относительную влажность, надо давление насыщенного пара при температуре точки росы разделить на давление насыщенного пара при температуре окружающего воздуха и умножить на 100%.
2. Волосной гигрометр.

Его работа основана на том, что обезжиренный человеческий волос при увеличении влажности воздуха удлиняется, а при уменьшении влажности укорачивается. Волос оборачивают вокруг легкого блока, прикрепив один конец к раме, а к другому подвешивают груз. При изменении длины волоса указатель (стрелка), прикрепленный к блоку, будет двигаться, перемещаясь по шкале. Шкалу градуируют по эталонному прибору.
3. Психрометр. (от греч «психриа» — холод).

Состоит из двух одинаковых термометров. Резервуар одного из них обернут марлей, опущенной в сосуд с водой. Вода смачивает резервуар термометра и при её испарении он охлаждается. По разности температур сухого и влажного термометров по психрометрической таблице определяют влажность воздуха.