Каком объеме раствора содержится

Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
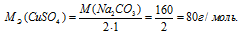
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
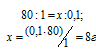
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
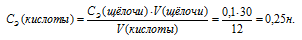
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
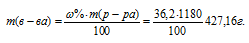
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
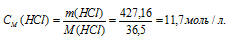
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
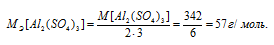
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
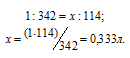
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
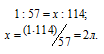
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
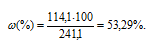
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
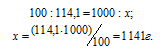
Теперь рассчитаем моляльность раствора:
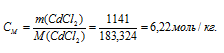
Ответ: 53,3%; 6,22 моль/кг.
Êîíöåíòðàöèÿ ðàñòâîðà ìîæåò âûðàæàòüñÿ êàê â áåçðàçìåðíûõ åäèíèöàõ (äîëÿõ, ïðîöåíòàõ), òàê è â ðàçìåðíûõ âåëè÷èíàõ (ìàññîâûõ äîëÿõ, ìîëÿðíîñòè, òèòðàõ, ìîëüíûõ äîëÿõ).
Êîíöåíòðàöèÿ – ýòî êîëè÷åñòâåííûé ñîñòàâ ðàñòâîðåííîãî âåùåñòâà (â êîíêðåòíûõ åäèíèöàõ) â åäèíèöå îáúåìà èëè ìàññû. Îáîçíà÷èëè ðàñòâîðåííîå âåùåñòâî — Õ, à ðàñòâîðèòåëü — S. ×àùå âñåãî èñïîëüçóþ ïîíÿòèå ìîëÿðíîñòè (ìîëÿðíàÿ êîíöåíòðàöèÿ) è ìîëüíîé äîëè.
Ñïîñîáû âûðàæåíèÿ êîíöåíòðàöèè ðàñòâîðîâ.
1. Ìàññîâàÿ äîëÿ (èëè ïðîöåíòíàÿ êîíöåíòðàöèÿ âåùåñòâà) – ýòî îòíîøåíèå ìàññû ðàñòâîðåííîãî âåùåñòâà m ê îáùåé ìàññå ðàñòâîðà. Äëÿ áèíàðíîãî ðàñòâîðà, ñîñòîÿùåãî èç ðàñòâîð¸ííîãî âåùåñòâà è ðàñòâîðèòåëÿ:
 ,
,
ãäå:
ω – ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà;
mâ-âà – ìàññà ðàñòâîð¸ííîãî âåùåñòâà;
mð-ðà – ìàññà ðàñòâîðèòåëÿ.
Ìàññîâóþ äîëþ âûðàæàþò â äîëÿõ îò åäèíèöû èëè â ïðîöåíòàõ.
2. Ìîëÿðíàÿ êîíöåíòðàöèÿ èëè ìîëÿðíîñòü – ýòî êîëè÷åñòâî ìîëåé ðàñòâîð¸ííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà V:
 ,
,
ãäå:
C – ìîëÿðíàÿ êîíöåíòðàöèÿ ðàñòâîð¸ííîãî âåùåñòâà, ìîëü/ë (âîçìîæíî òàêæå îáîçíà÷åíèå Ì, íàïðèìåð, 0,2 Ì HCl);
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
V – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîð íàçûâàþò ìîëÿðíûì èëè îäíîìîëÿðíûì, åñëè â 1 ëèòðå ðàñòâîðà ðàñòâîðåíî 1 ìîëü âåùåñòâà, äåöèìîëÿðíûì – ðàñòâîðåíî 0,1 ìîëÿ âåùåñòâà, ñàíòèìîëÿðíûì – ðàñòâîðåíî 0,01 ìîëÿ âåùåñòâà, ìèëëèìîëÿðíûì – ðàñòâîðåíî 0,001 ìîëÿ âåùåñòâà.
3. Ìîëÿëüíàÿ êîíöåíòðàöèÿ (ìîëÿëüíîñòü) ðàñòâîðà Ñ(x) ïîêàçûâàåò êîëè÷åñòâî ìîëåé n ðàñòâîðåííîãî âåùåñòâà â 1 êã ðàñòâîðèòåëÿ m:
 ,
,
ãäå:
Ñ (x) – ìîëÿëüíîñòü, ìîëü/êã;
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
mð-ëÿ – ìàññà ðàñòâîðèòåëÿ, êã.
4. Òèòð – ñîäåðæàíèå âåùåñòâà â ãðàììàõ â 1 ìë ðàñòâîðà:
 ,
,
ãäå:
T – òèòð ðàñòâîð¸ííîãî âåùåñòâà, ã/ìë;
mâ-âà – ìàññà ðàñòâîðåííîãî âåùåñòâà, ã;
Vð-ðà – îáú¸ì ðàñòâîðà, ìë.
5. Ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà – áåçðàçìåðíàÿ âåëè÷èíà, ðàâíàÿ îòíîøåíèþ êîëè÷åñòâà ðàñòâîðåííîãî âåùåñòâà n ê îáùåìó êîëè÷åñòâó âåùåñòâ â ðàñòâîðå:
 ,
,
ãäå:
N – ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà;
n – êîëè÷åñòâî ðàñòâîð¸ííîãî âåùåñòâà, ìîëü;
nð-ëÿ – êîëè÷åñòâî âåùåñòâà ðàñòâîðèòåëÿ, ìîëü.
Ñóììà ìîëüíûõ äîëåé äîëæíà ðàâíÿòüñÿ 1:
N(X) + N(S) = 1.
ãäå N(X) — ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà Õ;
N(S) — ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà S.
Èíîãäà ïðè ðåøåíèè çàäà÷ íåîáõîäèìî ïåðåõîäèòü îò îäíèõ åäèíèö âûðàæåíèÿ ê äðóãèì:

ω(X) — ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà, â %;
Ì(Õ) – ìîëÿðíàÿ ìàññà ðàñòâîðåííîãî âåùåñòâà;
ρ= m/(1000V) – ïëîòíîñòü ðàñòâîðà.6. Íîðìàëüíàÿ êîíöåíòðàöèÿ ðàñòâîðîâ (íîðìàëüíîñòü èëè ìîëÿðíàÿ êîíöåíòðàöèÿ ýêâèâàëåíòà) – ÷èñëî ãðàìì-ýêâèâàëåíòîâ äàííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà.
Ãðàìì-ýêâèâàëåíò âåùåñòâà – êîëè÷åñòâî ãðàììîâ âåùåñòâà, ÷èñëåííî ðàâíîå åãî ýêâèâàëåíòó.
Ýêâèâàëåíò – ýòî óñëîâíàÿ åäèíèöà, ðàâíîöåííàÿ îäíîìó èîíó âîäîðîäà â êèñëîòîíî-îñíîâíûõ ðåàêöèÿõ èëè îäíîìó ýëåêòðîíó â îêèñëèòåëüíî – âîññòàíîâèòåëüíûõ ðåàêöèÿõ.
Äëÿ çàïèñè êîíöåíòðàöèè òàêèõ ðàñòâîðîâ èñïîëüçóþò ñîêðàùåíèÿ í èëè N. Íàïðèìåð, ðàñòâîð, ñîäåðæàùèé 0,1 ìîëü-ýêâ/ë, íàçûâàþò äåöèíîðìàëüíûì è çàïèñûâàþò êàê 0,1 í.
 ,
,
ãäå:
ÑÍ – íîðìàëüíàÿ êîíöåíòðàöèÿ, ìîëü-ýêâ/ë;
z – ÷èñëî ýêâèâàëåíòíîñòè;
Vð-ðà – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîðèìîñòü âåùåñòâà S — ìàêñèìàëüíàÿ ìàññà âåùåñòâà, êîòîðàÿ ìîæåò ðàñòâîðèòüñÿ â 100 ã ðàñòâîðèòåëÿ:

Êîýôôèöèåíò ðàñòâîðèìîñòè – îòíîøåíèå ìàññû âåùåñòâà, îáðàçóþùåãî íàñûùåííûé ðàñòâîð ïðè êîíêðåòíîé òåìïåðàòóðå, ê ìàññå ðàñòâîðèòåëÿ:

Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
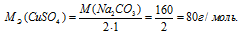
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
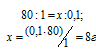
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
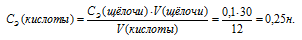
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
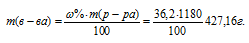
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
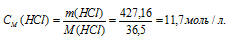
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
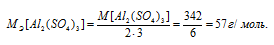
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
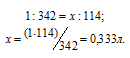
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
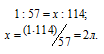
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
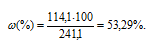
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
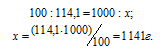
Теперь рассчитаем моляльность раствора:
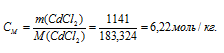
Ответ: 53,3%; 6,22 моль/кг.
Изучите материал!
Процентная концентрация раствора
С% = W% (растворённого вещества) = (m растворённого вещества• 100%) /m раствора
m1/m2 = (W3-W2)/(W1-W3) |
Молярная концентрация раствора
1. Молярную концентрацию (Cm) растворов определяют по формуле: Cm = υрастворённого вещества/ Vраствора где ν = m/M — количество вещества (здесь М — молярная масса вещества), V – объём 2. Cm измеряют в моль/л или моль/м3 (в системе СИ). 3. Молярная концентрация показывает количество растворённого вещества (моль), содержащегося в 1 л раствора. |
РЕШИТЕ ЗАДАЧИ!
Задачи по теме: Массовая доля растворенного вещества.
I уровень
1. Вычислите массовую долю растворенного вещества, если в 150 г. воды растворили 7 г. соли.
( Ответ: 4,46 %)
2. В 80 мл. воды растворили 6 г. глюкозы. Рассчитайте массовую долю глюкозы в полученном растворе.
( Ответ: 6,98 %)
3. Какую массу сахара нужно взять и какой объем воды, чтобы приготовить раствор массой 240 г. с массовой долей сахара 6%.
( Ответ: 14,4 г. сахара; 225,6 мл. воды)
4. Вычислите массы соли и воды, необходимые для приготовления
300 г. раствора с массовой долей соли 15 %.
( Ответ: 45 г. соли; 255 г. воды)
5. Выпарили 150 г. раствора с массовой долей сахара 15 %. Вычислите массу сахара, оставшегося в чашке после выпаривания воды.
( Ответ: 22,5 г.)
II уровень.
6. Сколько граммов сульфата меди необходимо смешать с 450 г. воды, чтобы получить раствор с массовой долей 10 %.
( Ответ: 50 г.)
7. В каком количестве воды нужно растворить 40 г. соли для получения раствора с массовой долей 25 %.
( Ответ: 120 г.)
8. Смешали 150 г. раствора с массовой долей серной кислоты 10 % и 250 г. раствора с массовой долей серной кислоты 8 %. Определите массовую долю кислоты в полученной смеси.
( Ответ: 8,75 %)
9. 120 г. раствора с массовой долей соли 10 % упарили до 80 г. Какова массовая доля (в %) соли в упаренном растворе?
( Ответ: 15 %)
10. Определите массовую долю серной кислоты в растворе, если к 600 г. раствора с массовой долей 12 % добавили ещё 200 мл. воды.
( Ответ: 9 %)
III уровень.
11. Определите массу соли, которую нужно добавить к 80 г. раствора с массовой долей соли 10 %, чтобы получить раствор с массовой долей этой соли 25 %.
( Ответ: 16 г.)
12. Определите массу воды, которую нужно добавить к 50 г. раствора с массовой долей соли 5 %, чтобы получить раствор с массовой долей соли 2 %.
( Ответ: 75 г.)
13. Необходимо приготовить 500 г. раствора серной кислоты, массовая доля которой 0,3. Вычислите массу 98 %-го раствора серной кислоты, которая потребуется для приготовления такого раствора.
( Ответ: 153,06 г.)
14. В 130 мл. воды растворили 35,8 г. ZnSO4. 7 H20. Рассчитайте массовую долю растворенного вещества.
( Ответ: 12,11 %)
15. Какой объем газа HI (н.у.) нужно растворить в воде, чтобы получить 40 г. раствора HI с массовой долей 20 %.
( Ответ: 1,41 л.)
Задачи по теме: «Молярная концентрация раствора»
1. Вычислите массу хлорида натрия, необходимого для приготовления 200мл раствора, в котором концентрация нитрата калия равна 0,5моль/л.
2. Вычислите объём раствора с молярной концентрацией 2,5моль/л, содержащего 6 моль хлорида натрия.
3. Вычислите молярную концентрацию раствора поваренной соли, если в 1 л этого раствора содержится 25 моль хлорида натрия.
4. Вычислите молярную массу вещества, если известно, что в 36 л раствора с молярной концентрацией 9 моль/л было растворено 1440 г вещества.
ТИПЫ ЗАДАЧ ПО ТЕМЕ: «РАСТВОРЫ»
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
С ИСПОЛЬЗОВАНИЕМ
КОНЦЕНТРАЦИИ РАСТВОРОВ
Задача 1. Сколько граммов КОН надо растворить в 100 г воды, чтобы получить раствор с массовой долей 6 %?
Решение. По определению массовой доли (w) известно, что в 100 г раствора будет содержаться 6 г КОН.
mраствора = mрастворенного в-ва + m ;
следовательно, m = 100 г раствора – 6 г = 94 г,
тогда в 94 г Н2О содержится 6 г КОН, а
в 100 г Н2О » х г КОН; х = 6,38 г КОН.
Задача 2. Какой объем 96 %-ной (по массе) серной кислоты (плотность раствора, r = 1,84 г/см3) и какую массу воды надо взять для приготовления 100 мл 15%-ного (по массе) раствора серной кислоты (плотность раствора, r = 1,10 г/см3).
Решение. Найдем массу 100 мл 15%-ного (по массе) раствора Н2SO4.
mраствора = r×V = 1,10×100 = 110 г
Массу Н2SO4 , содержащуюся в 110 г этого раствора, найдем из пропорции
100 г раствора содержат 15 г Н2SO4
110 г раствора » х г Н2SO4,
х =16,5 г Н2SO4
или m = 110× = 16,5 г.
Далее найдем массу 96 %-ного (по массе) раствора Н2SO4, в котором содержится 16,5 г Н2SO4,
в 100 г раствора содержится 96 г Н2SO4
х г » » 16,5 г Н2SO4 ;
х = 17,2 г раствора или m 96%-ного р-ра = = 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
; V = 17,2/1,84 = 9,34 мл.
Итак, для приготовления 100 мл 15%-ного раствора Н2SO4 потребуется 9,34 мл 96%-ного раствора и 110 г — 16,5 г = 93,5 г Н2О.
Задача 3. Определите молярную концентрацию раствора NaOH, если в 200 мл раствора содержится 1,6 г растворенного вещества.
Решение. Молярная масса NaOH равна 40 г/моль. Определим количество молей NaOH, содержащихся в 200 мл раствора:
n = = 1,6 : 40 = 0,04 моля.
Исходя из определения молярной концентрации, найдем количество молей NaOH, содержащихся в 1 л раствора:
СM = n / V
СM = 0,04 : 0,2 = 0,2 моль/л.
Задача 4. Какова нормальность раствора хлорида железа (III), в 0,3 л которого содержится 32,44 г соли?
Решение. Молярная масса хлорида железа равна 162,3 г/моль. Эквивалентная масса FeCl3 = 162,3 : 3 = 54,1 г/моль-экв.
Определим количество моль-эквивалентов растворенного вещества (FeCl3), содержащихся в 0,3 л раствора:
n = 32,44 : 54,1 = 0,6 моль-эквивалентов (эквивалентов).
Нормальность определяется количеством моль-эквивалентов растворенного вещества в 1 л раствора. Следовательно, 0,3 л содержит 0,6 моль-эквивалента
1 л » х моль-эквивалентов;
х = 2 моль-эквивалента (эквивалента).
СН = 2 (2н раствор) или СН = экв./л.
Задача 5. Определите молярность, нормальность и титр 15%-ного раствора серной кислоты. Плотность раствора r =1,10 г/см3.
Решение. 1. Примем объем раствора, равным 1 л. Определяем массу (г) серной кислоты, содержащуюся в 1 л ее раствора, из пропорции
в 100 г раствора содержится 15 г Н2SO4
в 1,10 × 1000 г » » х г Н2SO4 ,
отсюда следует, что в 1л раствора массой 1,10 × 1000 г содержится х =165 г Н2SO4 ;
2.Молярная масса Н2SO4 равна 98 г/моль, в 1л раствора содержится Н2SO4 165 : 98 = 1,68 моль. Таким образом СМ = 1,68 моль/л;
3.Эквивалент Н2SO4 равен 98 : 2 = 49 г/моль-экв. или 49 г/экв. Количество моль-эквивалентов в165 г Н2SO4 равно 165 : 49 = 3,36 моль-эквивалентов. Следовательно, в 1л раствора содержится 3,36 моль-эквивалентов
СН = 3,36 моль-экв./л (экв./л);
4.Определим титр раствора. Т = m / v; Т = 165: 1000 = 0,165 г/мл.
Задача 6. В каком объеме 0,5 нормального раствора карбоната натрия содержится 10 г соли? Какова молярность и титр этого раствора?
Решение. 1.Исходя из определения нормальности, в 1 литре раствора содержится 0,5 моль-эквивалентов Na2CO3.
Эквивалентная масса Na2CO3 = 106 : 2 = 53 г/моль-экв. Следовательно, в 1 л 0,5 н раствора содержится 0,5 × 53 = 26,5 г Na2CO3,
тогда в 1л 0,5н раствора содержится 26,5 г Na2CO3
в х л » 10 г Na2CO3
х = 0,38 л ;
2.Определим СМ раствора. В 1 л 0,5н раствора содержится 26,5 г Na2CO3. Находим количество молей Na2CO3
n = 26,5:106=0,25 молей, следовательно, СМ = 0,25 моль/л.
3.Определим титр раствора.
В 1000 мл раствора содержится 26,5 г Na2CO3
в 1мл раствора » х г
х = 0,0265 г, Т = 0,0265 г/мл.
Задача 7. Для нейтрализации 42 мл серной кислоты потребовалось 14 мл 0,3 н раствора щелочи. Определите молярность раствора Н2SO4.
Решение. Поскольку вещества реагируют между собой в эквивалентных количествах (закон эквивалентов), то можно написать
CН кислоты× Vкислоты = CН щелочи× Vщелочи
Следовательно, CН кислоты × 42 = 14 × 0,3; CН кислоты = 0,1.
CН кислоты = 0,1 моль-эквивалентов/л. Молярная масса Н2SO4 = 98 г/моль; эквивалентная масса Н2SO4 =98 : 2 = 49 г/моль-экв., или эквивалентная масса составляет 0,5 моля Н2SO4.
Отсюда молярность раствора Н2SO4 составит 0,1 × 0,5 = 0,05 моль/л, CМ = 0,05 моль/л.
Или примем Vх раствора = 1 л, тогда m= CН × Э × V;
= 0,1×49×1 = 4,9 г; CМ = = 0,05 моль/л.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
