Какой продукт окисления первичных спиртов
Принципиальной проблемой, которая возникает при окислении спиртов до альдегидов, является то, что альдегиды очень легко подвергаются дальнейшему окислению по сравнению с исходными спиртами. По сути альдегиды являются активными органическими восстановителями. Так, при окислении первичных спиртов бихроматом натрия в серной кислоте (смесь Бекмана), альдегид, который образуется, необходимо защитить от дальнейшего окисления до карбоновой кислоты. Можно, например, удалять альдегид из реакционной смеси. И это широко применяется, так как температура кипения альдегида как правило ниже, чем температура кипения исходного спирта. Таким путем могут быть получены, в первую очередь, низкокипящие альдегиды, например, уксусный, пропионовый, изомасляный:
Рисунок 1.
Лучшие результаты можно получить, если вместо серной кислоты использовать ледяную уксусную кислоту.
Для получения высококипящих альдегидов из соответствующих первичных спиртов в качестве окислителя используют трет-бутиловый эфир хроматной кислоты:
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Рисунок 2.
При окислении трет-бутилхроматом ненасыщенных спиртов (в апротонных неполярных растворителях) кратные связи не занимаются, и ненасыщенные альдегиды образуются с высокими выходами.
Достаточно селективным является метод окисления, в котором используют диоксид марганца в органическом растворителе, пентан или хлористый метилен. Например, алил- и бензил- спирты таким образом можно окислять в соответствующие альдегиды. Выходные спирты мало растворимые в неполярных растворителях, а альдегиды, которые образуются в результате окисления, значительно лучше растворимые в пентан или хлористый метилен. Поэтому карбонильные соединения переходят в слой растворителя и таким образом можно предотвратить контакт с окислителем и дальнейшем окислению:
Рисунок 3.
Проводить окисление вторичных спиртов в кетоны значительно проще, чем первичных спиртов в альдегиды. Выходы здесь выше, так как, во-первых, реакционная способность вторичных спиртов выше, чем первичных, а, во-вторых, кетоны, которые образуются значительно более стойки к действию окислителей чем альдегиды.
Окислители для окисления спиртов
Для окисления спиртов в качестве окислителей наиболее широкое применение нашли реагенты на основе переходных металлов — производные шестивалентного хрома, четырех и семи валентного марганца.
Для селективного окисления первичных спиртов до альдегидов в настоящее время лучшими реагентами считается комплекс $CrO_3$ с пиридином — $CrO_{3^.} 2C_5H_5N$ (реагент Саррета-Коллинза), также широко применяется реагент Кори — хлорхромат пиридиния $CrO_3Cl^-C_5H_5N^+H$ в хлористом метилене. Комплекс $CrO_{3^.} 2C_5H_5N$ красного цвета получается при медленном взаимодействии $CrO_{3^.}$ с пиридином при 10-15 $^circ$С. Оранжевый хлорхромат пиридиния получают при добавлении пиридина к раствору оксида хрома (IV) в 20%-й соляной кислоте. Оба этих реагента растворимы в $CH_2Cl_2$ или $CHCl_3$:
Рисунок 4.
Эти реагенты обеспечивают очень высокие выходы альдегидов, однако хлорхромат пиридиния имеет важное преимущество в том отношении, что этот реагент не затрагивает двойную или тройную связи в исходных спиртах и поэтому особенно эффективен для получения ненасыщенных альдегидов.
Для получения $α¸β$-ненасыщенных альдегидов окислением замещенных аллильных спиртов универсальным окислителем является оксид марганца (IV) $MnO_2$
Примеры реакций спиртов с этими окислителями приведены ниже:
Рисунок 5.
Рисунок 6.
Рисунок 7.
Рисунок 8.
Каталитическое дегидрирование спиртов
Собственно говоря, окисление спиртов до карбонильных соединений сводится к отщеплению водорода от молекулы исходного спирта. Такое отщепление можно осуществить не только с помощью рассмотренных ранее методов окисления, а и используя каталитическое дегидрирование. Каталитическое дегидрирование — процесс отщепления водорода от спиртов в присутствии катализатора (медь, серебро, оксид цинка, смесь оксидов хрома и меди) как с участием кислорода, так и без него. Реакция дегидрирования в присутствии кислорода называется реакцией окислительного дегидрирования.
В качестве катализаторов чаще всего используют тонкодисперсные медь и серебро, а также оксид цинка. Каталитическое дегидрирование спиртов особенно удобно использовать для синтеза альдегидов, которые очень легко окисляются до кислот.
Вышеупомянутые катализаторы наносят в высокодисперсном состоянии на инертные носители, с развитой поверхностью, например, асбест, пемза. Равновесие реакции каталитического дегидрирования устанавливается при температуре 300-400 $^circ$С. Чтобы предотвратить дальнейшее преобразование продуктов дегидрирования, реакционные газы необходимо быстро охлаждать. Дегидрирования очень эндотермических реакцией ($triangle H$ = 70-86 кДж / моль). Водород, образующийся можно сжигать, если добавлять в реакционную смесь воздуха, тогда суммарная реакция будет сильно экзотермической ($triangle H$ = -(160-180) кДж / моль). Такой процесс называется окислительное дегидрирование или аутотермичное дегидрирования. Хотя дегидрирование используется главным образом в промышленности, этот метод можно применять также и в лаборатории для препаративного синтеза.
Дегидрирование насыщения спиртов алифатического ряда происходит с хорошими выходами:
Рисунок 9.
В случае высококипящих спиртов реакцию проводят при пониженном давлении. Ненасыщенные спирты в условиях дегидрирования превращаются в соответствующие насыщенные карбонильные соединения. Гидрирование кратной $C = C$ связи происходит водородом, который образуется в процессе реакции. Чтобы предотвратить эту побочную реакцию и иметь возможность получать каталитическим дегидрированием ненасыщенные карбонильные соединения, процесс проводят в вакууме при 5-20 мм рт. ст. в присутствии паров воды. Такой метод позволяет получать целый ряд ненасыщенных карбонильных соединений:
Рисунок 10.
Применение дегидрирования спиртов
Дегидрирования спиртов является важным промышленным методом синтеза альдегидов и кетонов, например формальдегида, ацетальдегида, ацетона. Эти продуты в больших объемах добывают как дегидрированием, так и окислительным дегидрированием на медном или серебряном катализаторе:
дегидроциклизацией бутан-1,4-диола на медном катализаторе при 250 $^circ$С с высокими выходами получают $γ$-бутиролактон:
Рисунок 11.
глиоксаль синтезируют в промышленности в условиях каталитического окислительного дегидрирования этиленгликоля при 300 $^circ$ С:
Рисунок 12.
полиолы более сложного строения, например, пентаэритрит, сахара в условиях каталитического дегидрирования.
Окисление спиртов и фенолов
Для окисления гидроксисоединений используются соединения марганца(IV), марганца(VII), хрома(VI), оксиды металлов (Cu, Zn, Ag) и др.
Легкость окисления одноатомных спиртов уменьшается в ряду:
CH3OHМетанол CH3OH – сильный яд. Его высокая токсичность обусловлена лёгкой окисляемостью с образованием ядовитых продуктов (попадание в организм 5-10 г метанола приводит к слепоте, а 25-30 г – к смерти). > первичные ≥ вторичные >> третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот. В реакции участвует ближайшая к гидроксильной группе связь С–Н, по которой происходит внедрение атома кислорода. От образовавшегося при этом неустойчивого алкандиола-1,1Алкандиолы-1,1 – двухатомные спирты с ОН-группами при одном и том же атоме углерода R–CH(OH)2 и R2C(OH)2. Неустой-чивые соединения. Подобно угольной кислоте (O=C(OH)2 → CO2 + H2O) они легко отщепляют воду и превращаются в альдегиды R–CH=O или кетоны R2C=O. отщепляется вода с разрывом связей О–Н и С–ОH.
Окисления альдегида в карбоновую кислоту можно избежать, удаляя его из реакционной смеси путем отгонки
(альдегид кипит при более низкой температуре, так как его молекулы не ассоциированы за счет водородных связей).
При окислении вторичных спиртов получают кетоны.
Промышленное значение имеет реакция окисления вторичного алициклического спирта циклогексанола до кетона циклогексанона:

Это одна из стадий в многостадийном синтезе ε-капролактама, из которого получают поликапролактам (капрон).
Окисление первичных и вторичных спиртов происходит также в результате реакции дегидрирования (отщепления водорода) при пропускании паров спирта над нагретым катализатором (Cu, соединения Ag, Cr, или Zn). В этих условиях процесс идёт как внутримолекулярная окислительно-восстановительная реакция.

Данный метод позволяет превращать первичные спирты в альдегиды без их дальнейшего окисления до кислот.
Третичные спирты более устойчивы к действию окислителей. Если первичные и вторичные спирты окисляются в кислой, нейтральной и щелочной средах, то третичные спирты реагируют лишь в жестких условиях – кислая среда, повышенная температура. Это приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов – карбоновых кислот и кетонов с меньшим числом углеродных атомов.
- Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
- Устойчивость третичных спиртов при окислении позволяет отличить их от первичных и вторичных спиртов по реакции с разбавленным щелочным раствором перманганата калия.
Многоатомные спирты при окислении образуют различные вещества, поскольку в реакцию могут вступать одна или несколько гидроксильных групп. Состав продуктов окисления зависит от взаимного положения ОН-групп в молекулах полигидроксильного соединения и природы окислителя.
Соединения с ОН-группами у соседних атомов углерода (1,2-диолы, 1,2,3-триолы и т.п.) окисляются наиболее легко. В зависимости от условий их окисление происходит с сохранением
C–C-связей
углеродного скелета (пример 1) или с их разрывом (пример 2) вплоть до полного разрушения С-скелета (пример 3).
Пример 1. Окисление этиленгликоля при действии CrO3 или HNO3

Пример 2. Окисление раствором перманганата калия в кислой среде при нагревании
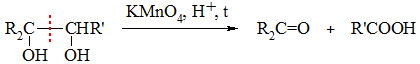
Кетон R2C=O образуется из фрагмента, содержащего третичную спиртовую группу, а карбоновая кислота R’COOH – из фрагмента с вторичной группой ОН.
При наличии фрагмента с первично-спиртовой группой –CH2OH образуется CO2:

Пример 3. Взаимодействие глицерина с кристаллическим перманганатом калия (видео)
Реакция глицерина HOCH2–CH(OH)–CH2OH с тонко измельчённым кристаллическим KMnO4 начинается самопроизвольно и идёт с высокой скоростью при выделении большого количества тепла. При этом глицерин окисляется полностью до углекислого газа и воды:
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О + Q
Характерной реакцией многоатомных спиртов с соседними ОН-группами является окисление водным раствором иодной кислоты HIO4, которая не окисляет одноатомные спирты и многоатомные спирты других типов. Подробнее…
Реакция протекает через стадию образования циклического сложного эфира иодной кислоты (иодата), который расщепляется далее по связи С–С с выделением иодноватой кислоты:

В отличие от деструктивного окисления перманганатом калия, продуктами реакции с иодной кислотой являются альдегиды и (или) кетоны.
В случае трёх соседних C–ОН-групп средняя группа окисляется до муравьиной кислоты НСООН:

Данная реакция, называемая гликольным расщеплением, используется для установления числа и положения ОН-групп в полигидроксильных соединениях (главным образом, в углеводах) путём определения количества израсходованного окислителя и анализа продуктов окисления.
Кроме иодной кислоты для гликольного расщепления применяют также тетраацетат свинца (CH3COO)4Pb в органическом растворителе.
Фенолы окисляются легче спиртов. Эти реакции протекают многоступенчато с образованием довольно сложной смеси продуктов. Многие из фенолов, являясь бесцветными веществами, при стоянии на воздухе приобретают окраску за счёт примеси продуктов окисления.
Действие на фенол сильных окислителей (CrО3, хромовая смесь) приводит к образованию пара-бензохинона (наряду с другими продуктами окисления). Реакция идёт с отщеплением наиболее подвижного атома водорода в пара-положении бензольного кольца.

Значительно легче окисляются многоатомные фенолы.
Поэтому они являются более сильными восстановителями, чем одноатомные фенолы. Например, двухатомный фенол гидрохинон применяется как антиоксидант и ингибитор радикальной полимеризации, а также как проявитель в классической фотографии:

Наиболее сильными восстановителями являются трёхатомные фенолы, легко окисляющиеся даже кислородом воздуха. На этом основано применение в газовом анализе щелочного раствора пирогаллола , количественно поглощающего кислород.
, количественно поглощающего кислород.
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:
2CH3OH + 3O2 2CO2 + 4H2O
Полное окисление метанола идет схеме:
При сгорании спиртов выделяется большое количество тепла.
C2H5OH + 3O2 2CO2 + 3H2O + 1370 кДж
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторной практике этанол применяется как горючее для «спиртовок».
- Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия».
В
химических реакциях гидроксисоединений возможно разрушение одной из двух
связей:
·
С–ОН
с отщеплением ОН-группы
·
О–Н
с отщеплением водорода
Это
могут быть реакции замещения, в которых происходит замена ОН или Н, или
реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный
характер связей С–О и О–Н способствует гетеролитическому их разрыву и
протеканию реакций по ионному механизму. При разрыве связи О–Н с
отщеплением протона (Н+) проявляются кислотные свойства
гидроксисоединения, а при разрыве связи С–О – свойства основания и
нуклеофильного реагента.
С
разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции,
давая различные классы соединений. Вследствие доступности гидроксильных
соединений, в особенности спиртов, каждая из этих реакций является одним из
лучших способов получения определенных органических соединений.
I. Кислотно-основные
RO— + H+ ↔ ROH ↔ R+ + OH-
алкоголят-ион
Кислотные свойства
уменьшаются в ряду, а основные возрастают:
HOH → R-CH2-OH →
R2CH-OH → R3C-OH
вода первичный вторичный третичный
Кислотные свойства
С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2
этилат натрия
Алкоголяты подвергаются гидролизу, это доказывает,
что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH +
NaOH
Основные свойства
С галогенводородными кислотами:
C2H5OH + HBr
H2SO4(конц)↔ C2H5Br
+ H2O
бромэтан
Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной
способности происходит в следующих рядах:
первичные <
вторичные < третичные
II. Окисление
1). В присутствии
окислителей [O] – K2Cr2O7
или KMnO4 спирты окисляются до карбонильных
соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Третичные спирты более устойчивы к
действию окислителей. Они окисляются только в жестких условиях (кислая
среда, повышенная температура), что приводит к разрушению углеродного
скелета молекулы и образованию смеси продуктов (карбоновых кислот и
кетонов с меньшей молекулярной массой).
В кислой среде:
Для первичных и
вторичных одноатомных спиртов качественной реакцией является взаимодействие их
с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72-
исчезает и появляется зеленоватая окраска, характерная для иона Cr3+ .
Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4
→ CO2 + K2SO4 + Cr2(SO4)3
+ 6H2O
3CH3-CH2-OH + K2Cr2O7
+ 4H2SO4 → 3CH3COH + K2SO4
+ Cr2(SO4)3 + 7H2O
В более жёстких
условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
3CH3-CH2-OH + 2K2Cr2O7
+ 8H2SO4 t→ 3CH3COOH + 2K2SO4
+ 2Cr2(SO4)3 + 11H2O
Третичные спирты
устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при
нагревании, в кислой среде) они окисляются с расщеплением связей С-С и
образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих
карбоновых кислот.
2). Качественная реакция на первичные спирты!
3). Горение(с увеличением массы углеводородного радикала –
пламя становится всё более коптящим)
CnH2n+1-OH
+ O2t → CO2
+ H2O + Q
III. Реакции
отщепления
1)
Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 + H2O
бутанол-2 бутен-2
В тех случаях, когда возможны 2 направления реакции,
например:
дегидратация
идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена. Правило
Зайцева: Водород отщепляется от
наименее гидрированного атома углерода соседствующего с углеродом, несущим
гидроксил.
2) Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
— при переходе
от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов;
уменьшается способность образовывать простые эфиры.
3)
Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В.
Лебедева
2C2H5OH — 425,ZnO,Al2O3→ CH2=CH-CH=CH2 + H2
+ 2H2O
IV. Реакции
этерификации
Спирты
вступают в реакции с минеральными и органическими кислотами, образуя сложные
эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).

Видео-опыты:
Горение спиртов
Взаимодействие этилового спирта с металлическим натрием
Взаимодействие этилового спирта с бромоводородом
Качественная реакция наэтанол
Окисление этилового спиртаоксидом меди (II)
Окисление этилового спиртараствором перманганата калия
Окисление этилового спиртакристаллическим перманганатом калия
Каталитическое окислениеэтанола
Окисление этанола (тест наалкоголь)
