Какое физическое свойство не характерно для воды

Самое важное, уникальное по свойствам и составу вещество нашей планеты — это, конечно, вода. Ведь именно благодаря ей на Земле жизнь есть, в то время как на других известных сегодня объектах Солнечной системы ее нет. Твердая, жидкая, в виде пара — она нужна и важна любая. Вода и ее свойства составляют предмет изучения целой научной дисциплины — гидрологии.
Количество воды на планете
Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75% от общей массы. При этом следует учитывать связанную воду в органических соединениях, живых существах, минералах и прочих элементах.

Если учитывать только жидкое и твердое состояние воды, показатель падет до 70,8%. Рассмотрим, как распределяются эти проценты, где содержится рассматриваемое вещество.
- Соленой воды в океанах и морях, солончаковых озерах на Земле 360 млн км2.
- Пресная вода распределена неравномерно: ее в ледниках Гренландии, Арктики, Антарктиды заковано во льды 16,3 млн км2.
- В пресных реках, болотах и озерах сосредоточено 5,3 млн км2 оксида водорода.
- Подземные воды составляют 100 млн м3.
Именно поэтому космонавтам из далекого космического пространства видно Землю в форме шара голубого цвета с редкими вкраплениями суши. Вода и ее свойства, знание особенностей строения являются важными элементами науки. К тому же, в последнее время человечество начинает испытывать явную нехватку пресной воды. Может быть, такие знания помогут в решении данной проблемы.
Состав воды и строение молекулы
Если рассмотреть эти показатели, то сразу станут понятны и свойства, которые проявляет это удивительное вещество. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, поэтому имеет эмпирическую формулу Н2О. Кроме того, при построении самой молекулы большую роль играют электроны обоих элементов. Посмотрим, что собой представляют структура воды и ее свойства.
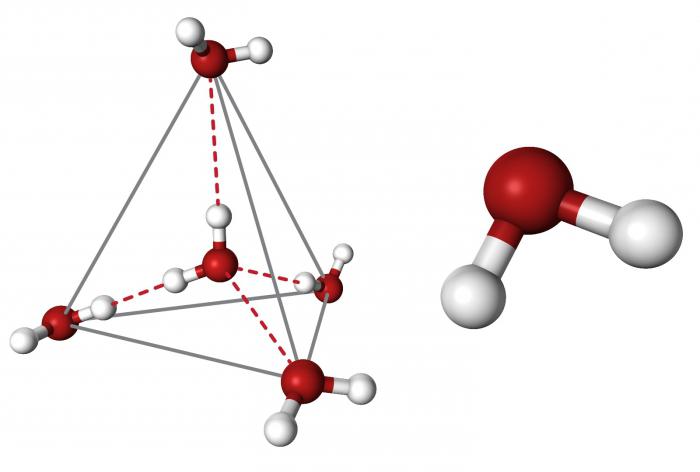
Очевидно, что каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Интересно то, что оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Угол между центром атома кислорода и ядрами водородов составляет 104,5 0С. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода, и ее физические свойства также зависят от строения молекулы. Для живых существ эти особенности играют жизненно важную роль.
Основные физические свойства
К таковым принято относить кристаллическую решетку, температуры кипения и плавления, особенные индивидуальные характеристики. Все их и рассмотрим.
- Строение кристаллической решетки оксида водорода зависит от агрегатного состояния. Оно может быть твердым — лед, жидким — основная вода при обычных условиях, газообразным — пар при повышении температуры воды свыше 100 0С. Красивые узорные кристаллы формирует лед. Решетка в целом рыхлая, но соединение очень прочное, плотность низкая. Видеть ее можно на примере снежинок или морозных узоров на стеклах. У обычной воды решетка не имеет постоянной формы, она изменяется и переходит из одного состояния в другое.
- Молекула воды в космическом пространстве имеет правильную форму шара. Однако под действием земной силы тяжести она искажается и в жидком состоянии принимает форму сосуда.
- То, что по структуре оксид водорода — диполь, обуславливает следующие свойства: высокая теплопроводность и теплоемкость, которая прослеживается в быстром нагревании и долгом остывании вещества, способность ориентировать вокруг себя как ионы, так и отдельные электроны, соединения. Это делает воду универсальным растворителем (как полярным, так и нейтральным).
- Состав воды и строение молекулы объясняют способность этого соединения образовывать множественные водородные связи, в том числе с другими соединениями, имеющими неподеленные электронные пары (аммиак, спирт и прочие).
- Температура кипения жидкой воды — 1000С, кристаллизация наступает при +40С. Ниже этого показателя — лед. Если же увеличивать давление, то температура кипения воды резко возрастет. Так, при высоких атмосферах в ней можно растопить свинец, но она при этом даже не закипит (свыше 3000С).
- Свойства воды весьма значимы для живых существ. Например, одно из самых важных — поверхностное натяжение. Это формирование тончайшей защитной пленки на поверхности оксида водорода. Речь идет о воде в жидком состоянии. Эту пленку разорвать механическим воздействием очень сложно. Учеными установлено, что понадобится сила, равная весу в 100 тонн. Как ее заметить? Пленка очевидна, когда вода капает из крана медленно. Видно, что она словно в какой-то оболочке, которая растягивается до определенного предела и веса и отрывается в виде круглой капельки, слегка искаженной силой тяжести. Благодаря поверхностному натяжению многие предметы могут находиться на поверхности воды. Насекомые, имеющие особые приспособления, могут свободно передвигаться по ней.
- Вода и ее свойства аномальны и уникальны. По органолептическим показателям данное соединение — бесцветная жидкость без вкуса и запаха. То, что мы называем вкусом воды, — это растворенные в ней минералы и другие компоненты.
- Электропроводность оксида водорода в жидком состоянии зависит от того, сколько и каких солей в нем растворены. Дистиллированная вода, не содержащая никаких примесей, электрический ток не проводит.
Лед — это особое состояние воды. В структуре этого ее состояния молекулы связаны друг с другом водородными связями и формируют красивую кристаллическую решетку. Но она достаточно неустойчива и легко может расколоться, растаять, то есть деформироваться. Между молекулами сохраняется множество пустот, размеры которых превышают размеры самих частиц. Благодаря этому плотность льда меньше, чем жидкого оксида водорода.

Это имеет большое значение для рек, озер и прочих пресных водоемов. Ведь в зимний период вода в них не замерзает полностью, а лишь покрывается плотной коркой более легкого льда, всплывающего наверх. Если бы данное свойство не было характерно для твердого состояния оксида водорода, то водоемы промерзали бы насквозь. Жизнь под водой была бы невозможна.
Кроме того, твердое состояние воды имеет большое значение как источник огромного количества питьевых пресных запасов. Это ледники.
Особенным свойством воды можно назвать явление тройной точки. Это такое состояние, при котором лед, пар и жидкость могут существовать одновременно. Для этого требуются такие условия, как:
- высокое давление — 610 Па;
- температура 0,010С.
Показатель прозрачности воды варьируется в зависимости от посторонних примесей. Жидкость может быть полностью прозрачной, опалесцентной, мутной. Поглощаются волны желтого и красного цветов, глубоко проникают лучи фиолетовые.

Химические свойства
Вода и ее свойства — важный инструмент в понимании многих процессов жизнедеятельности. Поэтому они изучены очень хорошо. Так, гидрохимию интересуют вода и ее химические свойства. Среди них можно назвать следующие:
- Жесткость. Это такое свойство, которое объясняется наличием солей кальция и магния, их ионов в растворе. Подразделяется на постоянную (соли названных металлов: хлоридов, сульфатов, сульфитов, нитратов), временную (гидрокарбонаты), которая устраняется кипячением. В России воду перед использованием смягчают химическим путем для лучшего качества.
- Минерализация. Свойство, основанное на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ, ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Окислительно-восстановительные свойства. Как универсальный растворитель, катализатор, ассоциат, вода способна взаимодействовать с множеством простых и сложных соединений. С одними она выступает в роли окислителя, с другими — наоборот. Как восстановитель реагирует с галогенами, солями, некоторыми менее активными металлами, с многими органическими веществами. Последние превращения изучает органическая химия. Вода и ее свойства, в частности, химические, показывают, насколько она универсальна и уникальна. Как окислитель она вступает в реакции с активными металлами, некоторыми бинарными солями, многими органическими соединениями, углеродом, метаном. Вообще химические реакции с участием данного вещества нуждаются в подборе определенных условий. Именно от них и будет зависеть исход реакции.
- Биохимические свойства. Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой.
- Взаимодействие с газами с образованием клатратов. Обычная жидкая вода может поглощать даже неактивные химически газы и располагать их внутри полостей между молекулами внутренней структуры. Такие соединения принято называть клатратами.
- Со многими металлами оксид водорода формирует кристаллогидраты, в которые он включен в неизменном виде. Например, медный купорос (CuSO4*5H2O), а также обычные гидраты (NaOH*H2O и другие).
- Для воды характерны реакции соединения, при которых происходит образование новых классов веществ (кислот, щелочей, оснований). Они не являются окислительно-восстановительными.
- Электролиз. Под действием электрического тока молекула разлагается на составные газы — водород и кислород. Один из способов получения их в лаборатории и промышленности.
С точки зрения теории Льюиса вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоей амфотерности в химических свойствах.

Вода и ее полезные свойства для живых существ
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода — источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода — источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода — это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород — газ, благодаря которому существует жизнь на нашей планете.
Можно назвать еще десятки причин того, почему вода — это самое широко распространенное, важное и необходимое вещество для всех живых и искусственно созданных человеком объектов. Мы привели только самые очевидные, главные.

Гидрологический цикл воды
Иными словами, это ее круговорот в природе. Очень важный процесс, позволяющий постоянно пополнять исчезающие запасы воды. Как он происходит?
Основных участников трое: подземные (или грунтовые) воды, поверхностные воды и Мировой океан. Важна также и атмосфера, конденсирующая и выдающая осадки. Также активными участниками процесса являются растения (в основном деревья), способные поглощать огромное количество воды в сутки.
Итак, процесс происходит следующим образом. Грунтовые воды заполняют подземные капилляры и стекаются к поверхности и Мировому океану. Затем поверхностные воды поглощаются растениями и транспирируются в окружающую среду. Также происходит испарение с огромных площадей океанов, морей, рек, озер и прочих водоемов. Попав в атмосферу, вода что делает? Конденсируется и проливается обратно в виде осадков (дождь, снег, град).
Если бы не происходили эти процессы, то запасы воды, особенно пресной, давно бы уже закончились. Именно поэтому охране и нормальному гидрологическому циклу уделяется людьми большое внимание.
Понятие о тяжелой воде
В природе оксид водорода существует в виде смеси изотопологов. Это связано с тем, что водород формирует три вида изотопа: протий 1Н, дейтерий 2Н, тритий 3Н. Кислород, в свою очередь, также не отстает и образует три устойчивые формы: 16О, 17О, 18О. Именно благодаря этому существует не просто обычная протиевая вода состава Н2О (1Н и 16О), но еще и дейтериевая, и тритиевая.

При этом устойчива по структуре и форме именно дейтериевая (2Н), которая включается в состав практически всех природных вод, но в малом количестве. Именно ее называют тяжелой. Она несколько отличается от обычной или легкой по всем показателям.
Тяжелая вода и ее свойства характеризуются несколькими пунктами.
- Кристаллизуется при температуре 3,82 0С.
- Кипение наблюдается при 101,42 0С.
- Плотность составляет 1,1059 г/см3.
- Как растворитель в несколько раз хуже легкой воды.
- Имеет химическую формулу D2O.
При проведении опытов, показывающих влияние подобной воды на живые системы, было установлено, что жить в ней способны лишь некоторые виды бактерий. Для приспособления и акклиматизации колониям потребовалось время. Но, приспособившись, они полностью восстановили все жизненно важные функции (размножение, питание). Кроме того, стали очень устойчивы к воздействию радиоактивного излучения. Опыты на лягушках и рыбах положительного результата не дали.
Современные области применения дейтерия и образованной им тяжелой воды — атомная и ядерная энергетика. Получить в лабораторных условиях такую воду можно при помощи электролиза обычной — она образуется как побочный продукт. Сам дейтерий формируется при многократных перегонках водорода в специальных устройствах. Применение его основано на способности замедлять нейтронные синтезы и протонные реакции. Именно тяжелая вода и изотопы водорода — основа для создания ядерной и водородной бомбы.
Опыты на применении дейтериевой воды людьми в небольших количествах показали, что задерживается она недолго — полный вывод наблюдается через две недели. Употреблять ее в качестве источника влаги для жизни нельзя, однако техническое значение просто огромно.
Талая вода и ее применение
Свойства такой воды издревле были определены людьми как целебные. Давно было замечено, что при таянии снега животные стараются напиться водой из образовавшихся лужиц. Позже были тщательно исследованы ее структура и биологическое воздействие на организм человека.

Талая вода, ее признаки и свойства находятся посередине между обычной легкой и льдом. Изнутри она образована не просто молекулами, а набором кластеров, сформированных кристаллами и газом. То есть внутри пустот между структурными частями кристалла находятся водород и кислород. По общему виду строение талой воды сходно со строением льда — сохраняется структурность. Физические свойства такого оксида водорода незначительно меняются в сравнении с обычным. Однако биологическое воздействие на организм отличное.
При замораживании воды первой фракцией превращается в лед более тяжелая часть — это дейтериевые изотопы, соли и примеси. Поэтому эту сердцевину следует удалять. А вот остальная часть — чистая, структурированная и полезная вода. Каково воздействие на организм? Учеными Донецкого НИИ были названы следующие виды улучшений:
- Ускорение восстановительных процессов.
- Укрепление иммунитета.
- У детей после ингаляций такой водой происходит восстановление и излечение простудных заболеваний, проходит кашель, насморк и прочее.
- Улучшается дыхание, состояние гортани и слизистых оболочек.
- Общее самочувствие человека, активность повышаются.
Сегодня существует ряд сторонников лечения именно талой водой, которые пишут свои положительные отзывы. Однако есть ученые, в том числе медики, которые эти взгляды не поддерживают. Они считают, что вреда от такой воды не будет, но и пользы мало.
Энергетика
Почему свойства воды могут изменяться и восстанавливаться при переходе в разные агрегатные состояния? Ответ на этот вопрос следующий: у данного соединения существует своя информационная память, которая записывает все изменения и приводит к восстановлению структуры и свойств в нужное время. Биоэнергетическое поле, через которое проходит часть воды (та, что поступает из космоса), несет в себе мощный заряд энергии. Эту закономерность часто используют при лечении. Однако с медицинской точки зрения не каждая вода способна оказать благоприятный эффект, в том числе и информационный.
Структурированная вода — что это?
Это такая вода, которая имеет несколько иное строение молекул, расположение кристаллических решеток (такое, которое наблюдается у льда), но это все же жидкость (талая также относится к этому типу). В этом случае состав воды и ее свойства с научной точки зрения не отличаются от тех, что характерны для обычного оксида водорода. Поэтому структурированная вода не может иметь такого широкого лечебного эффекта, который ей приписывают эзотерики и сторонники нетрадиционной медицины.
Благодаря своим уникальным физическим и химическим
свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем
состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно
много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять
накопленное тепло и остыть. Вот почему она используется в системах охлаждения
(например, в автомобильных радиаторах или для охлаждения промышленного
оборудования). Эта характеристика объясняет также то, почему в прибрежных (или
озерных) регионах температура воздуха мягче: в этих местах, когда времена года
меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается
или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды
определяют ее особое биологическое значение, первым делом нужно вспомнить, что
она имеет высокое поверхностное натяжение. Это означает, что после наливания на
гладкую поверхность она имеет тенденцию образовывать сферические капли, а не
растекаться в тонкую пленку. И это свойство во многом объясняет высокую
биологическую активность воды. Без гравитации капля ее была бы совершенно
сферической. Поверхностное натяжение позволяет растениям поглощать воду,
содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой
«проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко
стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, то
есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше
уровень, тем ниже температура, при которой вода начинает кипеть). Значения
кипения и замерзания воды берут в качестве контрольной точки для калибровки
термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а
100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность
уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или
лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она
является единственным на Земле веществом, которое можно найти во всех трех
физических состояниях в зависимости от температуры окружающей среды: жидкой,
твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — H2O: два атома водорода
(H2) связаны с одним атомом кислорода (O). Электроны атома (частицы с
отрицательным зарядом) устанавливают связи между собой. Кислород способен
держать их ближе к нему, чем водород. Молекула эта оказывается заряженной
отрицательно вблизи атома кислорода и положительно вблизи атомов водорода.
Поскольку противоположности притягиваются, молекулы воды имеют тенденцию
соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она
может растворять больше веществ, чем любая другая жидкость. И нам очень с этим
повезло: если бы не это химическое свойство, мы не могли бы выпить чашку
горячего подслащенного чая, потому что сахар остался бы на дне чашки. Вот
почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на
первый взгляд, на самом деле содержат огромное количество растворенных
элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри
нашего тела, вода растворяет в себе и несет чрезвычайно большое количество
различных веществ. Таким образом, она выполняет драгоценную задачу: переносить
иногда на большие расстояния вещества, с которыми она сталкивается на своем
пути. Причем, с водой при обычных климатических условиях не реагирует
большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7
(средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода
реагирует с немногими веществами, например, серой, некоторыми солями и
металлами. Также возможен гидролиз (распад) воды при реакции с какими-то
химическими веществами.
Вода может содержать огромное количество взвешенных частиц
разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение
чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая
и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих
случаях зависит от водородных связей внутри ее молекул. При сравнении этих
свойств со свойствами атомов или не связанных с водородом молекулярных
жидкостей с аналогичными размерами молекул некоторые особенности воды
заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании,
приводит ко многим последствиям в природе. Именно вода и ее свойство легко
проникать в расщелины скал, когда она замерзает, приводит к разрушению скал.
Постепенно происходит физическое и химическое выветривание скальных пород. И, в
конечном итоге, физические свойства и химические функции воды сформировали
почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а
не в точке замерзания, имеет важное значение для термического расслоения и
циркуляции воды в природе. Это химико-физическое свойство воды приводит к
замерзанию водоемов от их поверхности в направлении дна. Это важно не только
для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы
океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за
время лета, было бы достаточно только для оттаивания самого верхнего слоя. Так
осуществляется круговорот энергии и материи, которая опирается на циркуляции
океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его
способность хранить огромное количество энергии. Таким образом, водные потоки,
например, Гольфстрим, способны нести огромное количество тепла из более теплых
климатических зон в более холодные. Таким образом, океаны работают как огромные
термостаты. Не только климат Земли, но и температурное регулирование живых
организмов зависит от высокой теплоемкости воды. Это способствует, например,
поддержанию постоянной температуры тела у теплокровных организмов. Кроме того,
относительно высокая теплопроводность воды предотвращает серьезные локальные
колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03
мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных
водоемах значительно выше, из-за растворенных ионных компонентов. Вода, будучи
сильным диэлектриком (водный диэлектрик – константа), является одним из самых
лучших растворителей для солей и газов, которые способны к сольволизу с
последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для
гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть
воды. Она определяет количество воды, которое переходит в газовую фазу и может
транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в
физическом и химическом плане. Особые свойства воды сделали ее колыбелью и
абсолютным условием жизни на Земле. Зная основные характеристики этого
вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим
свойствам вода стала жидкой основой жизни.
