Какими свойствами обладает азотная кислота
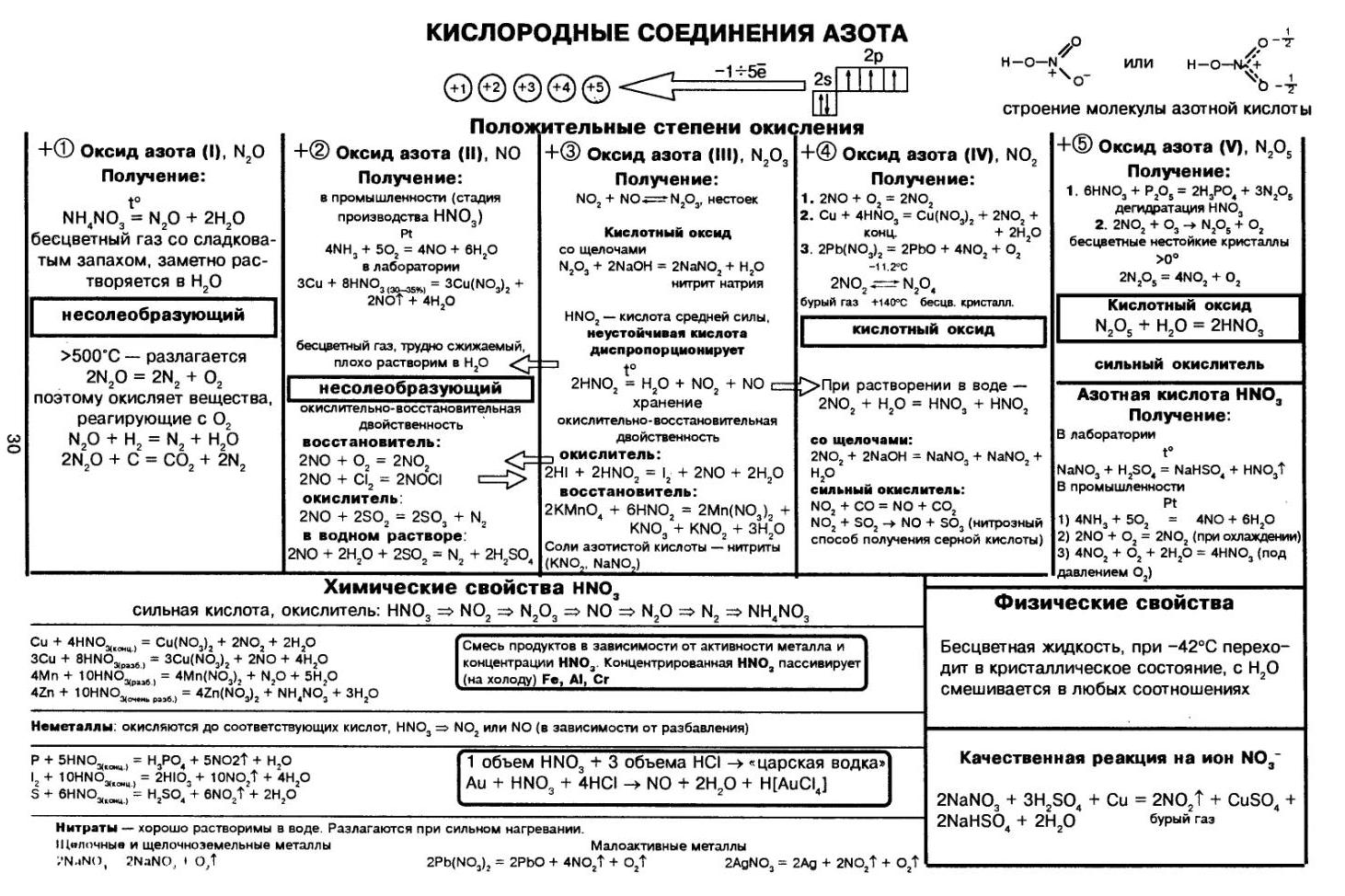

Химические
свойства азотной кислоты
Для азотной
кислоты характерны свойства: общие с другими кислотами и специфические:
ХИМИЧЕСКИЕ
СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1.
Очень сильная кислота. Индикаторы в
её растворе изменяют цвет на красный.
Диссоциирует в водном растворе
практически нацело:
HNO3 → H+ +
NO3-
Изменение цветов индикаторов в
кислотах
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+
+ 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
3.
Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH-
→ Na+ + NO3- + H2O
H+ + OH- → H2O
4.
Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3
+ H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3-
+ H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная
кислота — сильный окислитель
N+5
→ N+4→ N+2→ N+1→ No →N-3
N+5
+ 8e—→N-3
окислитель, восстанавливается.
1.
Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2
+ O2
Образуется бурый газ
2.
Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук —
«ксантопротеиновая реакция»)
3.
Реагирует с металлами.
В зависимости от концентрации кислоты и
положения металла в электрохимическом ряду напряжений Н. Бекетова могут
образовываться разные азотсодержащие продукты.

При взаимодействии с металлами никогда
не выделяется водород
HNO3 + Me = соль + H2O + Х
Щелочные и щелочноземельные | Fe, Cr, Al, | Металлы до водорода | Металлы после водорода (Cu и др) | Благородные Au, Pt, Os, Ir, Ta | |
HNO3 | N2O | пассивация (при обычных условиях); NO2 (при нагревании) | NO2 | NO2 | Нет реакции |
HNO3 | NH3, | Основной NO, но в зависимости от | NO | ||
Таблица. Продукты реакции взаимодействия азотной
кислоты с металлами
Взаимодействие меди с азотной
кислотой

Упрощенная
схема
«Продукты реакции взаимодействия азотной
кислоты с металлами»
Царская водка: V(HNO3)
: V(HCl) = 1 : 3 растворяет
благородные металлы.
HNO3 + 4HCl + Au
= H[AuCl4]
+ NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO
+ 8H2O
4.
Реагирует с неметаллами.
Азотная кислота превращается в NO (или в
NO2); неметаллы окисляются до соответствующих кислот:
Видео «Взаимодействие азотной кислоты с углем»
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3
+ 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.)
+ неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 +
вода
HNO3(разбав.) + неметалл +
вода = окисление неметалла до кислоты в высшей степени окисления + NO
ВИДЕО — ЭКСПЕРИМЕНТЫ
Видео — Эксперимент » Индикаторы в
азотной кислоте»
Видео — Эксперимент «Действие
азотной кислоты на белки»
Видео — Эксперимент «Действие
азотной кислоты на бумагу и солому»
Видео — Эксперимент «Взаимодействие
меди с азотной кислотой»
Видео — Эксперимент «Свойства
азотной кислоты»
Видео — Эксперимент «Взаимодействие
азотной кислоты с металлами»
Видео — Эксперимент «Взаимодействие
безводной азотной кислоты с белым фосфором»
Видео — Эксперимент «Взаимодействие
безводной азотной кислоты с углем»
Видео — Эксперимент «Взаимодействие
безводной азотной кислоты со скипидаром»
Видео — Эксперимент «Окислительные
свойства азотной кислоты»
Тренажёр «Взаимодействие азотной
кислоты с металлами»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществите
превращения по схеме, назовите вещества, для УХР со * составить ОВ баланс, а
для** разбор РИО:
NH4Cl**→ NH3* → N2 → NO → NO2
→ HNO3 → NO2
№2. Осуществить превращения по схеме
(внимательно посмотрите, куда направлены стрелки):
Соль аммония←Аммиак←Нитрид Лития ←Азот →
Оксид азота (II)←Азотная кислота
Для ОВР составить е-баланс, для РИО
полные, ионные уравнения.
№3. Напишите уравнения реакций взаимодействия
азотной кислоты со следующими веществами в молекулярном и ионном виде:
a) Al2O3
б) Ba(OH)2
в) Na2S
№4. Запишите уравнения, составьте
электронный баланс, укажите процессы окисления и восстановления, окислитель и
восстановитель:
А) Сa + HNO3 (конц.)
Б) Сa + HNO3 (paзбавл.)
№5. Осуществите переход по ссылке,
изучите информацию на странице и посмотрите видео , нажмите «посмотреть
опыт».
Напишите в молекулярном и ионном виде уравнения реакций, с помощью которых
можно различить азотную, серную и соляную кислоту.
Это интересно:
«Фотохимический смог»
Азотная кислота. Общая характеристика, химические свойства.

На этом уроке мы пройдем одно из важнейших веществ, широко используемое в химической промышленности, а также присутствующее практически во всех вариантах ЕГЭ по химии, — азотную кислоту.
Мало кто знает о том, что в зависимости от концентрации азотная кислота имеет различные внешние характеристики:
- 63% процентная HNO3, которая поступает в продажу, не дымит, представляет собой бесцветную жидкость, разбавленную водой;
- 86%— ная азотная кислота представляет собой красную дымящую жидкость (дымит красным цветом из-за тетраоксида азота — N2O4), имеет международное название RFNA (Red fuming nitric acid), используется в ракетного топлива;
- 99,9% процентная HNO3 — WFNA (White fuming nitric acid) — белая дымящая азотная кислота, данный ранг вещества используется в индустрии взрывчаток, а также используется в ракетном топливе, кислота такой высокой концентрации, однако, безопаснее RFNA по причине отсутствия N2O4.
Важно! Концентрированная азотная кислота при попадании на кожу окрашивает ее в желтый цвет, смыть ее практически невозможно, она сама исчезнет через некоторое время — этот эффект называется ксантопротеиновая реакция.
В рамках подготовки к ЕГЭ мы пройдем основные химические свойства двух конфигураций азотной кислоты — концентрированной и разбавленной в виде таблиц.
Сначала необходимо знать способы получения азотной кислоты.
Получение HNO3 | |
Метод Оствальда | Метод Глаубера |
N2 + 3H2 = 2NH3; 4NH3 + 5O2 = 4NO + 6H2O + Q; 2NO + O2 = 2NO2; 4NO2 + O2 + 2H2O = 4HNO3 (68% — ная). | Ba(NO3)2 + H2SO4 (k.) = BaSO4 +2HNO3 (150 C) |
Теперь рассмотрим как реагирует HNO3 с металлами
HNO3+ Meталл | |||
Концентрированная | Разбавленная | ||
Тяжелые металлы (Fe, Cu, Sn, Pb, Ni, Zn) | Металлы до Al (Ca, Na, Mg, Ba, K) | Тяжелые металлы (Fe, Cu, Sn, Pb, Ni, Zn) | Металлы до Al (Ca, Na, Mg, Ba, K) |
NO2 | N2O NO2 | NO NH4NO3 N2O | N2O NH4NO3 |
Cu + 4HNO3 (к.) = Cu(NO3)2 + 2NO2 + 2H2O; Zn + 4HNO3 (к.) = Zn(NO3)2 + 2NO2+ 2H2O. | 8Na +10HNO3 (к.) = 8NaNO3 + 2N2O + 5H2O; Mg +4HNO3 (к.) = Mg(NO3)2 + 2NO2 + 2H2O. | 3Сu + 8HNO3 (р.) = 3Cu(NO3)2 + 2NO+ 4H2O; 4Zn + 10HNO3 (р.) = 4Zn(NO3)2 + NH4NO3+ 3H2O; Fe + 4HNO3 (р.) = Fe(NO3)3 + NO + 2H2O. | Mg +10HNO3 (р.) = 4Mg(NO3)2 + N2O + 5H2O; 8Na +10HNO3 (р.) = 8NaNO3 +NH4NO3 + 2H2O. |
Азотная кислота реагирует также с неметаллами, как концентрированная, так и разбавленная и получением кислот и кислотных оксидов.
Важно! Si + HNO3 ≠
HNO3 + Неметалл | |
Концентрированная | Разбавленная |
NO2 | NO |
S + 6HNO3 (к.) = H2SO4 + 6NO2+ 2H2O; C + 4HNO3 (к.) = CO2 + 4NO2 + 2H2O; P (красн.) + 5HNO3 (к.) = H3PO4 + 5NO2 + H2O; I2 + 10HNO3 (к.) =2HIO3 + 10NO2 + 4 H2O. | S + 2HNO3 (р.) = H2SO4 + 2NO2; 3C + 6HNO3 (р.) = 3CO2 + 4NO + 2H2O; 3P + 5HNO3 (р.) + 2H2O = H3PO4 + 5NO. |
Азотная кислота также активно взаимодействует со сложными веществами (основаниями, оксидами, солями).
HNO3+ Сложное вещество | |
Концентрированная | Разбавленная |
1) С основными оксидами: МеО + HNO3 (k.) ≠ | 1) С основными оксидами: CaO + 2HNO3 (р.) = Ca(NO3)2 + H2O MgO +2HNO3 (р.) = Mg(NO3)2 + H2O |
2) С основаниями: Fe(OH)2 + 4HNO3 (k.) = Fe(NO3)3 + NO2 + 3H2O | 2) С основаниями: NaOH + HNO3 (р.) = NaNO3 + H2O Al(OH)3 + 3HNO3 (р.) = Al(NO3)3 + 3H2O |
3) С кислотными оксидами: P2O5 + 2HNO3 (k.) = 2HPO3 + N2O5 NO + 2HNO3 (k.) = 3NO2 + H2O SO2 +2HNO3 (k.) = H2SO4 + 2NO2 | 3) С кислотными оксидами: HемО + HNO3 (p.) ≠ |
4) С кислотами: 6HI+ 2HNO3 (k.) = 3I2 +2NO + 4H2O 6HCl + 2HNO3 (k.) = 3Cl2 +2NO + 4H2O H2S + 2HNO3 (k.) = S + 2NO2 + 2H2O (на холоду) H2S (р)+8HNO3 (k.) = H2SO4 + 8NO2 + 4H2O | 4) С кислотами: 3H3PO2 + 2HNO3 (р.) = 3H3PO3 + 2NO + H2O (на холоду); HI + HNO3 (р.) ≠ |
5) С амфотерными оксидами: As2O3 + 4HNO3 (k.) + H2O = 2H3AsO4 + 4NO2 (кипячение) | 5) С амфотерными оксидами: Al2O3 + 6HNO3 (р.) = 2Al(NO3)3 + 3H2O Fe2O3 + 6HNO3 (р.) = 2Fe(NO3)3 + 3H2O |
6) С солями: FeS + 12HNO3 (k.) =3Fe(NO3)3 +H2SO4 +9NO2 + 5H2O CuS + 8HNO3 (k.) = CuSO4 + 8NO2 + 4H2O MeCl2 + 4HNO3 (k.) = Me(NO3)3 + NO2 +2HCl + H2O (Me = Fe,Cr) | 6) С солями: Na2CO3 + 2HNO3 (р.) = 2NaNO3 + CO2 +3H2O 3PbS + 8HNO3 (р.) =3PbSO4 + 8NO + 4H2O Na2S + 4HNO3 (p.) = S + 2NO2 + 2NaNO3 + 2H2O |
В конце урока хотелось вспомнить про такое вещество как «царская водка» — это смесь 1 моль азотной кислоты и 3 молей соляной кислоты (HCl); в таком соотношении эти кислоты способны растворить драгоценные металлы (Au, Pt), причем, основным действующим агентом является атомарный хлор, который образуется при окислении HCl азотной кислотой.
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
При изучении этих таблиц, ты уже сможешь решать сложные задания второй части ЕГЭ, а также сформируешь правильное мышление относительно химических свойств многих веществ.
pangenes.ru © 2020
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O

Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O
Zn + HNO3(3% — оч. разб.) → Zn(NO3)2 + NH4NO3 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al2O3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3-
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Азотная кислота
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты: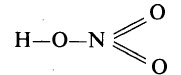
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
При обычных условиях азотная кислота – бесцветная жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе, смешивается с водой в любых соотношениях. Часто концентрированный раствор азотной кислоты окрашен в жёлтый цвет, который придаёт раствору оксид азота (IV) NO2, выделяющийся вследствие частичного разложения HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота является сильной одноосновной кислотой, в водном растворе диссоциирует на ионы: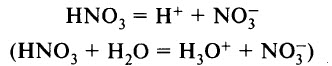
Ион Н3O+ можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
- а) со щелочами (реакция нейтрализации):
КОН + HNO3 = KNO3 + H2O
OH– + Н+ = H2O
- б) с нерастворимыми в воде основаниями:
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н+ = Mg2+ + 2H2O
- в) с амфотерными гидроксидами:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н+ = Zn2+ + 2H2O
- г) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н+ = Cu2+ + H2O
- д) с солями слабых и летучих кислот:
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО32– + 2Н+ = CO2↑ + H2O
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
- Реакция с металлами. Азотная кислота взаимодействует со многими металлами, окисляя их не за счёт Н+, а за счёт азота в высшей степени окисления (+5). В результате таких реакций водород не образуется. Продуктами реакции являются нитрат металла, продукт восстановления азота и вода. Реакция идёт по схеме:
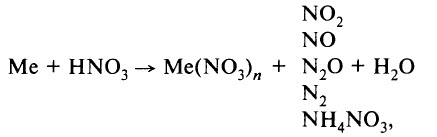
где Me – металл.
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
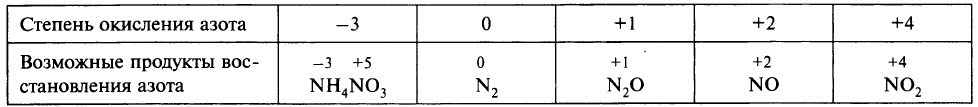
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
Глубина восстановления азота зависит:
- от природы металла (от восстановительной способности металла; чем левее положение металла в электрохимическом ряду напряжений металлов, тем глубже восстановление азота);
- от концентрации азотной кислоты (в более концентрированных растворах происходит менее глубокое восстановление азота);
- от температуры (понижение температуры способствует более глубокому восстановлению);
- от чистоты азотной кислоты.
С азотной кислотой не реагируют:
- а) благородные металлы Au, Ru, Rh, Os, Ir, Pt вследствие слишком малой их восстановительной способности;
- б) некоторые металлы (Al, Сг, Fe) не реагируют с концентрированной (> 68%) азотной кислотой вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
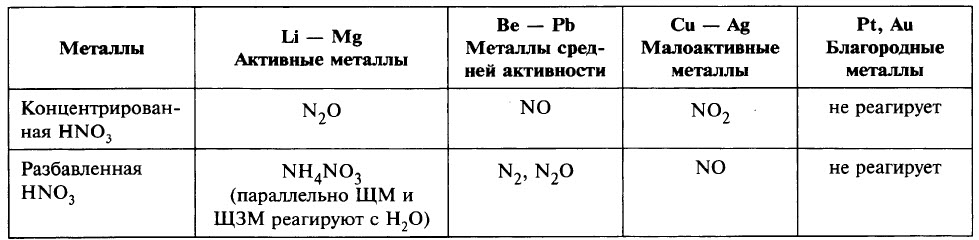
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
Классическими примерами взаимодействия азотной кислоты с металлами является растворение меди в азотной кислоте: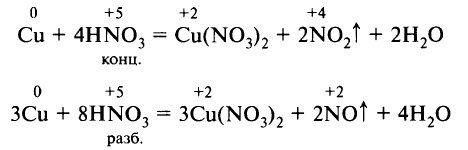
- Реакции с неметаллами. Азотная кислота реагирует с некоторыми неметаллами, способными проявлять восстановительные свойства. Например, концентрированная азотная кислота реагирует с углём, фосфором, йодом. В результате восстановления образуются NO или NO2:
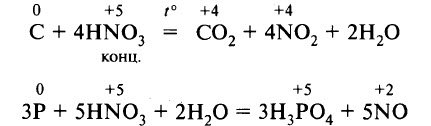
- Реакции со сложными веществами-восстановителями. Концентрированная азотная кислота является сильным окислителем, вступает в реакции с различными веществами, обладающими восстановительными способностями.
- Разложение при нагревании. При хранении, на свету или при нагревании концентрированная азотная кислота разлагается:
![]()
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:![]()
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
N2 → NH3 → NO → NO2 → HNO3
Сырьём является азот, получаемый разделением жидкого воздуха на фракции. Сначала осуществляется синтез аммиака: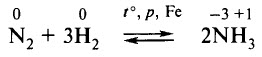
Аммиак окисляют кислородом на платиновом катализаторе:![]()
Оксид азота (II) легко окисляется кислородом воздуха:![]()
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:![]()
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
Всё про азотную кислоту кратко в одной таблице

Всё про азотную кислоту кратко в одной таблице
Конспект урока «Азотная кислота: строение, свойства, получение, применение».
Следующая тема: «».
