Какое свойство железа не связано с его применением

Железо – химический элемент
1. Положение железа в
периодической таблице химических элементов и строение его атома
Железо
— это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar(Fe) = 56; состав атома: 26-протонов;
30 – нейтронов; 26 – электронов.
Схема
строения атома:
Электронная
формула: 1s22s22p63s23p63d64s2
Металл
средней активности, восстановитель:
Fe0-2e-→Fe+2, окисляется восстановитель
Fe0-3e-→Fe+3, окисляется восстановитель
Основные
степени окисления: +2, +3
2. Распространённость
железа
Железо – один из
самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%,
по этому показателю оно уступает только
кислороду, кремнию и алюминию. Много железа находится и в небесных телах,
что установлено по данным спектрального анализа. В образцах лунного грунта,
которые доставила автоматическая станция “Луна”, обнаружено железо в
неокисленном состоянии.
Железные
руды довольно широко распространены на Земле. Названия гор на Урале говорят
сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят
соединения железа.
Железо
входит в состав большинства горных пород. Для получения железа используют
железные руды с содержанием железа 30-70% и более.
Основными железными
рудами являются:
магнетит (магнитный железняк) – Fe3O4 содержит 72%
железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
гематит (железный блеск, кровавик)– Fe2O3содержит до
65% железа, такие месторождения встречаются в Криворожском районе:
|
|
лимонит (бурый железняк) – Fe2O3*nH2O
содержит до 60% железа, месторождения встречаются в Крыму:

пирит (серный колчедан, железный
колчедан, кошачье золото) – FeS2
содержит примерно 47% железа, месторождения встречаются на Урале.

3. Роль железа в жизни
человека и растений
Биохимики
открыли важную роль железа в жизни растений, животных и человека. Входя в
состав чрезвычайно сложно построенного органического соединения, называемого
гемоглобином, железо обусловливает красную окраску этого вещества, от которого
в свою очередь, зависит цвет крови человека и животных. В организме взрослого
человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина.
Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном
направлении – CO2.
Железо
необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе
фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют
белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый
цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо,
и вскоре смазанное место зеленеет.
Так
от одной и той же причины – наличия железа в соках и тканях – весело зеленеют
листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо
– это серебристо-белый металл с температурой плавления 1539оС. Очень
пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется.
Железо обладает способностью намагничиваться и размагничиваться, поэтому
применяется в качестве сердечников электромагнитов в различных электрических
машинах и аппаратах. Ему можно придать большую прочность и твердость методами
термического и механического воздействия, например, с помощью закалки и
прокатки.
Различают
химически чистое и технически чистое железо. Технически чистое железо, по сути,
представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода,
а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо
содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый,
блестящий, по внешнему виду очень похожий на платину металл. Химически чистое
железо устойчиво к коррозии и хорошо
сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих
драгоценный свойств.
5. Получение железа
Восстановлением
из оксидов углём или оксидом углерода (II), а также водородом:
FeO + C =
Fe + CO
Fe2O3
+ 3CO = 2Fe + 3CO2
Fe2O3
+ 3H2 = 2Fe + 3H2O
Опыт «Получение железа алюминотермией»
6. Химические свойства железа
Как
элемент побочной подгруппы железо может проявлять несколько степеней окисления.
Мы рассмотрим только соединения, в которых железо проявляет степени окисления
+2 и +3. Таким образом, можно говорить, что у железа имеется два ряда
соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко
окисляется в присутствии влаги (ржавление):
4Fe +
3O2 + 6H2 O = 4Fe(OH)3
2) Накалённая железная проволока
горит в кислороде, образуя окалину — оксид железа (II,III) — вещество чёрного цвета:
3Fe +
2O2 = Fe3O4
C кислородом во влажном воздухе образуется Fe2O3*nH2O
Опыт «Взаимодействие железа с кислородом»
3) При высокой
температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O t˚C→
Fe3O4 + 4H2
4) Железо
реагирует с неметаллами при нагревании:
2Fe + 3Br2 t˚C→
2FeBr3
Fe + S t˚C→ FeS
5) Железо
легко растворяется в соляной и разбавленной серной кислотах при обычных
условиях:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4(разб.) = FeSO4
+ H2
6) В концентрированных кислотах –
окислителях железо растворяется только при нагревании
2Fe + 6H2SO4(конц.) t˚C→
Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) t˚C→ Fe(NO3)3
+ 3NO2 + 3H2O
На холоде
концентрированные азотная и серная кислоты пассивируют железо!
Опыт «Взаимодействие железа с концентрированными кислотами»
7) Железо
вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe +
CuSO4 = FeSO4 + Cu
8) Качественные реакции на
Железо (II)
Железо (III)
7. Применение железа.
Основная
часть получаемого в мире железа используется для получения чугуна и стали —
сплавов железа с углеродом и другими металлами. Чугуны содержат около 4%
углерода. Стали содержат углерода менее 1,4%.
Чугуны
необходимы для производства различных отливок — станин тяжелых машин и т.п.
Изделия из чугуна
Стали
используются для изготовления машин, различных строительных материалов, балок,
листов, проката, рельсов, инструмента и множества других изделий. Для
производства различных сортов сталей применяют так называемые легирующие
добавки, которыми служат различные металлы: Мn, Сr, Мо и другие, улучшающие
качество стали.
Изделия из стали
«ПОЯВЛЕНИЕ ЖЕЛЕЗА»
ЭТО ИНТЕРЕСНО
ТРЕНАЖЁРЫ
Тренажёр №1
— Генетический ряд Fe 2+
Тренажёр №2
— Генетический ряд Fe 3+
Тренажёр №3
— Уравнения реакций железа с простыми и сложными веществами
Задания для закрепления
№1. Составьте
уравнения реакций получения железа из его оксидов Fe2O3 и
Fe3O4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите
превращения по схеме:
Fe2O3 -> Fe -+H2O,
t -> X -+CO, t-> Y -+HCl-> Z
Назовите продукты X, Y, Z?
Данный урок посвящен изучению темы «Свойства железа». Вы познакомитесь со свойствами химического элемента железа, строением его атома и характерными степенями окисления. Также в уроке будут рассмотрены физические и химические свойства простого и сложных веществ, образованных железом.
Тема: Химия металлов
Урок: Свойства железа
1. Химический элемент железо
Железо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 26. Обозначается символом Fe. На внешнем четвертом слое атома железа находится 2 электрона:
Основные степени окисления железа — +2 и +3, менее характерна для железа степень окисления +6.
Железо — один из самых распространённых в земной коре металлов (второе место после алюминия). В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3), магнитный железняк (магнетит, Fe3O4), бурый железняк или лимонит.
а) б) в)
Рис. 1. Железные руды: а — магнетит, б- красный железняк, в – железный колчедан (пирит)
2. Простое вещество железо
Простое вещество железо— ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро коррозирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
При хранении на воздухе при температуре до 200 C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
С кислородом железо реагирует при нагревании. При сгорании железа в кислороде образуется оксид Fe3O4 (железная окалина):
3Fe + 2O2 = Fe3O4
Рис. 2. Горение железной проволоки в атмосфере кислорода
При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
При нагревании железо реагирует с галогенами, азотом, фосфором, кремнием, углеродом.
Рис. 3. Горение железной проволоки в атмосфере хлора
При высокой температуре (выше 700°С) железо реагирует с парами воды:
3Fe + 4H2O = Fe3O4 + 4H2.
Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
3. Оксиды и гидроксиды железа
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III).
Список рекомендованной литературы
1. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§29)
2. Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§34)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
с. 234 №№ 2-4 из учебника П.А. Оржековского «Химия: 9-ый класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
Вариант-2
Обязательная часть
В атоме химического элемента электроны распределятся по электронным слоям соответственно ряду чисел: 2,8,6. Какое место в периодической системе химических элементов занимает этот элемент?
А. Шестой период, VI группа, главная подгруппа
Б. Третий период, II группа, побочная подгруппа
В. Второй период, VI группа, главная подгруппа
Г. Третий период, VI группа, главная подгруппа
Валентность серы в соединении H2S равна
А. I Б. II В. III Г. IV
Какая схема представляет собой уравнение химической реакции?
А. Ca + O2 = CaO
Б. Ca + 2O2= CaO
В. 2Ca +O2 =CaO
Г.2Ca+ O2= 2CaO
4. К реакциям замещения относиться реакция
А. 4Na +O2= 2Na2O
Б. CaCO3=CaO+CO2
В. NaOH+HCI=NaCI+H2O
Г. Fe+CuSO4= FeSO4+Cu
Из предложенных ниже формул веществ основанием является
А. H2SiO3 Б. KOH В. CaCO3 Г. Fe2O3
Формуле Fe2(SO4)3 соответствует название
А. сульфат железа (II)
Б. хлорид железа (III)
В. сульфид железа (II)
Г. сульфат железа (III)
7. Химическая связь в кристаллах хлорида натрия NaCI
А. металлическая
Б. ковалентная полярная
В. ионная
Г. ковалентная неполярная
Какая пара веществ не взаимодействует между собой?
А. CO2 и H2O Б. NaOH и HCI В. HCI и Zn Г. Cu и H2SO4 (р-р)
Какие вещества могут взаимодействовать согласно уравнению с правой частью: ….=Na2SO4 + H2O
А. Na2O и H2SO4
Б. NaOH и H2SO4
В. NaOH и SO2
Г. NaCI и H2SO4
Какой буквой обозначен фрагмент молекулярного уравнения химической реакции, соответствующий кратному ионному уравнению
H+ + OH — = H2O
А. Cu(OH)2 + 2HCI= ….
Б. NaOH + HNO3= ….
В. BaO + 2HCI= ….
Г. CuSO4 + 2KOH= ….
Какое вещество пропущено в цепочке превращений
P …. H3PO4 Ca3(PO4)2
А. PH3 Б. HPO3 В. P2O5
Г. Na3P
Схеме превращений CI-1 CI0 соответствует уравнение
А.2NaCI = 2Na + CI2 B. 2Na + CI2 =2 NaCI
Б. H2S +CI2 = 2HCI + S Г.2NaCI+H2SO4=Na2SO4+2NaCI
Процесс окисления серы соответствуют схеме:
А. S+4 S-2
Б. S+6 S+4
В. S0 S+4
Г. S0 S-2
Какое свойство железа не связано с его применением в качестве главного конструкционного материала в настоящее время?
А. высокая прочность
Б. серебристый цвет
В. способность образовывать сплавы
Г. дешевизна по сравнению с другими металлами
15. Кислород можно распознать:
А. по цвету
Б. по запаху
В. внести тлеющую лучину, она вспыхнет
Г. внести тлеющую лучину, она потухнет
16. Рассчитайте массу гидроксида меди (II), полученного при взаимодействии раствора нитрата меди (II) с раствором, содержащим 0,4 моль гидроксида калия.
А. 0,2 моль Б. 39,2 г В. 0,4 моль Г. 19,6 г
Дополнительная часть
17. При добавлении в бесцветный раствор кислоты бесцветного раствора соли выделяется газ, окрашивающий влажную синюю лакмусовую бумажку в красный цвет. Составьте уравнение химической реакции, которая сопровождается этими признаками. Выразите ее сущность кратким ионным уравнением.
18. Составьте уравнения реакций, позволяющих осуществить превращение согласно схеме:
Na2SiO3 H2SiO3 SiO2 Si
CaSiO3
Указать (где необходимо) условия их проведения.
19. На сплав алюминия и меди массой 10 г. подействовали избытком соляной кислоты. При этом выделилось 6,72 л. газа. Вычислите массовые доли компонентов сплава.
Итоговая контрольная работа по химии за 9 класс
Вариант-1
Обязательная часть
Какой ряд чисел отражает распределение электронов по электронным слоям в атоме химического элемента, занимающего в периодической системе химических элементов место в третьем периоде, V группе, главной подгруппе?
А. 2,5 Б. 2,8,3 В. 2,8,5 Г. 2,8,8
Валентность азота в аммиаке NH3 равна
А. VI Б. II В. I Г. III
Укажите значение «x» и «у», которые соответствуют коэффициентам в уравнении химической реакции:
4AI +X O2 = Y AI2O3
А. x=2, y=3 Б. x=3, y=3 В. x=3, y=2 Г. x=2, y=2
4. К реакциям разложения относиться реакция
А. CaO+SiO2=CaSiO3
Б. 2HgO=2Hg+O2
В. Zn+2HCI=ZnCI2+H2
Г. 2Mg+O2=2MgO
Из предложенных ниже формул веществ солью является
А. HCI Б. Ca(OH)2 В. Na2O Г. AI2(SO4)3
Формуле Cu(OH) 2 соответствует название
А. оксид меди (II)
Б. гидроксид меди (I)
В. гидроксид меди (II)
Г. нитрат меди (II)
7. Формула вещества с ковалентной полярной связью
А. HCI Б. F2 В. Na2O Г. Cu
Какая пара веществ не взаимодействует между собой?
А. Na и H2O Б. CuO и H2SO4 В. HCI и SO2 Г. Ca(OH)2 и CO2
Какие вещества могут взаимодействовать согласно уравнению с правой частью: …. = MgSO4
А. Mg(OH)2 и SO3
Б. MgO и SO3
В. Mg(OH)2 и H2SO4
Г. Mg и H2SO4
Какой буквой обозначен фрагмент молекулярного уравнения химической реакции, соответствующий кратному ионному уравнению
2H+ + S2- = H2S
А. Na2S + 2HCI= ….
Б. H2O + SO2 = ….
В. FeS + 2HCI= ….
Г. K2SO3 + 2HCI = ….
Какое вещество пропущено в цепочке превращений?
Ca CaO …. CaCI2
A. CaO2 Б. CaН2 B. Ca(OH)2 Г. CaCO3
12. Схеме превращений S-2 S0 соответствует уравнение
А. H2S+Pb(NO3)2 =PbS +2HNO3
Б. 2H2S +3O2 = 2H2O +2SO2
В. 2H2S +O2 =2H2O + S
Г. 2Na + S= Na2S
13. Процесс восстановления меди соответствуют схеме:
А. Cu0 Cu+1
Б. Cu0 Cu+2
В. Cu+2 Cu0
Г. Cu+1 Cu+2
14. Из оксида кремния изготовляют точильные и шлифовальные круги, потому что он
А. не растворяется в воде
Б. химически стоек к действию
кислот
В. встречается в природе в виде минералов
Г. имеет высокую твердость
15.В растворе серной кислоты:
А. фенолфталеин становится
малиновым
Б. лакмус краснеет
В. метилоранж желтеет
Г. лакмус синеет
16. Вычислите объем водорода, образовавшегося при взаимодействии 4,8 г. магния с избытком соляной кислоты.
А. 0,2 моль Б. 4,48 л В. 0,4 г Г. 2,24 л
Дополнительная часть
17. Если в химический стакан с водой добавить несколько капель фенолфталеина и опустить туда кусочек мела, признаков реакции не наблюдается. Если же мел предварительно прокалить, удерживая его в пламени тигельными щипцами, а затем опустить в раствор фенолфталеина, то заметны признаки реакции. Какие? Почему?
18. Напишите уравнения химических реакций получения нитрата меди (II) тремя способами
19. Смесь, состоящую из 10 г. порошка серы и 10 г. порошка цинка, подожгли. Какие вещества обнаружили по окончанию процесса?
Используемая литература:
, . Программа курса, тематическое и поурочное планирование к учебнику , «Химия» для 9 класса общеобр. учреждений. – М. «Русское слово – РС», 2008
, . Самостоятельные работы по химии.
9 класс. – М. дом «ОНИКС 21 век»:
«Мир и Образование», 2006
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА
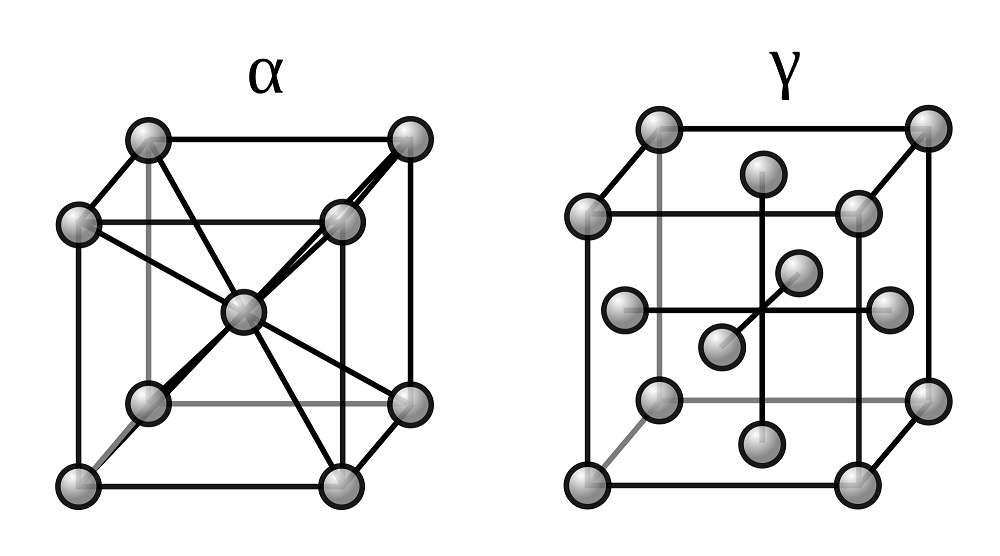
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 — 7.87 г/см3 |
| Радиоактивность (GRapi) | |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах {112} |
| Морфология | в маленьких пузырьках |
mineralpro.ru
13.07.2016



