Каким свойством обладает кислород

Анонимный вопрос · 23 декабря 2018
5,6 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Кислород (или Oxygenium)????
Химические свойства:
✅Сильный окислитель
✅Реагирует практически со всеми элементами
✅Образует оксиды
✅Окисляет простые и сложные неорганические вещества
✅Окисляет органические вещества
✅Характерна реакция горения
Физические свойства:
????Газ без цвета и запаха
????Мало растворим в воде
????Немного тяжелее воздуха
????Плотность 1,4г/л
????Температура кипения -183°C
????Температура плавления -216°C
????Атомы кислорода образуют такие вещества,как O ₂(кислород) и О ₃ (озон)
Пасиб огромное помогла на 5
Какое химическое уравнение самое важное?
Главный редактор издания «Популярный университет», химик по образованию, продвигаю массы… · popuni.ru
Хороший вопрос. Здесь стоит уточнить, для чего же оно самое важное. Для существования растительной жизни наиболее важен процесс фотосинтеза, который упрощенно можно описать в виде уравнения 6CO2+6H2O=C6H12O6 +6O2. Если же говорить о химической промышленности, то тут, пожалуй, одним из самых важных считается уравнение получения аммиака N2+3H2=2NH3, так как именно этот процесс позволил ученым получить ряд очень важных соединений, среди которых различные красители и биоорганические вещества. Но если посмотреть немного наверх и обратиться к истокам нашей жизни, получится, что главный ингредиет, благодаря которому мы такие, какие есть — это Солнце. И без термоядерных реакций, происходящих в его недрах, наше существование было бы невозможно. Один из самых основных процессов — это протон-протонная реакция, в ходе которой образуется дейтерий — изотоп водорода: 1H + 1H = D + e- (два атома водорода соединяются с образованием атома дейтерия и одного электрона). Есть еще множество видов термоядерных реакций, которые можно объединить в несколько циклов. Но это уже совсем другая история.
Прочитать ещё 1 ответ
На молекулу какого химического вещества похожа Солнечная система?
Researcher, Institute of Physics, University of Tartu
Ни на какую. Химическая связь создается за счет ковалентных и/или электростатических взаимодействий между объектами с сопоставимой массой, тогда как солнечная система — за счет гравитационных взаимодействий одного тяжелого и нескольких на порядки более легких объектов. В связи с этим, геометрически молекулы и планетарные системы очень сильно отличаются друг от друга.
Планетарная модель атома (очевидно, раз уж она так называется) похожа на солнечную систему. Но именно атома, а не какой-то молекулы.
Если животные вдыхают кислород (O2), а выдыхают углекислый газ (СО2), откуда берется С? Там что, склад углерода?
программист, предприниматель
Ну все живые организмы, начиная от бактерий — огромный склад углерода. Он — основа всех органических молекул и третий по распространенности элемент в организме животных и растений (после водорода и кислорода). Так что да, запас углерода в легких имеется.
Но углекислый газ производится не в легких. Его производят клетки при расщеплении кислородом органических соединений. Часть углекислого газа и углекислоты идут на поддержание многих процессов в организме, остальное — выходит с дыханием.
Какие вещества называют оксидами?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Оксиды это соединения различных химических элементов с кислородом. При этом кислород находистя в опредленной степени окисления. В реакцию с кислородом могут вступать и металлы, и неметаллы. Чаще всего в результате реакций с неметаллами образуются кислотные оксиды, а с металлами — основания.
Ест ли в воде кислород?
Да,конечно кислород в воде есть.
Есть ещё воды с повышенным содержанием кислорода.
Советую попробовать. Я обычно покупаю Стэлмас кислород, т.к. она есть во всех аптеках.
Конечно всё индивидуально, но я её беру всегда во время походов в спорт зал. По сути Стэлмас Кислород это питьевая столовая артезианская вода, с той лишь особенностью,что на выходе её дополнительно насыщают кислородом. Соответственно, если пить такую воду улучшается работа всего организма.
Прочитать ещё 3 ответа
Лекция «Кислород –
химический элемент и простое вещество»
План
лекции:
1. Кислород – химический элемент:
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ
б)
Валентные возможности атома кислорода
в)
Распространённость химического элемента в природе
2. Кислород – простое вещество
а)
Получение кислорода
б)
Химические свойства кислорода
в)
Круговорот кислорода в природе
г)
Применение кислорода
«Dum spiro spero» (Пока дышу, надеюсь…), — гласит
латынь
Дыхание – это синоним
жизни, а источник жизни на Земле – кислород.

Подчёркивая важность кислорода для земных
процессов, Яков Берцелиус сказал: « Кислород – это вещество, вокруг которого
вращается земная химия»
Материал данной лекции обобщает
ранее полученные знания по теме «Кислород».
1.
Кислород – химический элемент
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород — элемент главной подгруппы шестой группы,
второго периода периодической системы химических элементов
Д. И. Менделеева, с атомным порядковым номером 8. Обозначается
символом O (лат. Oxygenium). Относительная
атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
б)
Валентные возможности атома кислорода
В соединениях кислород
обычно двухвалентен (в оксидах), валентность VI
не существует. В свободном виде
встречается в виде двух простых веществ: О2 («обычный» кислород) и О3
(озон). О2 — газ без цвета и запаха, с относительной молекулярной
массой =32. О3 – газ без цвета с резким запахом, с относительной
молекулярной массой =48.
Внимание! H2O2 (перекись водорода) – O (валентность II)
СО
(угарный газ) – О (валентность III)
в)
Распространённость химического элемента кислорода в природе

Кислород — самый
распространенный на Земле элемент, на его долю (в составе различных соединений,
главным образом силикатов), приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода —
85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по
объёму и 23% по массе. Более 1500 соединений земной коры в своем составе
содержат кислород.
Кислород входит в
состав многих органических веществ и присутствует во всех живых клетках. По
числу атомов в живых клетках он составляет около 20 %, по массовой
доле — около 65 %.
2.Кислород
– простое вещество
а) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C=K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2=2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток=2H2 + O2↑
2) Из воздуха
ВОЗДУХ давление, -183˚C=O2 (голубая жидкость)
В
настоящее время в промышленности кислород получают из воздуха. В лабораториях
небольшие количества кислорода можно получать нагреванием перманганата калия
(марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее
воздуха, поэтому его можно получать двумя способами:
·
вытеснением воды;
·
вытеснением воздуха (кислород будет собираться на
дне сосуда).
Существуют и другие способы получения
кислорода.
Посмотрите видео-сюжет
получение кислорода при разложении марганцовки (перманганата калия). Полученный
кислород можно обнаружить на дне сосуда тлеющей лучинкой – она вспыхнет.
б)
Химические свойства кислорода
Взаимодействие веществ с кислородом называется окислением.
В результате образуются оксиды –
сложные вещества, состоящие из двух элементов, одним из которых является
двухвалентный атом кислорода.
Реакции окисления, протекающие с выделением тепла и
света, называют реакциями горения. Кислород взаимодействует с простыми
веществами – металлами и неметаллами; а так же со сложными веществами.
Изучите алгоритм составления уравнений реакций
окисления на примере алюминия и метана CH4.

в)
Круговорот кислорода в природе
В природе кислород
образуется в процессе фотосинтеза, который происходит в зелёных растениях на
свету. В целях сохранения кислорода в воздухе вокруг городов и крупных
промышленных центров создаются зоны зелёных насаждений.

г)
Применение кислорода
Применение кислорода
основано на его свойствах: кислород поддерживает горение и дыхание.
В заключении ещё раз отметим важность
кислорода для всего живого на нашей планете такими поэтическими строками:
«
Он всюду и везде:
В
камне, в воздухе, в воде,
Он
и в утренней росе
И небес голубизне…»
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]() С в электрической дуге, в природе – при грозовом разряде). Например:
С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t![]() );
);
4NH3 + 3O2 = 2N2↑ + 6H2O (t![]() );
);
4NH3 + 5O2 = 4NO↑ + 6H2O (t![]() , kat);
, kat);
2PH3 + 4O2 = 2H3PO4 (t![]() );
);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t![]() ).
).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t![]() );
);
2SO2 + O2 = 2SO3 (t![]() , V2O5);
, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t![]() ).
).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
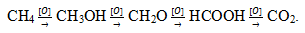
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]() С растворяется 3
С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
Наш урок посвящен химическому элементу, который занимает особое место в жизни человека и всего живого. Речь пойдет о кислороде. Вы познакомитесь с общей характеристикой химического элемента – кислорода по его положению в ПСХЭ, рассмотрим нахождение кислорода в природе, изучим способы получения кислорода и его физические свойства.
Также данный урок посвящен изучению истории открытия одного из самых известных неорганических веществ – кислорода. Из материалов урока вы узнаете, кому принадлежит приоритет открытия кислорода и кто дал название этом веществу.
Эпиграф урока
“Кислород — это вещество, вокруг которого вращается земная химия”.
Я. Берцелиус.
I. Познавательный фильм: “Кислород”
II. Общая характеристика кислорода как химического элемента по положению его в ПСХЭ
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным порядковым номером 8.
Обозначается символом O (лат. Oxygenium).
Относительная атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
Относительная молекулярная масса равна 32, т.е. Мr(O2)=32.
III. Валентность кислорода, физические свойства
В соединениях кислород обычно двухвалентен (в оксидах), валентность VI не существует. В свободном виде встречается в виде двух простых веществ: О2 («обычный» кислород) и О3 (озон). О2 — газ без цвета и запаха, с относительной молекулярной массой =32. О3 – газ без цвета с резким запахом, с относительной молекулярной массой =48.
Температура кипения сжиженного кислорода -183 С, температура плавления твердого кислорода -219 С. Интересно, что кислород притягивается магнитом.
Кислород поддерживает дыхание и горение. Причем, если внести в сосуд с кислородом тлеющую лучинку, то она вспыхнет ярким пламенем.
Это интересно: “Какого цвета твердый кислород”
При температуре 90 K газ кислород превращается в бледно-голубую жидкость, а при температуре 54 K становится твёрдым. Но твёрдый кислород твёрдому кислороду рознь: в интервале давлений от 0 до приблизительно 130 гигапаскалей (1,3 млн атмосфер) кислород может существовать по крайней мере в шести модификациях (их обозначают греческими буквами γ, β, α, δ, ε и ζ). Эти модификации отличаются друг от друга кристаллической решёткой, магнитными и электрическими свойствами, а также цветом. Например, при давлении 5,4 гПа (это примерно в 52 тысячи раз выше атмосферного) твёрдый кислород имеет бледно-голубой цвет. При дальнейшем повышении давления (до 10 гПа) твёрдый кислород становится красным. Некоторые модификации твёрдого кислорода даже называют по их характерному цвету. Например, δ-O2 называют оранжевым кислородом, а ε-O2 — красным кислородом.
IV. Кислород в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20 %, по массовой доле — около 65 %.
V. Открытие и получение кислорода
Открытие кислорода приходится на XVIII век. До этого времени считалось, что любой газ – это разновидность воздуха. Началом изучения газов послужило, казалось бы, незначительное изобретение. Английский ученый Гейлс предложил прибор для сбора газов. Заполненную водой колбу он опустил горлом вниз в сосуд с водой, в горло колбы поместил изогнутый ружейный ствол, по которому в колбу, вытесняя воду, поступали газы. Вот с этого прибора все и началось…
Приоритет открытия кислорода принадлежит англичанину Джозефу Пристли.В 1774 г. он обнаружил, что при разложении оксида ртути образуется газообразное вещество, в атмосфере которого тлеющая лучина вспыхивает ярким пламенем, а дышать этим газом особенно легко. Это был кислород. Уравнение реакции разложения оксида ртути:
2HgO = 2Hg + O2
Пристли поделился своим открытием с А.Лавуазье, и тот дал газу название «кислород».
Интересно, что еще до работ Дж. Пристли в 1771 г. опыты по разложению оксида ртути проделал шведский химик Карл Шееле. Но результаты его исследований были опубликованы только в 1775 г., поэтому Пристли о них ничего не знал.
Есть еще один интересный исторический факт. Оказывается голландский химик Корнелиус Дреббел примерно за 150 лет до Пристли и Шееле получил кислород при нагревании нитрата калия:
2KNO3 = 2KNO2 + O2
Он описал свойства полученного газообразного вещества: тлеющий уголек в нем вспыхивал, в атмосфере этого газа легко дышалось. Свое открытие ученый даже использовал на изобретенном им подводном судне. Однако в то время ученые не интересовались газами, и открытие Дреббела даже не заметили.
VI. Получение кислорода
Промышленный способ получения кислорода
В промышленных целях кислород необходимо получать в больших объёмах и максимально дешёвым способом. Такой способ получения кислорода был предложен лауреатом Нобелевской премии Петром Леонидовичем Капицей. Он изобрёл установку для сжижения воздуха. Как известно, в воздухе находится около 21% по объему кислорода. Кислород можно выделить из жидкого воздуха методом перегонки, т.к. все вещества, входящие в состав воздуха имеют разные температуры кипения. Температура кипения кислорода — -183°С, а азота — -196°С. Значит, при перегонке сжиженного воздуха первым закипит и испарится азот, а затем – кислород.
Лабораторные способы получения кислорода
В лаборатории кислород требуется не в таких больших количествах, как в промышленности. Обычно его привозят в голубых стальных баллонах, в которых он находится под давлением. В некоторых случаях всё же требуется получить кислород химическим путём. Для этого используют реакции разложения.
1. Разложение пероксида водорода
При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вокруг крупинок черного оксида сразу начинают выделяться пузырьки газа. Это кислород. Как бы долго ни протекала реакция, крупинки оксида марганца(IV) в растворе не растворяются. То есть, оксид марганца(IV) участвует в реакции, ее ускоряет, но сам в ней не расходуется.
Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами.
Реакции, ускоряемые катализаторами, называют каталитическими.
Ускорение реакции катализатором называют катализом.
Таким образом, оксид марганца (IV) в реакции разложения пероксида водорода служит катализатором. В уравнении реакции формула катализатора записывается сверху над знаком равенства. Запишем уравнение проведенной реакции. При разложении пероксида водорода выделяется кислород и образуется вода. Выделение кислорода из раствора показывают стрелкой, направленной вверх:
2. Разложение перманганата калия
В повседневной жизни вы наверняка сталкивались с веществом, которое в быту называется «марганцовкой». Химическое название этого вещества — перманганат калия, его химическая формула KMnO4.
При нагревании перманганат калия разлагается с образованием кислорода.
В пробирку насыпают кристаллический перманганат калия. При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет.
Уравнение проведенной реакции:
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
3. Разложение бертолетовой соли
Для получения кислорода к бертолетовой соли всегда примешивают оксид марганца МпО2 или другое вещество, каталитически ускоряющее процесс разложения. Если нагревать более или менее значительные количества чистой соли, то на поверхности расплава может образоваться корка тугоплавкого хлорида калия, под которой скопляется кислород, в результате чего происходит взрыв. В присутствии оксида марганца MnO2 бертолетова соль начинает разлагаться раньше, чем она расплавится (около 200 ºС).
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Это интересно
Бертолетова соль KClO3 (хлорноватокислый калий, хлорат калия) — одна из самых известных солей. Это сильный окислитель; при подогревании, толчках, растирании бертолетовой соли со многими соединениями происходит воспламенение или взрыв. Именно поэтому бертолетову соль используют при производстве спичек, взрывчатых веществ, в пиротехнике и т. п. Обращаться с этой солью нужно осторожно: она не только взрывоопасна, но и ядовита. Она может связываться с гемоглобином крови и таким образом лишать его способности переносить кислород.
Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
- вытеснением воды:
- вытеснением воздуха (кислород будет собираться на дне сосуда)
ЦОРы
Познавательный фильм: “Кислород”
Видео: “Разложение пероксида водорода”
Видео: “Разложение перманганата калия”
Домашнее задание
- Параграф 22
- Стр. 75 упр. 4-6 (письменно)
