Какие свойства вещества определяются ковалентным видом химической связи

Ковалентная связь — химическая связь, образованная обобществлением пары валентных электронных облаков. Обеспечивающие связь электроны называются общей электронной парой.
Св-ва ковалентной связи: направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Ионная связь.
Ионный тип связи возможен только между атомами, которые резко отличаются по свойствам. Резкое отличие в свойствах элементов приводит к тому, что атом металла полностью теряет свои валентные электроны, а атом неметалла присоединяет их. образовавшиеся положительно и отрицательно заряженный ионы в молекулах и кристаллической решетки силами электростатического притяжения. Такая связь называется ионной.
Пример образование молекулы NaCL в газовой фазе.
Неспецифические виды связи.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов иинтерметаллических соединений.
Механизм металлической связи: Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Другие свойства: Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами.
Дата добавления: 2016-11-12; просмотров: 5539 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Анонимный вопрос · 19 декабря 2017
14,4 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????Ковалетная связь????
❗️это химическая связь между атомами,которая образуется за счёт образования общих электронных пар
❗️ковалентная связь бывает полярной и неполярной
❗️ковалентная полярная связь образуется между атомами с разной электроотрицательностью
Угарный газ С=О
❗️ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью
Кислород О=О,водород Н-Н
Non refert, qui sum…Quod ego facio…I vide de abysso» — «Не важно кто…
Ковалентная связь — это тип химической связи, которая осуществляется при взаимодействии элементов атома с одинаковыми или близкими по значению электроотрицательности.
Как определить валентность по таблице менделеева?
Номер группы, в которой расположен атом в периодической таблице равен его высшей валентности. Низшая валентность определяется разницей между числом восемь и номером группы. Натрий и алюминий имеют только одно значение валентности, равное номеру группы.
Какая связь в молекуле серной кислоты?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????Это структурная формула серной кислоты
????Связи в H2SO4 образуются между неметаллами➡️связи ковалентные
????Атомы в молекуле H2SO4 оочень сильно отличаются друг от друга по электроотрицательности➡️связи полярные
⬇️
????В молекуле серной кислоты связи ковалентные полярные????
Существует ли мгновенная связь между всеми частицами (материи и света) во вселенной? Если да, то возможная совокупность этих связей и есть Бог?
Отвечаю на вопросы о буддийских традициях. Проектирую шрифты.
Смотря что считать связью. Например считать ли связью взаимозависимость запутанных фотонов, теоретически вероятное на противоположных краях вселенной?
Для совокупности связей есть более подходящее чем Бог слово — сингулярность или целостность. Можно представить что наша вселенная — это вязанный свитер. Каждая петелька — это частица. Можно ли связать весь свитер из одной нитки? Да. Можно связать из нескольких ниток разного цвета, но с возможностью взаимодействия между ними. Если мы тянем за одну петлю (фотон), а затягивается другая, значит они находятся на одной нитке, имеют одну природу, одну прошлую причину существования.
Слово Бог чаще всего означает разум в каком-то виде. Разум предполагает какие-то процессы, протекающие внутри него и снаружи. То есть взаимодействие внутренних частей с внешним миром. Если вся вселенная это одно большое сознание, как она может понять, что она — сознание? Представьте мыслящего человека, лишенного органов чувств. Какие процессы могут протекать в таком сознании? Это будут внешне случайные процессы определяемые только внутренними условиями взаимодействия частей, не имеющие никаких целей, кроме реализации возможности движения. Можно ли такой такой цельный, но бесцельный ) процесс назвать сознанием?
Если в итоге вселенная достигнет состояния равноудалённых невзаимодействующих частиц, если свитер распустится в длинную нитку с отдельными узелками, или даже если все петли распустятся и останется только сама нитка — нулевые колебания волн, значит в нашем мире-разуме не осталось больше мыслей? Так что ли? Получается бог не бессмертный?
Прочитать ещё 3 ответа
Что является веществом с ионной связью?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????Что такое ионная связь?????
Это связь,которая образуется между катионами и анионами за счёт их притяжения
????Катион????
Это положительно заряженный ион
Например:K(+),Ca(2+),Li(+),Al(+3) и т.д.
????Анион ????
Это отрицательно заряженный ион
Например:SO ₄(-2),Cl(-),NO ₃(-) и т.д.
????Как же образуется ионная связь ?????
Каждый атом старается завершить свой внешний уровень,чтобы на нем было 8 электронов
Завершить этот уровень атом может только принимая электрон или отдавая
У атома натрия на внешнем уровне 1 электрон,у атома хлора -8
Хлору не хватает всего одно электрона ,чтобы завершить свой уровень????Но атом натрия с удовольствием его отдаст .Так и образуются ионы
Далее разноименно заряженные ионы соединяются ,между ними образуется химическая связь,которую мы называем ионной????
????Вещества с ионной связью????
Металл+НеМеталл
LiCl,KOH,MgO,Ca(NO ₃) ₂ и т.д.
 îñíîâå ìåòîäà âàëåíòíûõ ñâÿçåé ëåæàò ñëåäóþùèå ïîëîæåíèÿ:
1. Êîâàëåíòíàÿ ñâÿçü îáðàçóåòñÿ äâóìÿ ýëåêòðîíàìè ñ ïðîòèâîïîëîæíî íàïðàâëåííûìè ñïèíàìè, ïðè÷åì ýòà ýëåêòðîííàÿ ïàðà ïðèíàäëåæèò äâóì àòîìàì.
2. Êîâàëåíòíàÿ ñâÿçü òåì ïðî÷íåå, ÷åì â áîëüøåé ñòåïåíè ïåðåêðûâàþòñÿ ýëåêòðîííûå îáëàêà.
Êîâàëåíòíàÿ ñâÿçü – âèä õèìè÷åñêîé ñâÿçè, îñóùåñòâëÿåìûé çà ñ÷¸ò îáðàçîâàíèÿ ýëåêòðîííîé ïàðû, êîòîðàÿ ïðèíàäëåæèò îáîèì àòîìàì. Îáîçíà÷àåòñÿ «:» èëè « – ».
Ïî ìåõàíèçìó îáðàçîâàíèÿ êîâàëåíòíàÿ ñâÿçü ðàçäåëÿåòñÿ íà:
- îáìåííóþ êîâàëåíòíóþ ñâÿçü;
- äîíîðíî-àêöåïòîðíóþ êîâàëåíòíóþ ñâÿçü.
Îáìåííàÿ êîâàëåíòíàÿ ñâÿçü âîçíèêàåò ìåæäó àòîìàìè. Ãäå êàæäûé àòîì îòäà¸ò ïî îäíîìó íåñïàðåííîìó ýëåêòðîíó â îáùóþ ýëåêòðîííóþ ïàðó.
Äîíîðíî-àêöåïòîðíàÿ êîâàëåíòíàÿ ñâÿçü çàêëþ÷àåòñÿ â òîì, ÷òî îäèí àòîì (äîíîð) îòäà¸ò ýëåêòðîííóþ ïàðó, à äðóãîé àòîì (àêöåïòîð) ïðåäîñòàâëÿåò äëÿ ýòîé ïàðû ñâîáîäíóþ îðáèòàëü.

Êðîìå îäèíàðíûõ ñâÿçåé, ìîæåò îáðàçîâûâàòüñÿ äâîéíàÿ è òðîéíàÿ êîâàëåíòíàÿ ñâÿçü.

Ñâîéñòâà êîâàëåíòíîé ñâÿçè.
- íàñûùàåìîñòü;
- íàïðàâëåííîñòü;
- ïîëÿðèçóåìîñòü.
Íàñûùàåìîñòü – ñïîñîáíîñòü ê îáðàçîâàíèþ ñòðîãî îïðåäåë¸ííîãî êîëè÷åñòâà êîâàëåíòíûõ ñâÿçåé (îò 1 äî 6), êîòîðàÿ îïðåäåëÿåò ìàêñèìàëüíî âîçìîæíóþ âàëåíòíîñòü ýëåìåíòà.
Íàïðàâëåííîñòü – ñòðåìëåíèå àòîìîâ ê îáðàçîâàíèþ íàèáîëüøåé ýëåêòðîííîé ïëîòíîñòè ìåæäó ÿäðàìè.
Ïîëÿðèçóåìîñòü – ñìåùåíèå ýëåêòðîíîâ ïîä âëèÿíèåì âíåøíåãî ýëåêòðè÷åñêîãî ïîëÿ.
- íåïîëÿðíàÿ êîâàëåíòíàÿ ñâÿçü ò.å. ýëåêòðîííîå îáëàêî, îáðàçîâàííîå îáùåé ïàðîé ýëåêòðîíîâ, ðàñïðåäåëÿåòñÿ â ïðîñòðàíñòâå ñèììåòðè÷íî îòíîñèòåëüíî ÿäåð îáîèõ àòîìîâ (ïðèìåðû: Cl2, N2).
- ïîëÿðíóþ êîâàëåíòíóþ ñâÿçü ò.å. îáùåå ýëåêòðîííîå îáëàêî ñìåøåíî â ñòîðîíó îäíîãî èç àòîìîâ òàê, ÷òî âîçíèêàåò àññèìåòðèÿ â ðàñïðåäåëåíèè çàðÿäà (ïðèìåðû: CO, H2O).

Ýëåêòðîîòðèöàòåëüíîñòü – ýòî ñïîñîáíîñòü àòîìîâ îòòÿãèâàòü ê ñåáå îáùóþ ýëåêòðîííóþ ïàðó.

Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õèìè÷åñêàÿ ñâÿçü. | |
| Õèìè÷åñêàÿ ñâÿçü ýòî âçàèìîäåéñòâèå àòîìîâ â ìîëåêóëå è êðèñòàëëè÷åñêîé ðåø¸òêå â ðåçóëüòàòå äåéñòâèÿ ìåæäó íèìè ýëåêòðè÷åñêèõ ñèë ïðèòÿæåíèÿ. | |
| Õèìè÷åñêàÿ ñâÿçü. | |
Âîäîðîäíàÿ ñâÿçü. | |
| Âîäîðîäíàÿ ñâÿçü ñâÿçü ìåæäó ïîëîæèòåëüíî çàðÿæåííûì àòîìîì âîäîðîäà îäíîé ìîëåêóëû è îòðèöàòåëüíî çàðÿæåííûì àòîìîì äðóãîé ìîëåêóëû. | |
| Âîäîðîäíàÿ ñâÿçü. | |
Ìåòàëëè÷åñêàÿ ñâÿçü. | |
| Ìåòàëëè÷åñêàÿ ñâÿçü âèä õèìè÷åñêîé ñâÿçè ìåæäó ïîëîæèòåëüíî çàðÿæåííûìè èîíàìè (êàòèîíàìè) â êðèñòàëëè÷åñêîé ðåø¸òêå ìåòàëëîâ, îñóùåñòâëÿåìàÿ çà ñ÷¸ò ïðèòÿæåíèÿ ïîäâèæíûõ ýëåêòðîíîâ. | |
| Ìåòàëëè÷åñêàÿ ñâÿçü. | |
Почему атомы могут соединяться друг с другом и образовывать молекулы? Какова причина возможного существования веществ, в состав которых входят атомы совершенно разных химических элементов? Это глобальные вопросы, затрагивающие основополагающие понятия современной физической и химической науки. Ответить на них можно, имея представление об электронном строении атомов и зная характеристики ковалентной связи, являющейся базовой основой для большинства классов соединений. Цель нашей статьи – ознакомиться с механизмами образования различных типов химической связи и особенностями свойств соединений, содержащих их в своих молекулах.
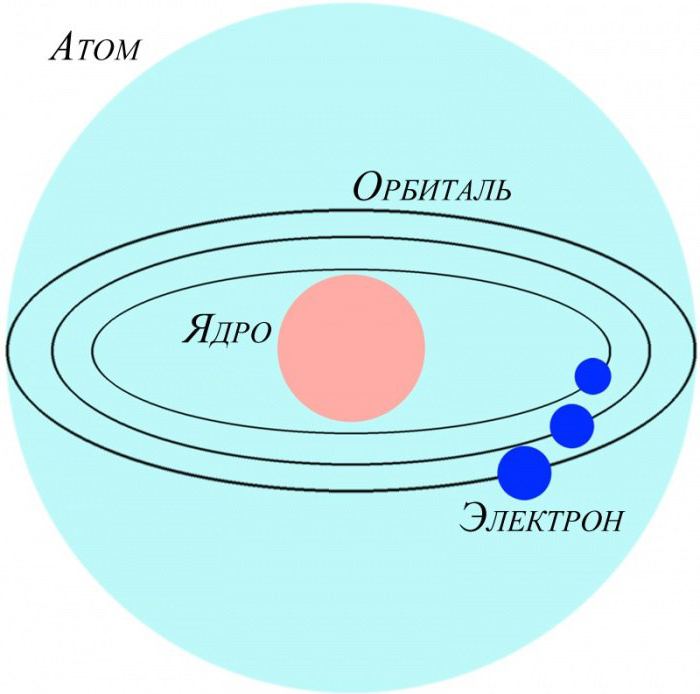
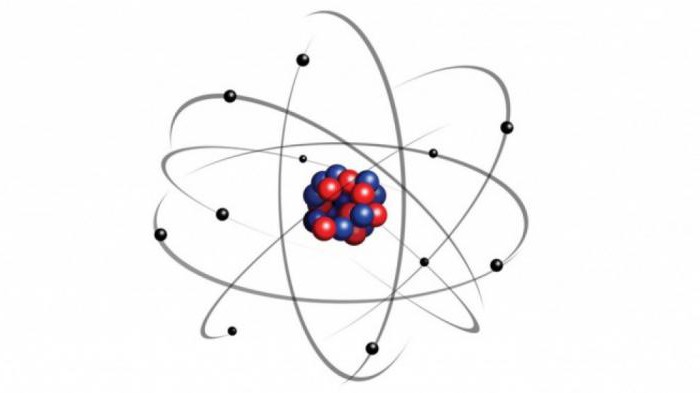
Электронное строение атома
Электронейтральные частицы материи, являющиеся ее структурными элементами, имеют строение, зеркально отражающее устройство Солнечной системы. Как планеты вращаются вокруг центральной звезды – Солнца, так и электроны в атоме движутся вокруг положительно заряженного ядра. Для характеристики ковалентной связи значимыми будут электроны, располагающиеся на последнем энергетическом уровне и наиболее удаленные от ядра. Так как их связь с центром собственного атома минимальна, они способны легко притягиваться ядрами других атомов. Это очень важно для возникновения межатомных взаимодействий, приводящих к образованию молекул. Почему же именно молекулярная форма является основным видом существования материи на нашей планете? Давайте разберемся.
Основное свойство атомов
Способность электронейтральных частиц к взаимодействию, приводящая к выигрышу в энергии, – их важнейшая особенность. Ведь в обычных условиях молекулярное состояние вещества более стойкое, чем атомное. Основные положения современного атомно-молекулярного учения объясняют как принципы образования молекул, так и характеристики ковалентной связи. Напомним, что на внешнем энергетическом уровне атома может находиться от 1 до 8 электронов, в последнем случае слой будет завершенным, а значит, очень устойчивым. Такую структуру внешнего уровня имеют атомы благородных газов: аргона, криптона, ксенона – инертных элементов, завершающих каждый период в системе Д. И. Менделеева. Исключением здесь будет гелий, у которого на последнем уровне находится не 8, а только 2 электрона. Причина проста: в первом периоде — всего два элемента, атомы которых имеют единственный электронный слой. У всех остальных химических элементов на последнем, незавершенном слое располагается от 1 до 7 электронов. В процессе взаимодействия между собой атомы будут стремиться заполниться электронами до октета и восстановить конфигурацию атома инертного элемента. Такое состояние может быть достигнуто двумя путями: потерей собственных или принятием чужих отрицательно заряженных частиц. Эти формы взаимодействия объясняют, как определить, какая связь – ионная или ковалентная — возникнет между вступающими в реакцию атомами.
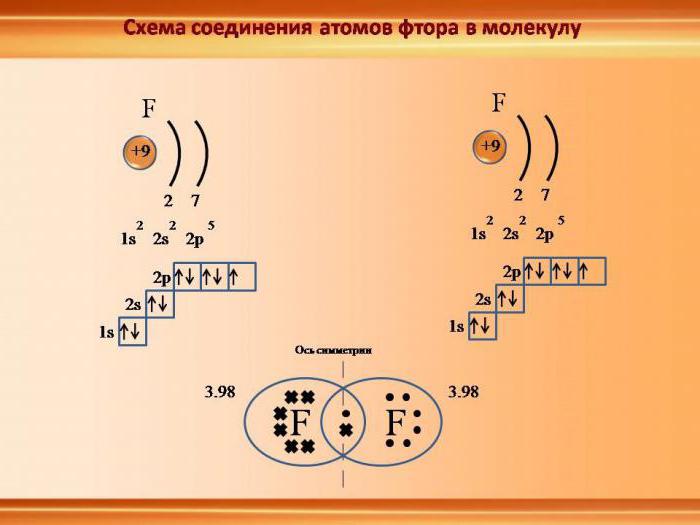
Механизмы образования стойкой электронной конфигурации
Представим, что в реакцию соединения вступают два простых вещества: металлический натрий и газообразный хлор. Образуется вещество класса солей – хлорид натрия. Оно имеет ионный тип химической связи. Почему и как она возникла? Снова обратимся к строению атомов исходных веществ. У натрия на последнем слое находится всего один электрон, слабо связанный с ядром вследствие большого радиуса атома. Энергия ионизации у всех щелочных металлов, к которым относится и натрий, мала. Поэтому электрон внешнего уровня покидает энергетический уровень, притягивается ядром атома хлора и остается в его пространстве. Это создает прецедент перехода атома Cl в форму отрицательно заряженного иона. Теперь мы имеем дело уже не с электронейтральными частицами, а с заряженными катионами натрия и анионами хлора. В соответствии с законами физики между ними возникают силы электростатического притяжения, и соединение образует ионную кристаллическую решетку. Рассмотренный нами механизм формирования ионного типа химической связи поможет более четко выяснить специфику и основные характеристики ковалентной связи.
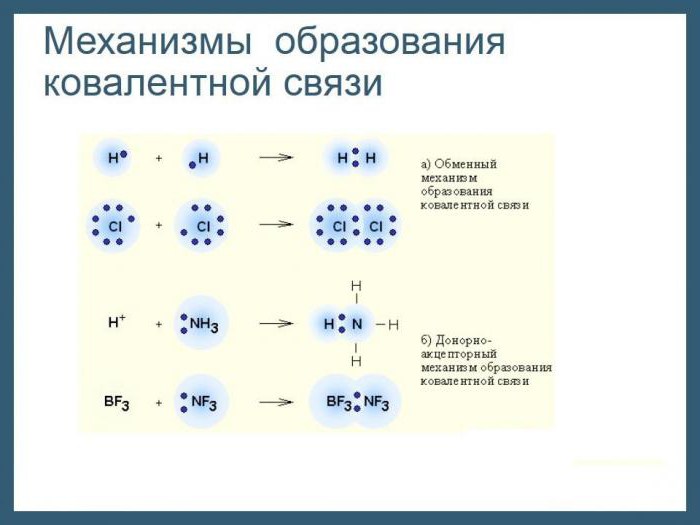
Общие электронные пары
Если ионная связь возникает между атомами элементов, сильно отличающихся электроотрицательностью, т. е. металлами и неметаллами, то ковалентный тип появляется при взаимодействии атомов как одного и того же, так и разных неметаллических элементов. В первом случае принято говорить о неполярном, а в другом – о полярном виде ковалентной связи. Механизм их образования общий: каждый из атомов частично отдает в общее пользование электроны, которые объединяются попарно. А вот пространственное расположение электронных пар относительно ядер атомов будет неодинаковым. По этому признаку и различают типы ковалентной связи – неполярную и полярную. Наиболее часто в химических соединениях, состоящих из атомов неметаллических элементов, встречаются пары, состоящие из электронов с противоположными спинами, т. е. вращающихся вокруг своих ядер в противоположные стороны. Так как движение отрицательно заряженных частиц в пространстве ведет к образованию электронных облаков, что в конечном счете заканчивается взаимным их перекрыванием. Каковы последствия этого процесса для атомов и к чему он приводит?
Физические свойства ковалентной связи
Оказывается, что между центрами двух взаимодействующих атомов возникает двухэлектронное облако, имеющее большую плотность. Усиливаются электростатические силы притяжения между самим отрицательно заряженным облаком и ядрами атомов. Высвобождается порция энергии и уменьшаются расстояния между атомными центрами. Например, в начале образования молекулы H2 расстояние между ядрами водородных атомов составляет 1,06 А, после перекрывания облаков и образования общей электронной пары – 0,74 А. Примеры ковалентной связи, формирующейся по вышеописанному механизму, можно встретить как среди простых, так и среди сложных неорганических веществ. Ее главная отличительная черта – наличие общих электронных пар. В итоге после возникновения ковалентной связи между атомами, например, водорода каждый из них приобретает электронную конфигурацию инертного гелия, и образовавшаяся молекула имеет устойчивую структуру.
Пространственная форма молекулы
Еще одно очень важное физическое свойство ковалентной связи – это направленность. Он нее зависит пространственная конфигурация молекулы вещества. Например, при перекрывании двух электронов со сферической формой облака вид молекулы линейный (хлороводород или бромоводород). Форма молекул воды, у которой гибридизируются s- и p- облака — угловая, а очень прочные частицы газообразного азота имеют вид пирамиды.
Строение простых веществ – неметаллов
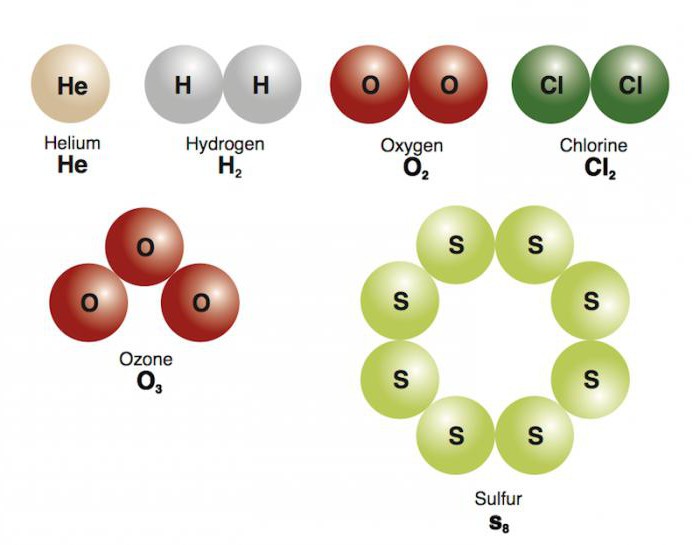
Выяснив, какую связь называют ковалентной, какие признаки она имеет, теперь самое время разобраться с ее разновидностями. Если во взаимодействие между собой вступают атомы одного и того же неметалла – хлора, азота, кислорода, брома и т. д., то формируются соответствующие простые вещества. Их общие электронные пары располагаются на одинаковом расстоянии от центров атомов, не смещаясь. Для соединений с неполярным видом ковалентной связи присущи такие признаки: низкие температуры кипения и плавления, нерастворимость в воде, диэлектрические свойства. Далее мы выясним, для каких веществ характерна ковалентная связь, при которой происходит смещение общих электронных пар.
Электроотрицательность и ее влияние на тип химической связи
Свойство определенного элемента притягивать к себе электроны от атома другого элемента в химии называют электроотрицательностью. Шкалу величин данного параметра, предложенную Л. Полингом, можно встретить во всех учебниках по неорганической и общей химии. Наибольшее его значение – 4,1 эВ — имеет фтор, меньшее – другие активные неметаллы, а наименьший показатель характерен для щелочных металлов. Если между собой реагируют элементы, отличающиеся своей электроотрицательностью, то неизбежно один, более активный, будет притягивать к своему ядру отрицательно заряженные частицы атома более пассивного элемента. Таким образом, физические свойства ковалентной связи напрямую зависят от способности элементов отдавать электроны в общее пользование. Образующиеся при этом общие пары уже не располагаются симметрично относительно ядер, а смещаются в сторону более активного элемента.
Особенности соединений с полярной связью
К веществам, в молекулах которых совместные электронные пары несимметричны относительно ядер атомов, можно отнести галогеноводороды, кислоты, соединения халькогенов с водородом и кислотные оксиды. Это сульфатная и нитратная кислоты, оксиды серы и фосфора, сероводород, и т. д. Например, молекула хлороводорода содержит одну общую электронную пару, образованную неспаренными электронами водорода и хлора. Она смещена ближе к центру атома Cl, являющегося более электроотрицательным элементом. Все вещества с полярной связью в водных растворах диссоциируют на ионы и проводят электрический ток. Соединения, имеющие полярную ковалентную связь, примеры которых мы привели, имеют также более высокие температуры плавления и кипения по сравнению с простыми веществами-неметаллами.
Способы разрыва химических связей
В органической химии реакции замещения предельных углеводородов с галогенами идут по радикальному механизму. Смесь метана и хлора на свету и при обычной температуре реагирует таким образом, что молекулы хлора начинают расщепляться на частицы, несущие неспаренные электроны. Иначе говоря, наблюдается разрушение общей электронной пары и образование очень активных радикалов –Cl. Они способны так воздействовать на молекулы метана, что у тех происходит разрыв ковалентной связи между атомами углерода и водорода. Образуется активная частица –H, а свободная валентность атома углерода принимает радикал хлора, и первым продуктом реакции становится хлорметан. Такой механизм расщепления молекул называется гомолитическим. Если же общая пара электронов полностью переходит во владение к одному из атомов, то говорят о гетеролитическом механизме, характерном для реакций, проходящих в водных растворах. В этом случае полярные молекулы воды будут усиливать скорость разрушения химических связей растворяемого соединения.
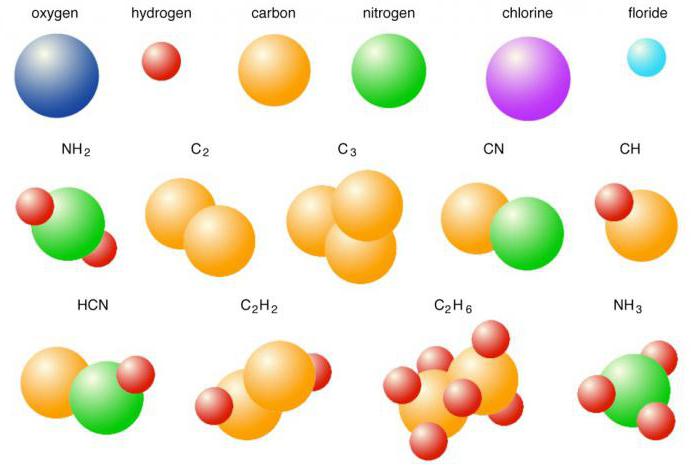
Двойные и тройные связи
Подавляющее большинство органических веществ и некоторые неорганические соединения содержат в своих молекулах не одну, а несколько общих электронных пар. Кратность ковалентной связи уменьшает расстояние между атомами и увеличивает стабильность соединений. О них принято говорить как о химически стойких. Например, в молекуле азота имеется три пары электронов, они обозначаются в структурной формуле тремя черточками и обусловливают ее прочность. Простое вещество азот химически инертен и может реагировать с другими соединениями, например с водородом, кислородом или металлами только при нагревании или повышенном давлении, а также в присутствии катализаторов.
Двойные и тройные связи присущи таким классам органических соединений, как непредельные диеновые углеводороды, а также вещества ряда этилена или ацетилена. Кратные связи обусловливают основные химические свойства: реакции присоединения и полимеризации, идущие в местах их разрыва.
В нашей статье мы дали общую характеристику ковалентной связи и рассмотрели ее основные виды.
