Какие свойства проявляет оксид магния
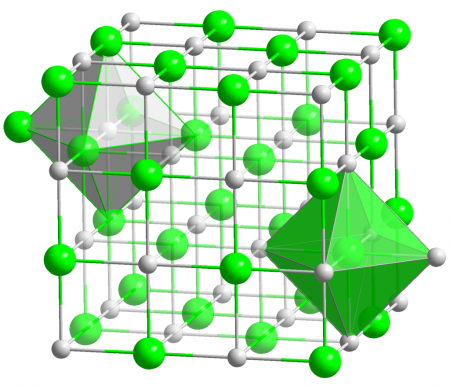
| Оксид магния | |
|---|---|
 | |
| Систематическое наименование | Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз, асбест |
| Хим. формула | MgO |
| Рац. формула | MgO |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Т. плав. | 2825 °C |
| Т. кип. | 3600 °C |
| Энтальпия образования | -601,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 0,86 г/100 мл |
| ГОСТ | ГОСТ 844-79 ГОСТ 4526-75 |
| Рег. номер CAS | 1309-48-4 |
| PubChem | 14792 |
| Рег. номер EINECS | 215-171-9 |
| SMILES | O=[Mg] |
| InChI | 1S/Mg.O CPLXHLVBOLITMK-UHFFFAOYSA-N |
| Кодекс Алиментариус | E530 |
| RTECS | OM3850000 |
| ChEBI | 31794 |
| ChemSpider | 14108 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Оксид магния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
MgO + 2HCl → MgCl2 + H2O MgO + H2O → Mg(OH)2
Получение
Оксид магния получают обжигом минералов магнезита и доломита.
CaCO3 ∗ MgCO3 → MgO + CaO + 2CO2 MgCO3 → MgO + CO2
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
Соединения магния | |
|---|---|
| |
Оксид магния, что это. Магний оксид: свойства, получение, применение
Магний оксид нередко называют еще жженой магнезией или просто окисью магния. Это вещество представляет легкий и мелкий кристаллический белый порошок. В природе магний оксид встречается в виде минерала периклаза. В пищевой промышленности это вещество известно как пищевая добавка под кодом E530.
Свойства оксида магния
Химическая формула данного вещества: MgO. Это соединение практически не имеет запаха, в аммиаке и кислоте растворяется хорошо, в воде его растворимость при 30 °С составляет всего лишь 0,0086 грамм/100 мл, а в спирте оно и вовсе не растворяется. Молярная масса MgO — 40,3044 г/моль. При 20 °C его плотность равна 3,58 г/см³, температура кипения — 3600 °C, плавления — 2852 °C. Мелкокристаллический магний оксид химически довольно активен. Он способен поглощать углекислый газ с образованием соответствующего карбоната:
- MgO + CO2= MgCO3;
хоть и медленно, но все же реагирует с водой, образуя при этом нерастворимое слабое основание :
- H2O + MgO = Mg(OH)2;
вступает в реакцию с кислотами:
- 2HCl + MgO = MgCl2+ H2O
Прокаленный магний оксид свою химическую активность теряет. Также следует добавить, что этот порошок гигроскопечен.
Получение оксида магния
В промышленности данное соединение в основном получают посредством обжига. В качестве сырья используют такие минералы как доломит (MgCO3.CaCO3) или магнезит (MgCO3). Кроме того, жженую магнезию производят при помощи прокаливания бишофита (MgCl2х 6H2O) в водяном паре, прокаливания Mg(OH)2 и прочих неустойчивых к температуре соединений Mg. В лабораторных условиях MgO можно получить при взаимодействии ее составных компонентов:
- 2Mg + O2= 2MgO;
либо посредством термического разложения некоторых солей или гидроксида:
- MgCO3= MgO + CO2.
В зависимости от способа получения окиси магния принято выделять два основных вида этого соединения: легкая и тяжелая магнезия. Первый представляет собой бесцветный порошок, который достаточно легко вступает в различные реакции с разбавленными кислотами, в результате чего образуются соли Mg. Второй состоит из больших кристаллов природного или искусственного периклаза и отличается водостойкостью и более инертен.
Применение оксида магния
В промышленности это соединение используют для изготовления цементов, огнеупоров, в качестве наполнителя при производстве резины и для очистки нефтепродуктов. Сверхлегкий магний оксид применяют в качестве очень мелкого абразива, которым очищают поверхность. В частности, это используется в электронной промышленности. Кроме того, жженая магнезия широко применяется в медицине. Здесь MgO используют при нарушении уровня кислотности желудочного сока, возникающего из-за избытка соляной кислоты. Окись магния также принимают для нейтрализации активных веществ, случайно попавших в желудок. В пищевой промышленности MgO применяется в качестве пищевой добавки (код E530), которая препятствует комкованию и слеживанию. Жженая магнезия используется также и в спортивной гимнастике. Здесь этот порошок спортсмены наносят на руки для того чтобы контакт с гимнастическим снарядом был более надежным. Добавим еще, что оксид магния является абсолютным отражателем. Коэффициент отражения данного вещества в расширенной спектральной полосе равен единице и поэтому его вполне можно использовать в качестве эталона белого цвета.
Оксид магния, какой оксид. Ниша использует
MgO , является одним из компонентов в портландцементе в.
Оксид магния широко используется в почве и подземных реабилитации, очистки сточных вод, очистки питьевой воды, очистки выбросов в атмосферу, а также для очистки сточных промышленности для его буферной емкости кислоты и связанной с эффективностью в стабилизации растворенных видов тяжелых металлов.
Многие виды тяжелые металлы, такие как свинец и кадмий наиболее растворим в воде при кислом рН (ниже 6), а также высокий уровень рН (выше 11). Растворимость металлов влияет на биодоступность видов и подвижности почвы и подземных систем. Большинство видов металлов являются токсичными для человека при определенных концентрациях, поэтому крайне важно, чтобы свести к минимуму металла биологической доступности и мобильности.
Гранулированный MgO, часто смешивают в металлы-загрязненные почвы или отходов материала, который также обычно низкого (кислый) рН, для того, чтобы управлять рН в диапазоне 8-10, где большинство металлов находятся на самом низком растворимостью. Металл-гидроксидные комплексы имеют тенденцию к осаждению из водного раствора в диапазоне рН 8-10. MgO, широко рассматривается в качестве наиболее эффективной стабилизации металлов соединения по сравнению с портландцементом, известь, печи пыли продуктов, продуктов производства электроэнергии отходов, а также различных патентованных продуктов из-за превосходной буферной емкости MgO в, эффективности затрат, и легкость / безопасность в обращении.
Большинство, если не все продукты, которые продаются как стабилизационных металлы технологии создают очень высокие условия рН в водоносных слоях, тогда как MgO создает идеальные условия водоносного с рН 8-10. Кроме того, магний, существенный элемент для большинства биологических систем, предоставляется популяция микроорганизмов почвы и подземных вод в процессе MgO, при содействии металлов реабилитации в качестве дополнительного преимущества.
Гидроксид магния. Фармакологические свойства
Гидроксид магния нейтрализует в желудочном соке свободную соляную кислоту с образованием хлорида магния. Далее хлорид магния переходит в кишечник, где, действуя как солевое слабительное, оказывает послабляющий эффект (плохо всасывается, повышает в просвете кишечника осмотическое давление, способствует переходу жидкости по градиенту концентрации, увеличивает объемы кишечного содержимого, которое растягивает стенки кишечника и стимулирует его перистальтику). Выводятся ионы магния в виде водорастворимых солей (бикарбоната и хлорида) и малорастворимой гидроокиси с содержимым кишечника. Гидроксид магния связывает желчные кислоты и инактивирует пепсин, которые попадают в результате рефлюкса из двенадцатиперстной кишки в желудок, тем самым оказывает защитное воздействие на слизистую оболочку двенадцатиперстной кишки и желудка, в том числе и при язвенной болезни. В желудке гидроксид магния не сразу расходуется и может нейтрализовать соляную кислоту, которая выделяется через некоторое время после употребления препарата. Таким образом, гидроксид магния характеризуется быстрым и продолжительным антацидным эффектом, не сопровождающимся изменениями кислотно-щелочного состояния и вторичной гиперсекрецией соляной кислоты. Гидроксид магния повышает перистальтику во всех отделах кишечника. Слабительное действие гидроксида магния наступает через 0,5–6 часов. При применении гидроксида магния у больных с нарушениями работы почек возможно поступления небольшого количества магния в кровь и развитие токсических реакций, которые проявляются угнетением центральной нервной системы.
Оксид магния усвояемость. Лучший препарат магния. Состав препаратов
Определимся с целью. Мы замахнулись на выбор именно лучшего препарата магния. Ничего нового мы не будем изобретать. Мы воспользуемся логикой, которая участвует при выборе любой техники.
Что для нас зачастую подпадает под категорию «лучший»? Чаще всего это соотношение цены-качества. Мы не любим переплачивать за имя или этикетку, но и не любим выбрасывать деньги на ветер, покупая сомнительный продукт по низкой цене. Скупой платит дважды (а в случае со здоровьем может и не расплатиться).
Итак, мы хотим порадовать свой организм магнием.
Органические соли хороши за счет лучшей биодоступности и дополнительных эффектов на организм.
Сначала представим наиболее распространенные формы, где магний прячется в органических соединениях (органические формы жизни со мной согласятся), а затем неорганические источники (силикатные формы жизни обвинят в расизме).
Выбирая лучший препарат магния, мы учитываем свойства солей:
- Цитрат магния. Соль лимонной кислоты.
- Малат магния. Соль яблочной кислоты.
- Аспарагинат или аспартат магния. Соль аспарагиновой (аминоянтарной) кислоты.
- Оротат магния. Соль оротовой кислоты.
- Лактат магния. Соль молочной кислоты.
| Название вещества | Ценность и роль для организма |
|---|---|
| Цитрат магния | Лимонная кислота является главным промежуточным продуктом метаболического цикла трикарбоновых кислот. Играет важную роль в системе биохимических реакций клеточного дыхания. В водном растворе образует хелатные комплексы с ионами кальция, магния, меди, железа и др. При приеме внутрь в небольших дозах активирует цикл Кребса, что способствует ускорению метаболизма. Биодоступность цитратов высокая. |
| Малат магния | Яблочная кислота является промежуточным продуктом цикла трикарбоновых кислот и глиоксилатного цикла. То есть является незаменимым веществом для клеточного дыхания и метаболизма. Яблочная кислота содержится в незрелых яблоках, винограде, рябине, барбарисе, малине и др. Биодоступность малатов высокая. |
| Аспарагинат (аспартат магния) | Аминоянтарная кислота — одна из 20 протеиногенных аминокислот организма. Играет важную роль в обмене азотистых веществ, участвует в образовании пиримидиновых оснований и мочевины. Аспарагиновая кислота и аспарагин являются критически важными для роста и размножения лейкозных клеток при некоторых видах лимфолейкоза. Хорошая биодоступность. |
| Оротат магния | Оротовая кислота — витаминоподобное вещество, влияющее на обмен веществ и стимулирующее рост живых организмов, но не обладающее всеми свойствами, характерными для витаминов. Синтезируется в достаточном количестве (случаев гиповитаминоза в литературе до сих пор описано не было). Биодоступность хорошая. |
| Лактат магния | Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром», глюкоза является главным источником углеводов в нашем организме. В пищевой промышленности используется как консервант, пищевая добавка E270. Поликонденсацией молочной кислоты получают пластик PLA. Биодоступность хорошая. |
| Сульфат магния | Неорганическое вещество. Применяется как солевое слабительное при приеме внутрь. В условиях стационара — внутривенное введение. Не подходит для восполнения дефицита магния. |
| Оксид магния | Неорганическое вещество. В нейтральной среде практически не растворяется. По биодоступности в десятки раз уступает органическим аналогам. Неплохо справляется с задачей борьбы с запором. |
Оксид магния + вода. Получение
Гидроксид магния получают в результате следующих химических реакций:
- 1. в результате взаимодействия металлического магния с парами воды :
Mg 2H2O → Mg(OH)2 H2.
- 2. в результате взаимодействия оксида магния и воды :
MgO H2O → Mg(OH)2 (t = 100-125 °C).
- 3. в результате взаимодействия растворимых солей магния с щелочью :
MgCl2 2NaOH → Mg(OH)2 2NaCl,
Mg(NO3)2 2KOH → Mg(OH)2 2KNO3.
При этом гидроксид магния выпадает в виде осадка.
- 4. в результате взаимодействия хлорида магния с обожженным доломитом :
MgCl2 CaO·MgO 2H2O → 2Mg(OH)2 CaCl2.
Оксид магния получают обжигом минераловмагнезита и доломита.
CaCO3∗MgCO3→MgO CaO 2CO2{displaystyle {mathsf {CaCO_{3}*MgCO_{3}rightarrow MgO CaO 2CO_{2}}}}MgCO3→MgO CO2{displaystyle {mathsf {MgCO_{3}rightarrow MgO CO_{2}}}}
Как же был открыт магний?
В 1695 г. английский врач Крю проводил анализы минеральной воды из источника поблизости города Эпсом. При упаривании этой воды на стенках сосуда образовалась белая соль c горьким вкусом. Эта соль обладала лечебными свойствами. Аптекари называли эту соль английской или эпсонской. Позже соль получила название белой магнезии из-за своего сходства с белым порошком, который получали, прокаливая минерал, обнаруженный вблизи греческого города Магнезии.
Металл магний впервые удалось получить в 1808 г. британскому химику Хемфри Дэви. Дэви подвергал электролизу смесь белой магнезии и окиси ртути. В результате он получил сплав ртути и неизвестного металла. Выделив металл, Дэви предложил назвать его магнием. Но магний, полученный Дэви, содержал примеси. Чистый, без примесей, магний удалось получить только в 1829 г. французскому химику Антуану Бюсси.
Металлический магний получают электротермическим или электролитическим способом.
В первом случае магнезит или доломит, находящиеся в реакционном аппарате, прокаливают. В результате получают окись магния MgO. Затем окись магния восстанавливается алюминием, кремнием или углем. Так получают чистый магний.
Но основным промышленным способом получения магния является электролитический. В специальных ваннах-электролизёрах находится расплав хлорида магния MgCl2. В результате электролиза на железном катоде выделяется магний, а на графитовом аноде собираются ионы хлора. Расплавленный магний собирают и разливают по формам. Затем магний проходит очистку от примесей.
Оксид магния получают обжигом минераловмагнезита и доломита.
Оксид магния (MgO) – белые гигроскопичные твердые минералы, которые встречаются в природе в виде периклаза и являются источником магния.
 Получение оксида магния возможно при обжиге минералов магнезита и доломита.
Получение оксида магния возможно при обжиге минералов магнезита и доломита.
В лабораторных условиях получение оксида магния происходит путем обработки карбоната магния хлоридом магния с известью и последующей тепловой обработкой.
Свойства оксида магния
Оксид магния – белый порошок без запаха растворимый в кислоте и аммиаке и нерастворимый в спирте.
Молекулярная формула оксида магния – MgO, молярная масса – 40,3044 г/моль, плотность – 3,58 г/см³, температура плавления – 2852 °C, 3125 K, 5166 °F, температура кипения – 3600 °C, 3873 K, 6512 °F, растворимость в воде – 0,0086 г/100 мл (30°С).
Применение оксида магния
В традиционной медицине оксид магния используется как минеральная добавка для профилактики и лечения дефицита магния в крови. Магний является очень важным компонентом для нормального функционирования клеток, нерв, мышц, костей и сердца.
Как правило, хорошо сбалансированная диета обеспечивает нормальное содержание магния в крови. Однако прием таких лекарственных средств как фуросемид и гидрохлоротиазид, желудочно-кишечные заболевания, плохое питание, алкоголизм и сахарный диабет приводят к развитию дефицита магния в организме.
Антацидные свойства оксида магния помогают при расстройстве желудка, повышенной кислотности желудка и изжоге, нейтрализуя кислотность желудка. Также оксид магния применяется в качестве слабительного при лечении язвы желудка, двенадцатиперстной кишки и камней оксалата кальция в почках.
Оксид магния входит в состав медикаментов и пищевых добавок, действие которых направлено на восполнение дефицита магния в организме. Лекарства на основе оксида магния принимают внутрь, желательно во время еды, чтобы исключить расстройство желудка и диарею. Принимать препараты необходимо регулярно в одно и то же время, для получения максимальной пользы. Дозировка зависит от состояния здоровья и реакции на лечение.
Переизбыток оксида магния в крови может привести к серьезным побочным эффектам. Прежде чем принимать добавки, в состав которых входит оксид магния, необходима врачебная консультация, так как в них могут содержаться неактивные компоненты, которые вызывающие аллергические реакции.
В качестве промышленного компонента оксид магния используется в производстве бумаги, магниевых солей (английская соль), ацетатов, хлоридов и в качестве компонента в некоторых видах цемента.
В стекловолоконной промышленности оксид магния используется в обработке стали и никеля.
Оксид магния входит в состав изоляторов промышленных кабелей, как основной огнеупорный материал для тиглей и в качестве основного компонента в производстве огнеупорных строительных материалов. Он широко используется в отопительных системах в качестве компонента нагревательных элементов трубчатых конструкций.
Прессованные кристаллы оксида магния используются в производстве оптического материала. Они прозрачные от 0,3 до 7 мкм и обладают хорошим показателем преломлении 1,72 при 1 мкм, а также обладают низкой стоимостью.
Оксид магния используется на заводах по утилизации отходов, как вещество способное контролировать растворимость радионуклидов.
Также оксида магнии используется в качестве защитного покрытия для плазменных дисплеев, а спортсмены используют порошок оксида магния в качестве белой посыпки для рук, благодаря которой они не скользят по спортивным снарядам.
В промышленности оксид магния применяется для производства резины, синтетических каучуков и очистки нефтепродуктов, а в электронной промышленности он используется как абразив для очистки поверхностей.
В пищевой промышленности оксид магния известен как пищевая добавка E530 – эмульгатор, не растворяемый в воде, который используется в производстве:
- Сухого молока;
- Сухих сливок;
- Шоколада;
- Какао;
- Пищевых масел.
Противопоказания и вред оксида магния
Прием медикаментов на основе оксида магния может привести к расстройствам желудка и поносу, серьезным аллергическим реакциям (сыпь, зуд и отеки в особенности в области лица, языка и горла), крапивнице, сильным головокружениям, судорогам, перепадам настроения, слабости, тошноте, рвоте, усталости и проблемам с дыханием.
Лекарства на основе оксида магния с осторожностью назначаются при болезни почек, во время беременности и в период лактации.
 Медикаменты в виде жидкостей и порошков, в состав которых входит оксид магния, также могут содержать сахар и подсластитель аспартам. В жидкостях также может содержаться спирт. Их с осторожностью следует принимать при таких болезнях, как диабет, алкогольная зависимость, заболевания печени, фенилкетонурия и при любых других заболеваниях, лечение которых требует ограничения этих веществ в повседневном рационе.
Медикаменты в виде жидкостей и порошков, в состав которых входит оксид магния, также могут содержать сахар и подсластитель аспартам. В жидкостях также может содержаться спирт. Их с осторожностью следует принимать при таких болезнях, как диабет, алкогольная зависимость, заболевания печени, фенилкетонурия и при любых других заболеваниях, лечение которых требует ограничения этих веществ в повседневном рационе.
Прием оксида магния противопоказан при употреблении целлюлозы натрия фосфата, дигоксина и полистиролсульфаната натрия.
Оксид магния может полностью нейтрализовать действие таких медикаментов, как:
- Тетрациклины (демеклоциклин, доксициклин, миноциклин и тетрациклин);
- Бисфосфонаты (алендронат);
- Лекарства для щитовидной железы (левотироксин);
- Антибиотики (ципрофлоксацин, левофлоксацин).
Использования оксида магния может вызывать легкие раздражения кожи и глаз. Вдыхание порошка оксида магния может вызвать раздражение носа и горла, а вдыхание паров оксида магния может вызвать состояние литейной лихорадки, сопровождаемой такими симптомами, как металлический привкус во рту, раздражение горла, сухой кашель, увеличение лейкоцитов в крови, озноб и слабость мышц.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
