Какие свойства химических элементов закономерно изменяются в периоде
26-Авг-2012 | комментарий 21 | Лолита Окольнова
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Не надо учить наизусть химические свойства каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по химии находится в Периодической системе элементов.

Как изменяются электронные конфигурации s-, p-элементов (по группам и периодам) и d-элементов, тоже можно почитать отдельно.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и в периодах.
1. Изменения свойств химических элементов и их соединений в группах:

В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
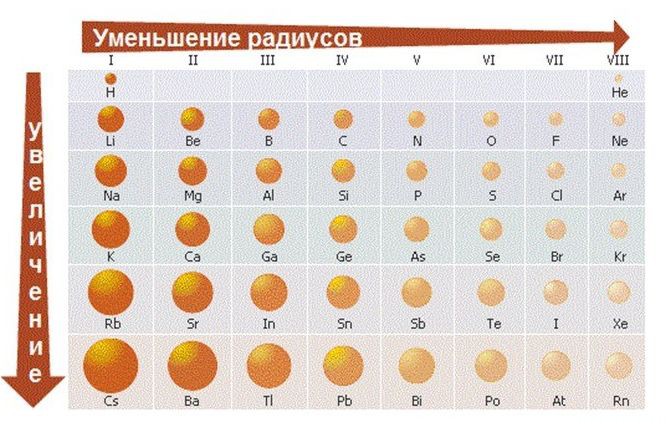
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
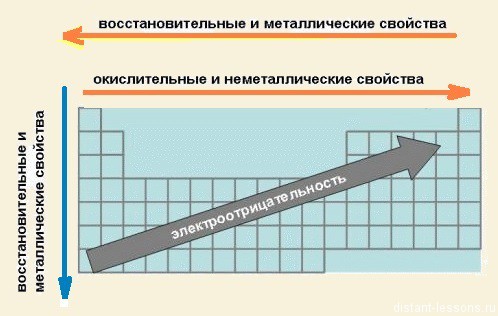
- В группах сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:

В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений

Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.
К ним относятся:
- Zn
- Cr
- Al
- Sn
- Pb
- Mn
- Fe
- Be
- вопросы заданий ЕГЭ по этой теме — А2
- А2 ГИА (ОГЭ)
Тест
1. В ряду Li → Ве → В → С
усиливаются восстановительные свойства простых веществ
усиливается основность соединений
усиливаются кислотные свойства соединений
кислотные свойства элементов ослабевают
2. Усиление металлических свойств элементов представлено в ряду:
N → Р → As
S → Р → Si
Sb → As → P
Al → C → N
3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0)имеет ион
Ca(0)
Al(3+)
Cs(+)
K(+)
4. В каком ряду кислотность соединений возрастает
Cr(0), Cr(3+), Cr(+6)
Mn(+6), Mn(+4), Mn(+2)
Cl(+7), Cl(+3), Cl(+1)
S(+6), S(+4), S(0)
5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO — Cr2O3 — CrO3
основной — кислотный — амфотерный
основной — амфотерный — кислотный
все основные
все несолеобразующие
6. Даны элементы: F, O, N, Cl. Какие утверждения верны?
в заданном ряду элементов электроотрицательность уменьшается
основные свойства оксидов этих элементов ослабевают, а кислотные усиливаются
неметаллические свойства простых веществ усиливаются
степень окисления атомов в высших оксидах одинакова
7. Наиболее выражены металлические свойства у:
фософра
азота
рубидия
водорода
8. Только амфотерные оксиды указаны в ряду:
Na2O, ZnO, CuO
ZnO, Al2O3, Cr2O3
Al2O3, FeO, SO3
CO2, CO, N2O5
9. Выберите правильное утверждение: А 9.в ряду элементов: Na – Si – Cl неметалличность простых веществ, образуемых этими элементами, усиливается B. в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
утвеждение А верно
веное утверждение — B
оба утверждения верны
оба неверны
10. Соединения элемента с порядковым номером 20
простое вещество проявляет металлические свойства
оксид элемента — кислотный
при взаимодействии с водой оксид элемента образует кислоту
в соединениях проявляет отрицательную степень окисления
Категории:
|
Обсуждение: «Закономерности изменения химических свойств элементов и их соединений»
(Правила комментирования)
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
252,2 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху вниз): увеличивается… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Как построена периодическая система химических элементов?
Интересы часто менялись, поэтому во многих областях знаний что-то знаю:)
В периодической системе отражаются сходства свойств различных элементов.
Выделяют:
- группы (столбцы таблицы), в рамках которых элементы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках.
- периоды (строки таблицы), в рамках которых элементы демонстрируют определённые закономерности в атомном радиусе, энергии ионизации и электроотрицательности, а также в энергии сродства к электрону.
- блоки, элементы в которых объединены тем, на какой оболочке находится последний электрон. Блоковая структура выглядит так:
Подробнее почитать обо всех закономерностях периодической системы можно здесь
Почему высшая валентность изменяется периодически?
TutorOnline — одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель… · tutoronline.ru
С увеличением порядкового номера элемента в периоде увеличивается количество электронов на внешнем энергетическом поле, которые могут создавать химические связи. Больше электронов — выше валентность! В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома. Легче всего отрываются электроны от атомов щелочного металла франция. В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень. Наиболее активно принимают электроны атомы галогена фтора.
Если есть, то какая вероятность того, что во вселенной есть еще не открытые химические элементы?
Есть, стопроцентная.
Менделеев, когда открыл периодическую таблицу химических элементов, расположил в ней все известные на тот момент элементы. Гениальность его открытия в том и состояла, что с помощью этой таблицы можно было предсказать свойства еще неоткрытых химических элементов.
И эта блестящая теория на сто процентов оправдала себя. С момента составления таблицы было открыто множество химических элементов и все они укладывадись в прогнозы.
На данный момент остались неоткрытыми 8 элементов:
- Унбибий
- Унбигексий
- Унбиквадий
- Унбинилий
- Унбипентий
- Унбитрий
- Унбиуний
- Унуненний
Сложность в том, что их место и предполагаемые свойства известны, а вот условия, в которых они появляются — нет. Но они явно далеки от земных и моделирование таких условий в научных лабораториях — дело не столь отдаленного будущего
Периодический закон изменения свойств химических элементов был открыт в 1869 году великим русским ученым Д.И. Менделеевым и в первоначальной формулировке звучал следующим образом:
«… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Атомным весом в те времена называли атомную массу химического элемента. Следует отметить, что в то время не было ничего известно о реальном строении атома и господствовала идея о его неделимости, в связи с чем Д.И. Менделеев сформулировал свой закон периодичного изменения свойств химических элементов и образованных ими соединений исходя из массы атомов. Позже после установления строения атома закон был сформулирован в следующей формулировке актуальной и в настоящий момент.
Свойства атомов химических элементов и образованных ими простых веществ находятся в периодической зависимости от зарядов ядер их атомов.
Графическим изображением периодического закона Д.И. Менделеева можно считать периодическую таблицу химических элементов, впервые построенную самим великим химиком, но несколько усовершенствованную и доработанную последующими исследователями. Фактически используемый в настоящее время вариант таблицы Д.И. Менделеева отражает современные представления и конкретные знания о строении атомов разных химических элементов.
Рассмотрим более детально современный вариант периодической системы химических элементов:
В таблице Д.И. Менделеева можно видеть строки, называемые периодами; всего их насчитывается семь. Фактически номер периода отражает число энергетических уровней, на которых расположены электроны в атоме химического элемента. Например, такие элементы, как фосфор, сера и хлор, обозначаемые символами P, S, и Cl, находятся в третьем периоде. Это говорит о том, что электроны в этих атомах расположены на трех энергетических уровнях или, если говорить более упрощенно, образуют трехслойную электронную оболочку вокруг ядер.
Каждый период таблицы, кроме первого, начинается щелочным металлом и заканчивается благородным (инертным) газом.
Все щелочные металлы имеют электронную конфигурацию внешнего электронного слоя ns1, а благородные газы — ns2np6, где n – номер периода, в котором находится конкретный элемент. Исключением из благородных газов является гелий (He) с электронной конфигурацией 1s2 .
Также можно заметить, что помимо периодов таблица делится на вертикальные столбцы — группы, которых насчитывается восемь. Большинство химических элементов имеет равное номеру группы количество валентных электронов. Напомним, что валентными электронами в атоме называются те электроны, которые принимают участие в образовании химических связей.
В свою очередь, каждая группа в таблице делится на две подгруппы – главную и побочную.
Для элементов главных групп количество валентных электронов всегда равно номеру группы. Например, у атома хлора, расположенного в третьем периоде в главной подгруппе VII группы, количество валентных электронов равно семи:
Элементы побочных групп имеют в качестве валентных электроны внешнего уровня или нередко электроны d-подуровня предыдущего уровня. Так, например, хром, находящийся в побочной подгруппе VI группы, имеет шесть валентных электронов – 1 электрон на 4s-подуровне и 5 электронов на 3d-подуровне:
Общее количество электронов в атоме химического элемента равно его порядковому номеру. Другими словами, общее количество электронов в атоме с номером элемента возрастает. Тем не менее, количество валентных электронов в атоме изменяется не монотонно, а периодически – от 1-го у атомов щелочных металлов до 8-ми для благородных газов.
Иными словами, причина периодического изменения каких-либо свойств химических элементов связана с периодическими изменениями в строении электронных оболочек.
При движении вниз по подгруппе атомные радиусы химических элементов возрастают ввиду увеличения количества электронных слоев. Тем не менее, при движении по одному ряду слева направо, то есть с ростом количества электронов для элементов, расположенных в одном ряду, происходит уменьшение радиуса атома. Данный эффект объясняется тем, что при последовательном заполнении одной электронной оболочки атома ее заряд, как и заряд ядра, увеличивается, что приводит к усилению взаимного притяжения электронов, в результате чего электронная оболочка «поджимается» к ядру:
Вместе с тем, внутри одного периода с ростом количества электронов происходит уменьшение радиуса атома, а также возрастает энергия связи каждого электрона внешнего уровня с ядром. Это означает, что, например, ядро атома хлора будет удерживать электроны своего внешнего уровня намного сильнее, чем ядро атома натрия единственный электрон внешнего электронного уровня. Более того, при столкновении атома натрия и хлора хлор «отберет» единственный электрон у атома натрия, то есть электронная оболочка хлора станет такой же, как у благородного газа аргона, а у натрия — такой же, как у благородного газа неона. Способность атома какого-либо химического элемента оттягивать на себя «чужие» электроны при столкновении с атомами другого химического элемента называется электроотрицательностью. Более подробно про электроотрицательность будет рассказано в главе, посвященной химическим связям, но нужно отметить, что, электроотрицательность, как и многие другие параметры химических элементов, также подчиняется периодическому закону Д.И. Менделеева. Внутри одной подгруппы химических элементов электроотрицательность убывает, а при движении по ряду одного периода вправо электроотрицательность возрастает.
Следует усвоить один полезный мнемонический прием, позволяющий восстановить в памяти то, как меняются те или иные свойства химического элемента. Заключается он в следующем. Представим себе циферблат обычных круглых часов. Если его центр поместить в правый нижний угол таблицы Д.И. Менделеева, то свойства химических элементов будут однообразно изменяться при движении по ней вверх и вправо (по часовой стрелке) и противоположно вниз и влево (против часовой стрелки):
Попробуем применить данный прием к размеру атома. Допустим, что вы точно помните, что при движении вниз по подгруппе в таблице Д.И. Менделеева радиус атома увеличивается, поскольку растет число электронных оболочек, но напрочь забыли, как изменяется радиус при движении влево и вправо.
Тогда нужно действовать следующим образом. Поставьте большой палец правой руки в правый нижний угол таблицы. Движение вниз по подгруппе будет совпадать с движением указательного пальца против часовой стрелки, как и движение влево по периоду, то есть радиус атома при движении влево по периоду, как и при движении вниз по подгруппе, увеличивается.
Аналогично и для других свойств химических элементов. Точно зная, как изменяется то или иное свойство элемента при движении вверх-вниз, благодаря данному методу вы сможете восстановить в памяти то, как меняется это же свойство при движении влево или вправо по таблице.

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
