Какие основные свойства ядер
Основными характеристиками атомных ядер являются электрический заряд, масса, спин, энергия связи и так далее.
Заряд ядра
Ядро каждого из атомов обладает положительным зарядом. В качестве носителя положительного заряда выступает протон. По той причине, что заряд протона численно эквивалентен заряду электрона e, можно записать, что заряд ядра элемента равен +Ze (Z выражает собой целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Значение Z также характеризует число протонов, входящих в состав ядра и количество электронов в атоме. Именно из-за этого его определяют как атомный номер ядра. Электрический заряд представляет собой одну из основных характеристик атомного ядра, от которой зависят оптические, химические и иные свойства атомов.
Масса ядра
Существует также другая значимая характеристика ядра, а именно масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.), в качестве атомной единицы массы выступает 112 массы нуклида углерода C612:
где NA=6,022·1023 моль-1 обозначает число Авогадро.
Кроме того, есть другой способ выражения атомной массы: исходя из соотношения Эйнштейна E=mc2, ее выражают в единицах энергии. По той причине, что масса протона mp=1.00728 а.е.м.=938,28 МэВ, масса нейтрона mn=1.00866а.е.м.=939,57МэВ, а масса электрона me=5,49⋅10-4 а.е.м.=0,511МэВ,
Из приведенных выше значений видно, что масса электрона несущественно мала, если сравнивать ее с массой ядра, поэтому масса ядра практически эквивалентна массе всего атома и отлична от целых чисел.
Определение 1
Масса ядра, которая выражается в а.е.м. и округляется до целого числа носит название массового числа и обозначается с помощью буквы A. Она характеризует количество нуклонов, находящихся в составе ядра.
Количество нейтронов в ядре эквивалентно N=A−Z. В качестве обозначения ядер используют символ XZA, в котором X определяется как химический символ этого элемента.
Определение 2
Атомные ядра, обладающие одинаковым числом протонов, однако при этом отличающимися друг от друга массовыми числами, носят название изотопов.
В некоторых элементах количество стабильных и нестабильных изотопов достигает десятков, в качестве примера, уран обладает 14 изотопами: от U92227 до U92240. Большая часть химических элементов, которые существуют в природе, являются смесью нескольких изотопов. Как раз наличие изотопов объясняет следующее явление: некоторые природные элементы обладают массой, которая является отличной от целых чисел. В качестве примера рассмотрим природный хлор, который состоит из 75%C1735l и 24%C1737l, а его атомная масса эквивалентна 35,5 а.е.м. В большей части атомов, исключая водород, изотопы обладают практически равными физическими и химическими свойствами. Однако, за своими, исключительно ядерными свойствами, изотопы значительно отличаются друг от друга. Какие-то из них могут представлять собой стабильные изотопы, а другие – радиоактивные.
Определение 3
Ядра с эквивалентными массовыми числами, но отличающимися значениями Z носят название изобар, в качестве примера, A1840r, C2040a.
Определение 4
Ядра с одинаковым числом нейтронов определяют как изотоны.
Определение 5
Среди легких ядер встречаются и так называемые «зеркальные» пары ядер. Это такие пары ядер, в которых числа Z и A−Z меняются местами. В качестве примера подобных ядер можно привести C613 и N713 или H13 и H23e.
Размер атомного ядра
Принимая форму атомного ядра приблизительно сферической, мы имеем возможность ввести понятие его радиуса R. Обратим внимание на то, что в некоторых ядрах есть небольшое отклонение от симметрии в распределении электрического заряда. Более того, атомные ядра представляют собой не статические, а динамические системы, и понятие радиуса ядра нельзя представлять как радиус шара. Именно из-за этого факта, в качестве размеров атомного ядра нужно принимать ту область, в которой проявляются ядерные силы. В процессе создания количественной теории рассеивания α-частиц Э. Резерфорд исходил из тех предположений, что атомное ядро и α — частица взаимодействуют по закону Кулона, Другими словами из того, что электрическое поле вокруг ядра обладает сферической симметрией.
Это работает в отношении α — частиц, обладающих достаточно малым значением энергии E. При этом частица не имеет возможности преодолеть кулоновский потенциальный барьер и в последствии не достигает области, в которой наблюдается действие ядерных сил. Одновременно с повышением энергии частицы до некоторого граничного значения Eгр, α-частица достигает данной границы. В таком случае в рассеянии α-частиц возникает некоторое отклонение от формулы Резерфорда.
Опытным путем было определено, что радиус R ядра является зависимым от числа нуклонов, которые входят в состав ядра.
Размеры ядер определяют экспериментальным путем по рассеянию протонов, быстрых нейтронов или же электронов высоких энергий. Существует также целый список иных косвенных способов получения значений размеров ядер. Они основываются:
- на связи времени жизни α — радиоактивных ядер с энергией выпущенных ими α — частиц;
- на оптических свойствах, носящих название мезоатомов, в которых один из электронов временно захвачен мюоном;
- на сравнении энергий связи парных зеркальных атомов.
Данные способы подтверждают эмпирическую зависимость R=R0A1/3, а также благодаря таким измерениям определено значение постоянной R0=1,2-1,5·10-15 м. Обратим свое внимание также на тот факт, что за единицу расстояний в атомной физике и физике элементарных частиц принимают единицу измерения «ферми», которая равняется 10-15 м 1 ф=10-15 м. Радиусы атомных ядер определяются их массовым числом и находятся в промежутке от 2·10-15 до 10-14 м. Если из формулы R=R0A1/3 выразить R0 и записать его в следующем виде 4πR33A=const, то можно заметить, что на каждый нуклон приходится примерно одинаковый объем. Из данного факта можно сделать вывод о том, что плотность ядерного вещества для всех ядер так же приблизительно одинакова. Как можно заметить, плотность ядерного вещества довольно велика. Этот факт основывается на действие ядерных сил.
Энергия связи. Дефект масс ядер
Определение 6
Величину ∆m, что определяет разницу масс между массой нуклонов, которые формируют ядро, и массой ядра, называют дефектом массы ядра.
Важные сведения о свойствах ядра могут быть получены даже при отсутствии знаний о подробностях взаимодействия между нуклонами ядра, на основании закона сохранения энергии и закона пропорциональности массы и энергии. Поскольку в результате каждого изменения массы ∆m происходит соответствующее изменение энергии ∆E(∆E=∆mc2), то при образовании ядра выделяется некоторое количество энергии. Исходя из закона сохранения энергии можно сделать вывод о том, что ровно такое же количество энергии необходимо для того, чтобы разделить ядро на составляющие его элементы, другими словами отдалить нуклоны друг от друга на такие расстояния, при которых взаимодействия между ними не происходит. Данную энергию определяют как энергию связи ядра.
Замечание 1
Заметим, что данная формула довольно неудобная в применении, так как в таблицах приводиться не массы ядер, а массы, которые относятся к массам нейтральных атомов. По этой причине ради удобства вычислений формулу преобразуют таким образом, чтобы в нее входили не массы атомов, а массы ядер. Для достижения этой цели в правой части формулы добавим и отнимем массу Z электронов (me). В таком случае Eсв=Zmp+me+A-Zmn-mя+Zmec2=ZmH11+A-Zmn-mac2 — масса атома водорода, ma — масса атома.
В ядерной физике энергию зачастую выражают в мегаэлектрон-вольтах (МэВ). Если речь идет о практическом применении ядерной энергии, то ее измеряют в джоулях. В случае сравнения энергии двух ядер используют массовую единицу энергии — соотношение между массой и энергией (E=mc2). Массовая единица энергии (le) равняется энергии, что соответствует массе в одну а.е.м. Она равняется 931,502 МэВ.
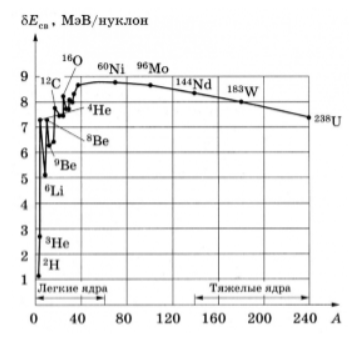
Рисунок 1
Определение 7
Кроме энергии, важное значение имеет удельная энергия связи ядра — энергия связи, которая припадает на один нуклон: ω=Ecв/A. Эта величина меняется сравнительно медленно по сравнению со сменой массового числа A, имея почти постоянную величину 8.6 МэВ в средней части периодической системы и уменьшается до ее краев.
Дефект массы
Энергия связи в МэВ: Eсв=∆m·931,502=0,030359·931,502=28,3 МэВ;
Удельная энергия связи: ω=EсвA=28,3 МэВ4≈7.1 МэВ.
Глава 4. АТОМНЫЕ ЯДРА И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
§ 19. ОСНОВНЫЕ СВОЙСТВА АТОМНЫХ ЯДЕР
СОСТАВ И СТРУКТУРА ЯДЕР
Свойства атомных ядер определяются их составом и структурой
1) числами протонов и нейтронов в ядре;
2) свойствами этих частиц; характером взаимодействия между ними;
3) относительным расположением и движением протонов и нейтронов внутри ядра.
Протоны и нейтроны как составные части ядер объединены общим названием — нуклоны; есть число нуклонов в ядре.
Ядра принято обозначать химическим символом элемента, снабженным числами, указывающими содержание ядра, по схеме
Например, ядро натрия, содержащее 11 протонов и 12 нейтронов, записывается так:
Известно и изучено около 1300 ядер, из которых 267 являются стабильными. Большинство стабильных ядер имеют четные значения Из них 159 являются четно-четными, т. е. имеют одновременно четные и и ядра являются четно -нечетными нечетно-четными и лишь 5 стабильных ядер являются нечетно-нечетными:
(впрочем, ванадий имеет очень большой период полураспада — около лет). Эти сведения показывают, что при комплектовании внутренней структуры стабильных ядер четность чисел протонов и нейтронов имеет важное значение. Ядра, имеющие:
1) одинаковые но разные называются изотопами;
2) одинаковые но разные называются изотопами;
3) разные но одинаковые называются изобарами. Кроме того, могут существовать ядра, имеющие одинаковый состав и но отличающиеся некоторыми свойствами, в частности периодами полураспада. Такие ядра называются изомерами.
Рис. IV.100
В исследовательской аппаратуре ядра, особенно тяжелые, изучаются вместе с окружающей их электронной оболочкой. Ввиду этого введен новый термин нуклид — ядро вместе с электронной оболочкой, нейтрализующей его заряд. Атом же есть химическое понятие; в большинстве случаев химический элемент представляет собой смесь изотопов (следовательно, нейтральные атомы — смесь нуклидов с одинаковыми числами протонов).
Число показывает избыток нейтронов в ядре. Имеется только одно ядро с отрицательным значением (гелий-3 имеет остальных ядер избыток нейтронов является положительным числом и возрастает с увеличением атомного номера. На рис. IV. 100 показано распределение стабильных четно-четных ядер по значениям Квадратиками обозначены радиоактивные ядра, имеющие очень большие периоды полураспада (104 лет и более). Ядра, имеющие одинаковое число нейтронов (изотопы), лежат на прямых, проведенных под углом 45° к осям координат. На рисунке проведено только несколько таких линий, соответствующих N = 20, 28, 50 и 82. Ядра, расположенные на прямых, перпендикулярных линиям имеют одинаковое значение величины (С — число нейтронов, которое
необходимо прибавить к ядру, чтобы число нейтронов в нем сделалось вдвое больше числа протонов). Рис. IV. 100 показывает, что семейства ядер с более многочисленны, чем семейства и
Два ядра, у которых число протонов одного равно числу нейтронов другого
называются зеркальными. К ним относятся, например,
Имеется 19 пар зеркальных ядер; характерно, что в 16 из этих пар одно ядро является стабильным, второе — радиоактивным (в остальных трех парах оба ядра являются радиоактивными).
Ядра, у которых числа протонов или нейтронов равны 2, 8, 20, 28, 50, 82 (а для нейтронов еще и 126), отличаются большой распространенностью и резко выделяются по основным свойствам среди соседних ядер. Эти ядра получили название магических. Ядра, у которых магическими являются оба числа называются дважды магическими; к ним относятся, например,
Для иллюстрации приведем относительное содержание изотопов в естественном элементе — хроме при различных значениях
Магическое значение резко выделяется среди остальных. У трех соседних элементов — кадмия олова и теллура имеющих одинаковое значение наибольшее содержание имеет изотоп олова с магическим значением Для
Приведем распространенность в Земной коре ряда соседних элементов (по А. Е. Ферсману, 1959 г.; распространенность водорода принята за единицу):
Элементы с магическими значениями чисел протонов имеют большую распространенность.
Кроме того, по сравнению с соседними ядрами:
1) магические ядра очень слабо поглощают нейтроны;
2) у радиоактивных магических ядер энергия выбрасываемых альфа-частиц очень мала;
3) для перевода магического ядра из основного состояния в ближайшее возбужденное состояние требуется значительно большая энергия, чем у соседних ядер.
Макеты страниц
Важнейшими характеристиками атомных ядер являются:
1) заряд
2) масса
3) дефект массы иди энергия связи
4) механический момент (спин
5) магнитный момент
6) электрический квадрупольный момент
7) спектр возбужденных состояний (т. е. значения энергии связи для всех состояний, в которых может находиться ядро данного состава).
Масса ядра меньше суммарной массы протонов и нейтронов измеренных в свободном состоянии, вне ядра. Разность
называется дефектом массы ядра. Более удобно определение по массе нуклида Мнук.
где Мн — масса атома водорода. Существование дефекта масс ядер является иллюстрацией общего положения, согласно которому масса физической системы всегда k меньше суммарной массы ее составных частей (измеренных вне системы). Ввиду этого масса нуклида также несколько меньше суммы масс ядра и электронов. Дефект массы данной системы умноженный на квадрат скорости света равен той энергии, которая выделилась при образовании этой системы или необходима для ее разрушения на составные элементы:
У атомных ядер эта «энергия связи», как правило, увеличивается с ростом числа нуклонов, но есть и отступление от этого правила, например: изотоп титана имеет а изотоп марганца имеет несколько меньшую энергию связи
Прочность ядра принято характеризовать удельной (средней) энергией связи, приходящейся на один нуклон:
есть среднее уменьшение массы одного нуклона при формировании данного ядра из свободных протонов и нейтронов. При увеличении числа нуклонов в ядре изменяется, но не монотонно. Рассмотрим таблицу стабильных изотопов кальция и ряд ядер, имеющих одинаковое число нейтронов В этой таблице указаны:
1) содержание данного изотопа в естественном элементе с (в процентах),
2) полная энергия связи ядра
3) удельная энергия связи
4) изменение энергии связи при добавлении к предыдущему ядру одного нейтрона или одного протона.
Эти таблицы показывают, что при присоединении нуклонов к четно-четным ядрам изменение энергии связи заметно меньше по сравнению с другими ядрами. Заметим также, что в семействе ядер с основной изотоп кальция с обладает меньшей удельной энергией связи чем другие, менее распространенные изотопы; более того, у этого стабильного ядра удельная энергия связи меньше, чем у радиоактивных изотопов с В семействе ядер с изотопы кальция и калия выделяющиеся своей распространенностью, также имеют меньшую удельную энергию связи по сравнению с менее распространенными ядрами серы и аргона То же самое можно отметить и для других значений Поэтому удельная энергия связи, по-видимому, не определяет ни устойчивости ядра, ни содержания данного изотопа в естественном элементе.
На рис. IV. 101 показаны значения энергии связи одного нуклона для ядер с различным числом нуклонов.
Из таблицы для изотопов кальция видно, что присоединение первого нейтрона к изотопу с дает увеличение энергии связи на а присоединение второго нейтрона вызывает несколько большее изменение энергии: Разность этих значений
можно рассматривать как энергию, которая дополнительно выделяется при соединении обоих нейтронов внутри ядра в особую систему — «пару нейтронов». Предполагается, что такие «пары» в структуре ядра представляют собой отдельную составную часть. Энергия образования «пары нейтронов» внутри данного ядра рассматривается как новая энергетическая характеристика этого ядра.
Рис. IV.101
Предполагается, что протоны внутри ядра также соединяются в «пары». Энергию, выделяющуюся при образовании внутри ядра «пары протонов», можно вычислить из энергии связи соседних ядер Например, для и 20 можно получить энергию образования «пары протонов» Однако величины и рассчитанные, например, для четно-четных ядер, не обнаруживают определенной зависимости от или А и, по-видимому, представляют собой такие же усредненные характеристики ядра, какими являются удельная энергия и энергия присоединения нуклона
1. Ядром называется центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд. Все атомные ядра состоят из элементарных частиц: протонов и нейтронов, которые считаются двумя зарядовыми состояниями одной частицы — нуклона. Протон имеет положительный электрический заряд, равный по абсолютной величине заряду электрона. Нейтрон не имеет электрического заряда.
2. Зарядом ядра называется величина Ze, где е — величина заряда протона, Z — порядковый номер химического элемента в периодической системе Менделеева, равный числу протонов в ядре. В настоящее время известны ядра с Z от Z=1 до Z=107. Для всех ядер, кроме и некоторых других нейтронодефицитных ядер N>Z, где N — число нейтронов в ядре. Для легких ядер N/Z»1; для ядер химических элементов, расположенных в конце периодической системы, N/Z»1,6.
3. Число нуклонов в ядре A=N+Z называется массовым числом. Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение А.
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Ядро химического элемента X обозначается , где Х — символ химического элемента.
Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
4. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра. Эмпирическая формула для радиуса ядра м, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем.
Плотность ядерного вещества составляет по порядку величины 1017 кг/м3 и постоянна для всех ядер. Она значительно превосходит плотности самых плотных обычных веществ.
5. Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра Рmяд в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон mяд
6. Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически симметричного является квадрупольный электрический момент ядра Q. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра.
Другие записи
10.06.2016.
Открытие атомного ядра
Уподобление атома планетной системе делалось еще в начале XX века. Но эту модель было трудно совместить с моделями электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 году…
10.06.2016.
Протонно-нейтронная модель ядра
В 1932 году Д.Д. Иваненко опубликовал заметку, в которой высказал предположение, что нейтрон является наряду с протоном структурным элементом ядра. Однако протонно-нейтронная модель ядра была встречена…
10.06.2016.
Радиоактивность, гамма-излучение, a и бета-распад
1. Радиоактивностью называется превращение неустойчивых изотопов одного химического элемента в изотопы другого элемента, сопровождающееся испусканием некоторых частиц.
Естественной радиоактивностью называется…
10.06.2016.
Расщепление ядра
В 1919 году Резерфордом было сделано новое сенсационное открытие — расщепление ядра. Резерфорд изучал столкновение a-частиц с легкими атомами. Столкновения a-частицы с ядрами таких атомов должны их ускорять.…
10.06.2016.
Энергия связи ядер. Дефект массы
1. Нуклоны в ядрах находятся в состояниях, существенно отличающихся от их свободных состояний. За исключением ядра обычного водорода во всех ядрах имеется не менее двух нуклонов, между которыми существует…
