Какие хим свойства характерны для метана
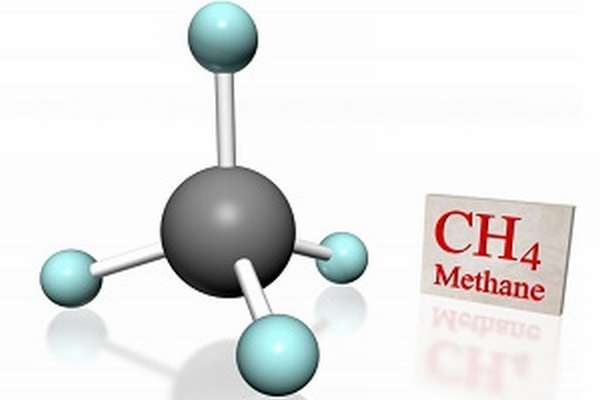

Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| СH4 | Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.

В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
- спирты: 2СН4 + O2 → 2СO3OН
- альдегиды: СН4 + O2 → НСОН + Н2O
- карбоновые кислоты: 2СН4 + 3O2 → 2НСОOН + 2Н2O
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.

Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
СH4 | Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
- спирты: 2СН4 + O2 → 2СO3OН
- альдегиды: СН4 + O2 → НСОН + Н2O
- карбоновые кислоты: 2СН4 + 3O2 → 2НСОOН + 2Н2O
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Предельные, углеводороды ряда метана (алканы)
Алканы, или парафины — алифатические
предельные углеводороды, в молекулах которых атомы углерода связаны между собой
простой s-связью.
Оставшиеся валентности углеродного атома, не затраченные на связь с другими
атомами углерода, полностью насыщены водородом. Поэтому предельные углеводороды
содержат в молекуле максимальное число водородных атомов.
Углеводороды ряда алканов имеют общую
формулу CnH2n+2. В таблице представлены некоторые
представители ряда алканов и их некоторые физические свойства.
Формула | Название | Название | Т | Т |
CH4 | метан | метил | -184 | -162 |
C2H6 | этан | этил | -172 | -88 |
C3H8 | пропан | пропил | -190 | -42 |
C4H10 | бутан | бутил | -135 | -0,5 |
C4H10 | изобутан | изобутил | -140 | -10 |
C5H12 | пентан | пентил | -132 | 36 |
C5H12 | изопентан | изопентил | -161 | 28 |
C5H12 | неопентан | неопентил | -20 | 10 |
C6H14 | гексан | гексил | -94 | 69 |
C7H16 | гептан | гептил | -90 | 98 |
C10H22 | декан | децил | -30 | 174 |
C15H32 | пентадекан | 10 | 271 | |
C20H42 | эйкозан | 37 | 348 |
Из таблицы видно, что эти углеводороды
отличаются друг от друга количеством групп — СН2-.Такой ряд сходных
по строению, обладающих близкими химическими свойствами и отличающихся друг от
друга числом данных групп называется гомологическим рядом. А вещества,
составляющие его, называются гомологами.
Тренажёр
№1 — Гомологи и изомеры
Тренажёр
№2. — Гомологический ряд предельных углеводородов
Физические
свойства
Первые четыре
члена гомологического ряда метана — газообразные вещества, начиная с пентана —
жидкости, а углеводороды с числом углеродных атомов 16 и выше — твердые
вещества (при обычной температуре). Алканы — неполярные соединения и трудно
поляризуемые. Они легче воды и в ней практически не растворяются. Не
растворяются также в других растворителях с высокой полярностью. Жидкие алканы
— хорошие растворители для многих органических веществ. Метан и этан, а также
высшие алканы не имеют запаха. Алканы — горючие вещества. Метан горит
бесцветным пламенем.
Получение
алканов
Для получения
алканов используют в основном природные источники.
Газообразные
алканы получают из природного и попутных нефтяных газов, а твердые алканы — из
нефти. Природной смесью твердых высокомолекулярных алканов является горный
воск —природный битум.
1. Из
простых веществ:
nC + 2nН2500 °С, кат → СnН2n+ 2
2. Действие
металлического натрия на галогенопроизводные алканов— реакция А.Вюрца:
2CH3-Cl + 2Na → CH3-CH3
+ 2NaCl
Химические свойства алканов
1. Реакции замещения — Галогенирование (стадийно)
CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl (1 стадия)
;
метан
CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl (2 стадия);
СH2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl (3 стадия);
CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl (4 стадия).
2. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2t→ nCO2 +
(n+1)H2O
Горение метана
Горение пропан-бутановой смеси
3. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-)
связи:
C10H22 → C5H12
+ C5H10
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С (сажа) и Н2:
СH4 1000°С→
C + 2H2
Применение
·
Предельные
углеводороды находят широкое применение в самых разнообразных сферах жизни и
деятельности человека.
·
Использование
в качестве топлива – в котельных установках, бензин, дизельное топливо,
авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
·
Вазелин
используется в медицине, парфюмерии, косметике, высшие алканы входят в состав
смазочных масел, соединения алканов применяются в качестве хладагентов в
домашних холодильниках
·
Смесь
изомерных пентанов и гексанов называется петролейным эфиром и применяется в
качестве растворителя. Циклогексан также широко применяется в качестве
растворителя и для синтеза полимеров.
·
Метан
используется для производства шин и краски
·
Значение
алканов в современном мире огромно. В нефтехимической промышленности предельные
улеводороды являются базой для получения разнообразных органических соединений,
важным сырьем в процессах получения полупродуктов для производства пластмасс,
каучуков, синтетических волокон, моющих средств и многих других веществ. Велико
значение в медицине, парфюмерии и косметике.
Задания для закрепления
№1.
Составьте уравнения реакций горения этана и бутана.
№2.
Составьте
уравнения реакций получения бутана из следующих галогеналканов:
CH3 — Cl (хлорметан) и C2H5 — I (йодэтан).
№3. Осуществите
превращения по схеме, назовите продукты:
C→ CH4 → CH3Cl → C2H6
→ CO2
№4. Реши кроссворд
По горизонтали:
1.
Алкан, имеющий молекулярную формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3. Французский химик, имя которого носит реакция получения углеводородов с
более длинной углеродной цепью взаимодействием галогенопроизводных предельных
углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы
метана.
5. Трихлорметан.
6. Название радикала С2Н5–.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных
условиях.
Если
вы правильно ответили на вопросы, то в выделенном столбце по вертикали получите
одно из названий предельных углеводородов. Назовите это слово?
Метан – первый представитель ряда алканов с формулой СН4. Это бесцветный природный газ без запаха. Благодаря физическим и химическим свойствам метан используется в качестве топлива.

Строение
Молекула метана представляет собой тетраэдр, в середине которого находится углерод, соединённый простыми (одинарными) σ-связями с атомами водорода. Строение и свойства молекулы метана важны для понимания всей органической химии, так как большинство органических соединений содержит метильные группы -СН2.

Рис. 1. Строение молекулы метана.
Метан образует гомологический ряд алканов. Каждый последующий гомолог отличается от предыдущего на одну группу -СН2.
Из-за тетраэдрической конфигурации длинные молекулы алканов имеют вид изогнутых цепочек.
Получение
Метан – распространённый газ во Вселенной. Он находится в природном и попутном газе, образуется на дне морей, выделяется как конечный продукт жизнедеятельности кишечных бактерий. Метан входит в состав атмосферы планет-гигантов. На поверхности Титана – спутника Сатурна – находятся этан-метановые озёра и реки.

Рис. 2. Спутник Титан.
В промышленности метан выделяют из природного газа и получают при коксовании (прокаливании) каменного угля.
В лаборатории метан образуется при нагревании сухого гидроксида натрия с уксусной кислотой, а также при плавлении ацетата с гидроксидом натрия:
- 2NaOH + CH3COOH → Na2CO3 + H2O + CH4;
- CH3COONa + NaOH → CH4 + Na2CO3.
Впервые метан обнаружил на болотах физик Алессандро Вольта в 1776 году. Два года спустя он выделил из болотного газа чистый метан.
Свойства
Основные физические свойства:
- легче воздуха;
- без запаха и вкуса;
- плохо растворяется в воде;
- молекулярная масса – 16;
- температура плавления – -182,49°С;
- температура кипения – -161,56°С;
- температура вспышки – 87,8°С;
- температура самовоспламенения – 537,8°С.
Метан определяет физико-химические свойства гомологического ряда алканов. При обычных условиях метан и его гомологи малоактивны и вступают в реакции под действием высокой температуры и катализатора. Дополнительные условия необходимы для расщепления связи С-Н.
Основные реакции метана:
- нитрование:
CH4 + HONO2 → CH3-NO2 + H2O;
- галогенирование:
CH4 + Cl2 → CH3Cl + HCl;
- сульфохлорирование:
CH4 + SO2 + Cl2 → CH3-SO2Cl + HCl↑;
- каталитическое окисление под действием солей меди и марганца:
2CH4 + O2 → 2CH3OH;
- полное окисление (горение):
CH4 + 2O2→ CO2 + 2H2O + Q;
- окисление водяным паром:
CH4 + H2O → CO + 3H2;
- крекинг (метод переработки нефти):
2CH4 → HC≡CH + 3H2.

Рис. 3. Горение метана.
Концентрация метана в воздухе более 4 % взрывоопасна. Поэтому метану специально придают запах, смешивая газ с тиолами, содержащими серу. Это помогает контролировать утечку бытового газа.
Что мы узнали?
Метан – простейший представитель класса алканов, образующий гомологический ряд. Это бесцветный горючий газ, выделяемый из природного газа и получаемый при коксовании угля. Метан используется в качестве топлива. При высокой температуре самовоспламеняется. Газ подвержен нитрованию, галогенированию, сульфохлорированию, окислению под действием катализатора, водяного пара, горения, а также крекингу, используемого в переработке нефти.
Тест по теме
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 133.
