Какие гидроксиды проявляют амфотерные свойства
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Анонимный вопрос · 5 марта 2019
5,1 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
Амфотерные гидроксиды — это гидроксиды, которые повторяют свойства кислот и оснований ⚗️
????К амфотерным относятся следующие гидроксиды:
????большинство гидроксидов d-элементов (хрома(III), железа, цинка, и др.);
????ряд гидроксидов p-элементов (алюминия, галлия, олова, свинца и др.);
????из гидроксидов s-элементов амфотерным является гидроксид бериллия;
????ХИМИЧЕСКИЕ СВОЙСТВА, СОВПАДАЮЩИЕ С ОСНОВАНИЯМИ
????Реагируют с кислотами
▫️Al(OH)3 + 3HCl = AlCl3 + 3H2O
????Реагируют с кислотными оксидами
▫️2Al(OH)3 + 3SiO2 = Al2(SiO3)3 + 3H2O
????ХИМИЧЕСКИЕ СВОЙСТВА, СОВПАДАЮЩИЕ С КИСЛОТАМИ
????Реагируют со щелочами
1) В растворе:
▫️Al(OH)3 + NaOH = Na[Al(OH)4]
2) При сплавлении:
▫️Al(OH)3 + NaOH = NaAlO2 + 2H2O
????Реагируют с основными оксидами
▫️2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
????Реагируют с солями
▫️2Al(OH)3 + Na2CO3 = 2NaAlO2 + CO2 + 3H2O
????Одно из общих свойств — разложение при нагревании:
▫️2Fe(OH)3 = Fe2O3 + 3H2O
Как найти высшей оксид и гидроксид Астата(At)?
Ну, если есть таблица Менделеева, то просто нужно посмотреть в самый низ группы Астата. Там будет формула высшего оксида
Высший гидроксид можно найти, исходя из высшей степени окисления вещества (как, собственно, и оксид). У Астата — 7 (номер группы). Итак, получается, что высший гидроксид — HAtO4
Какие соли называются кислыми?
Кислые соли — это соли, содержащие два вида катионов: катион металла (или аммония) и катион водорода, и многозарядный анион кислотного остатка. Катион водорода даёт к названию соли приставку «гидро», например, гидрокарбонат натрия.
Кислые соли сильных кислот (гидросульфаты, дигидрофосфаты) при гидролизе дают кислую реакцию среды (с чем и связано их название). В то же время растворы кислых солей слабых кислот (гидрокарбонаты, тартраты) могут обладать нейтральной или щелочной реакцией среды.
Кислые соли диссоциируют на ионы металла и кислотный остаток, включающий частицу водорода
Кислые соли образуются при воздействии избытка кислоты на щелочь. В зависимости от количества молей кислоты (в данном случае — ортофосфорной) могут образовываться дигидроортофосфаты (1) и гидроортофосфаты (2):
- Ba(OH)2 + 2H3PO4 → Ba(H2PO4)2 + 2H2O
- Ba(OH)2 + H3PO4 → BaHPO4 + 2H2O
NaHSO4 + NaOH = Na2SO4 + H2O
Кислые соли переходят в средние под действием соответствующей щелочи.
Прочитать ещё 1 ответ
Какая структурная формула оловянистой кислоты (H2SnO2)?
ALBA synchrotron, postdoc
Sn(OH)2 в свободном виде не существует. Бывает либо гель гидрата неопределённого состава, либо оксогидроксид Sn6O4(OH)4. Он состоит из кластеров состава Sn6O8, соединенных между собой водородными связями (на картинке не показаны).
Какие вещества называют оксидами?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Оксиды это соединения различных химических элементов с кислородом. При этом кислород находистя в опредленной степени окисления. В реакцию с кислородом могут вступать и металлы, и неметаллы. Чаще всего в результате реакций с неметаллами образуются кислотные оксиды, а с металлами — основания.
Как понять химию?
ALBA synchrotron, postdoc
Как-то раз одному моему знакомому физику захотелось разобраться в книжке, которая хотя и была про физический метод, но была написана химиком для химиков. После того, как я ему объяснил то, что автор книги использовал как общеизвестные знания, он мне сказал «Вы, химики, — секта. У вас всё просто, но в школах-университетах вы преподаёте так, чтобы казалось аццки сложно.»
Я, собственно, к чему. Чтобы понять химию, надо найти того, кто её расскажет нормально, а не так, как в школе.
Основания, их классификация, свойства, получение
Основания — это сложные вещества, при диссоциации которых образуются ионы металла или аммония и гидроксид-ионы ОН-. NaOH <=> Na+ + ОН- | Основания — это вещества, принимающие протоны. NH3 + H+ = NH4+ |
1. Какие из перечисленных веществ относятся к основаниям: LiOH, CH3COOH, Fe(OH)2, CH3NH2, H2SO3, Mg(OH)2?
Классификация оснований
Признаки классификации | Группы оснований | Примеры |
1. Природа веществ | Неорганические | NaOH гидроксид натрия |
Органические | CH3NH2 метиламин | |
2. Состав веществ (наличие кислорода) | Бескислородные | NH3 -аммиак |
Кислородсодержащие | Cu(OH)2 -гидроксид меди (II) | |
3. Кислотность оснований (по числу гидроксильных групп) | Однокислотные | KOH — гидроксид калия |
Двухкислотные | Ca(OH)2 — гидроксид кальция | |
4. Степень электролитической диссоциации | Слабые | Fe(OH)2 — гидроксид железа (II) |
Сильные (щелочи) | NaOH гидроксид натрия | |
5. Растворимость в воде | Растворимые (щелочи) | NaOH гидроксид натрия |
Нерастворимые | Cu(OH)2 -гидроксид меди (II) | |
6. Летучесть | Летучие | NH3 -аммиак |
Нелетучие | Cu(OH)2 -гидроксид меди (II) | |
7. Устойчивость к нагреванию | Устойчивые | KOH — гидроксид калия |
Неустойчивые | Cu(OH)2 -гидроксид меди (II) |
2. Охарактеризуйте гидроксид кальция Сa(OH)2 по всем признакам классификации.
ПОЛУЧЕНИЕ
Получение растворимых оснований (щелочей) | Получение нерастворимых оснований |
1. Реакцией обмена (если один из продуктов выпадает в осадок): Na2SO4 + Вa(OH)2 = ВaSO4↓ + 2NaOH | Нерастворимые основания получают реакцией обмена между раствором соли и раствором щелочи: CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaCl |
2. Растворимые основания (щелочи) можно получить взаимодействием щелочного и щелочно-земельного металла или их оксидов с водой: CaO + H2O = Ca(OH)2 | |
3. Электролизом водного раствора соли хлоридов щелочных металлов (в качестве побочного продукта образуется хлор): 2NaCl + 2H2O = 2NaOH + H2 + Cl2 (действием электрического тока) |
3. Даны вещества: Fe(OH)2, Ca(OH)2, LiOH, Al(OH)3. Какие вещества образуются при взаимодействии металлов с водой, а какие — действием щелочи на раствор соли?
Химические свойства оснований
1. Диссоциация оснований с образованием гидроксид-ионов ОН-:
NaOH <=> Na+ + OH-
LiOH <=> Li+ + OH-
Наличие гидроксид-ионов в растворе щелочи можно определить при помощи кислотно-основных индикаторов.
2. Взаимодействие с кислотами с образованием соли (реакция нейтрализации):
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
3. Взаимодействие щелочей с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 = Na2SiO3 + H2O (при нагревании)
Ca(OH)2 + CO2 = CaCO3↓ + H2O
4. Взаимодействие раствора щелочи с растворами различных солей с образованием нерастворимого основания:
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
Cu2+ + 2OH- = Cu(OH)2 ↓
5. Разложение нерастворимых оснований при нагревании с образованием оксида металла и воды:
Cu(OH)2 = CuO + H2O (при нагревании)
6. Взаимодействие растворов щелочи с некоторыми неметаллами:
2NaOH + Cl2 = NaCl + NaClO + H2O (на холоде)
6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H2O (при нагревании)
2NaOH + Si = Na2SiO3 + 2H2
Взаимодействие щелочи с некоторыми металлами (образующие амфотерные соединения).
??? 4. Даны вещества: CaO, SO2, Ba(OH)2, HClO4, KCl, CuCl2.
а) Какие из перечисленных веществ реагируют с гидроксидом натрия?
б) Напишите уравнения возможных реакций.
в) Какая из приведенных реакций относится к реакции нейтрализации?
5. Какие вещества разлагаются при нагревании: Fe(OH)2, NaOH, Al(OH)3, Fe(OH)3, Ba(OH)2? Напишите уравнения возможных реакций.
6.
В трех пробирках даны растворы хлорида натрия, соляной кислоты,
гидроксида натрия. Как можно распознать эти растворы химическим
способом?
7.
Какая масса щелочи NaOH должна находиться в растворе для реакции с 16 г
сульфата меди (II), чтобы получить осадок гидроксида меди(II)?
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды, которые при диссоциации образуют одновременно и катионы Н+, и гидроксид-ионы ОН-.
Амфотерные гидроксиды соответствуют амфотерным оксидам. Например, Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2 и другие.
1) Взаимодействие амфотерных гидроксидов с кислотами:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
2) Взаимодействие амфотерных гидроксидов со щелочью:
Al(OН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Zn(OН)2 + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
3) Проявляют свойства нерастворимых оснований — разлагаются при нагревании с образованием оксида и воды:
2Al(OH)3 → Al2O3 + 3H2O
??? 8. а) Приведите примеры реакций, доказывающие свойства гидроксида цинка.
б) В какой из приведенных реакций гидроксид цинка проявляется себя как кислота?
в) В какой из приведенных реакций гидроксид цинка проявляется себя как основание?
г) Напишите уравнение реакции получения гидроксида цинка.
Ответы на вопросы, которые вы встретили в конспекте, вы можете отправить в отдельное задание.
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
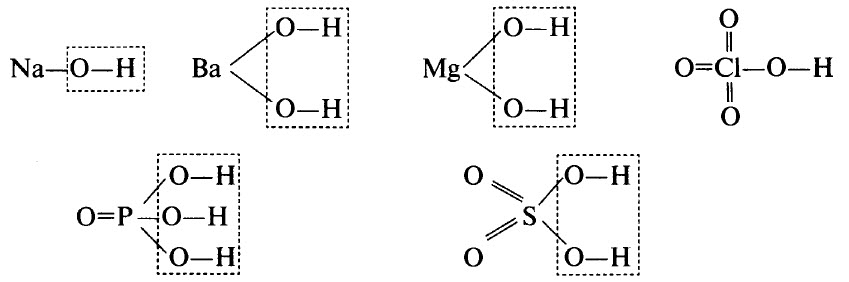
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
6.3.
Амфотерные гидроксиды, их свойства
Амфотерные гидроксиды – электролиты,
образующие при диссоциации одновременно катионы Н+и анионы ОН–:
X+ + OH– ⇌ ХOH = HXO ⇌ H++ XO–.
Амфотерные гидроксиды в кислой среде ведут
себя как основания, а в щелочной – как кислоты.
K амфотерным гидроксидам относятся Be(OH)2,
Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3,
Fe(OH)3,
Cr(OH)3 и некоторые
другие, им соответствуют амфотерные оксиды. Практически все они нерастворимы в
воде, являются слабыми электролитами и диссоциируют ступенчато.
Химические свойства
амфотерных гидроксидов
Например:
2Al(OH)3 + Na2O 2NaAlO2 + 3H2O↑.
Некоторые
амфотерные гидроксиды (Be(OH)2, Zn(OH)2, Pb(OH)2)
реагируют с кислотным оксидом СО2 с образованием осадков
основных солей и воды. Например:
2Be(OH)2 +
CO2 = (BeOH)2CO3 +
H2O.
Например:
Zn(OH)2 +
2KOH (тв.) K2ZnO2 + 2H2O↑,
Zn(OH)2 + 2KOH = K2[Zn(OH)4].
Например:
Al(OH)3 +
3HCl = AlCl3 + 3H2O.
Все
амфотерные гидроксиды (как и большинство оснований) разлагаются при нагревании
на оксид и воду. Например:
2Al(OH)3 Al2O3 +
3H2O.
В связи с
этим нужно учитывать, что фактически в процессе сплавления их со щелочами и
оксидами участвует не сам амфотерный гидроксид, а соответствующий ему оксид.
УПРАЖНЕНИЯ
1) СО2 и
HCl 2) Н2 и NaOH 3) NО
и NaNO3 4) H2SO4 и NaOH
Решение: Гидроксид хрома –
амфотерный гидроксид. Амфотерные гидроксиды реагируют с кислотами и щелочами, с
кислотыми и основными оксидами. Поэтому нам подходит вариант 4 –серная кислота
и гидроксид натрия (щелочь):
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Cr(OH)3 + NaOH
= Na[Cr(OH)4]
Ответ: 4
________________________________________________________________
2.
Гидроксид калия взаимодействует с каждым из
двух веществ
1) нитратом натрия и нитратом серебра
2) гидроксидом алюминия и нитратом серебра
3) гидроксидом цинка и оксидом меди(I)
4) хлоридом бария и оксидом фосфора(V)
Решение:
Гидроксид калия это щелочь. она взаимодействует
с кислотами,кислотными оксидами, амфотерными оксидами и гидроксидами,растворами
солей при условии, если есть признак необратимости реакции (осадок,
газ, слабый электролит). Данному условию соответствует набор веществ
в варианте 2 — амфотерный гидроксид и соль.
________________________________________________________________
3.
Осуществить превращения:
Al-1-
Al2O3 -2— NaAlO2 -3—
Al (OH)3 -4— Al2O3
1. 4Al + 3O2 = 2Al2O3
2. Al2O3 + Na2O 2NaAlO2
3. NaAlO2 + HCl + H2O = NaCl + Al(OH)3
4. 2Al(OH)3 Al2O3 +3H2O
________________________________________________________________
4.
Осуществить превращения:
AlCl3 —1—
Al(OH)3 -2— Na[Al (OH)4] —3—
AlCl3
1. AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
2. Al(OH)3 + NaOH = Na[ Al(OH)4 ]
3. Na[ Al(OH)4 ]+ 4HCl = NaCl + AlCl3 + 4H2O
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Закончите уравнения реакций:
Cr(OH)3 +
6HCl = ?
Cr(OH)3 +
NaOH = ?
2.
Напишите уравнения реакций, описывающие следующие
химические превращения:
а)
ZnCl2 + KOH(избыток) → осадок → растворение осадка;
б)
Cr(NO3)2 +
NaOH(избыток) → осадок
→ растворение осадка.
3.
Закончи уравнения реакций:
4. В предложенных рядах исключи (вычеркни) одну лишнюю
формулу – такую, которая не образует с остальными однородную группу. Объясни
свой выбор.
а)
HClO4, H2SO3, HNO3, H3PO4;
б) KOH, Mg(OH)2, Al(OH)3;
в)
HBr, HCl, HF; г) Mg(OH)2, Ca(OH)2, Zn(OH)2,
Ba(OH)2;
д) H2CO3,
H2SO3, HNO3; е) ZnO, BeO, MgO.
5. Составь уравнения реакций, соответствующие схемам:
1) Zn Na2→ZnO2 → ZnSO4 → Zn(OH)2 → ZnO;
2) Al2O3 → X → Al(OH)3 → Y → AlCl3;
6. Предложи cпособ разделения смеси KOH,
Mg(OH)2, Fe(OH)3. Напиши уравнения реакций.
………………………………………………………………………………………
……………………………………………………………………………………..
………………………………………………………………………………………
7.
Осуществите следующие превращения:
Al2O3 → Al → Al2O3 → NaAlO2 → AlCl3
8. Из порошкообразной смеси, содержащей
Na2CO3, Fe, Al и
BaSO4, выделите химическим путем все соединения в чистом виде.
Напишите уравнения реакций и последовательность их проведения (опишите
технологию всей работы).
9. Напишите схему диссоциации
гидроксида хрома (III), а также молекулярное и ионное уравнения реакций
растворения его в:
а) азотной кислоте;
б) растворе гидроксида натрия.
10. Заполни таблицу по химическим свойствам амфотерных гидроксидов
(укажи продукты реакций). Напиши уравнения реакций на примере Zn(OH)2.
Вещества-реагенты | Продукты реакции с амфотерными | |
Основный оксид | щелочных/ щелочно-земельных металлов | ………………………………………………………….. |
остальных металлов | ………………………………………………………….. | |
Амфотерный оксид | ………………………………………………………….. | |
Kислотный оксид | ………………………………………………………….. | |
Основание | растворимое (щелочь) | ………………………………………………………….. |
нерастворимое | ………………………………………………………….. | |
Амфотерный гидроксид | ………………………………………………………….. | |
Kислота | ………………………………………………………….. | |
Соль | ………………………………………………………….. | |
Металл | ………………………………………………………….. | |
Неметалл | ………………………………………………………….. | |
Термическое разложение | ………………………………………………………….. | |
1. В отличие от гидроксида калия гидроксид алюминия | |
а) хлоридом натрия | б) соляной кислотой |
в) гидроксидом натрия (р-р) | г) серной кислотой |
2. Гидроксид меди (II) | |
а) | б) меди с водой |
в) водных растворов хлорида меди (II) и гидроксида натрия | г) меди и водного раствора гидроксида |
3. В каких группах указаны формулы веществ, все из | |
а) Al, | б) P2O5, Al, |
в) Mn2O7, ZnO, | г) CO2, |
4. Действием каких веществ из гидроксида калия нельзя | |
а) нитрат натрия | б) азотная кислота |
в) нитрат меди (II) | г) оксид азота (V) |
5. Укажите схемы реакций, в результате протекания | |
а)Al2O3 + H2O → | б)Al2O3 + KOH (р-р)→ |
в)AlCl3 + K→ | г) Al2(SO4)3 + |
6. В каких парах между веществами при определенных | |
а) гидроксид калия и оксид кремния (IV) | б) хлорид калия и гидроксид бария |
в) железа и гидроксид натрия | г) гидроксид кальция и оксид углерода |
7. Щелочи могут реагировать: | |
а) только с сильными кислотами | б) все ответы верны |
в) только с кислотными оксидами | г) как с кислотными, так и с |
8. Укажите формулы веществ, с водными растворами | |
а)NaOH (разб.) | б) HCl |
в)все ответы | г) KCl |
9. Основание не образуется при взаимодействии избытка | |
а) сульфатом алюминия | б) хлоридом железа (II) |
в) нитратом аммония | г) все ответы верны |
10. Гидроксид алюминия проявляет кислотные свойства, | |
а) соляной кислотой | б) гироксидом калия |
в) серной кислотой | г) нет верного ответа |
Ответы:
1 | в |
2 | в |
3 | г |
4 | а |
5 | г |
6 | а |
7 | г |
8 | б |
9 | а |
10 | б |
