В каком объеме 1 м раствора и в каком объеме 1 н раствора содержится 114

Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
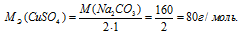
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
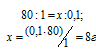
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
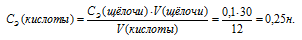
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
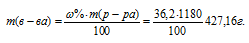
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
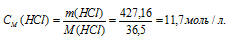
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
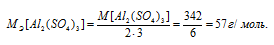
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
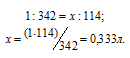
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
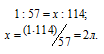
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
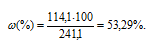
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
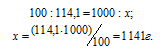
Теперь рассчитаем моляльность раствора:
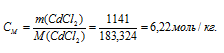
Ответ: 53,3%; 6,22 моль/кг.
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
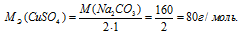
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
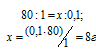
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
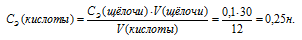
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
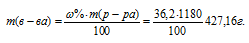
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
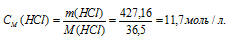
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
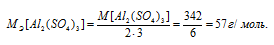
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
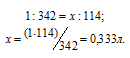
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
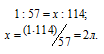
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
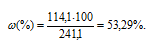
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
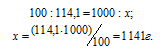
Теперь рассчитаем моляльность раствора:
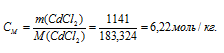
Ответ: 53,3%; 6,22 моль/кг.
Пример 1. Вычислите молярную концентрацию, молярную концентрацию эквивалентов и моляльность CuSO4 в растворе CuSO4 с концентрацией w , плотность которого г/см3.
Решение. Найдем значение молярной массы и молярной массы эквивалентов CuSO4:
В 100г раствора с w содержится 10г CuSO4 и 90г Н2O.
Следовательно, моляльность CuSO4 в растворе будет равна
.
Найдём массу 1л раствора:
.
В этой массе раствора содержится
1107 г × 0,1=110,7 г СuSO4.
Следовательно, молярная концентрация CuSO4 в растворе будет равна
,
а молярная концентрация эквивалентов CuSO4 в растворе составляет
.
Примечание.
Можно использовать следующие сокращённые записи для обозначения состава данного раствора:
– означает, что в растворе на каждый килограмм воды как растворителя приходится 0,696 моль CuSO4.
– означает, что в 1 л раствора содержится 0,693 моль CuSO4.
– означает, что в 1 л раствора содержится 1,386 моль эквивалентов CuSO4
Пример 2. Какой объем воды нужно прибавить к 200 мл раствора NaOH с концентрацией wNaOH=0,3 и с плотностью для получения раствора NaOH с концентрацией wNaOH=0,1.
Решение. Масса 200 мл исходного раствора NaOH равна
В этом растворе содержится 30 % NaOH, т.е. 266 г × 0,3=79,8 г.
По условию задачи эта масса составляет 10 % от общей массы разбавленного раствора. Тогда масса полученного раствора будет равна
Следовательно, к исходному раствору нужно прибавить Н2O:
798 г–266 г=532 г.
Пример 3. Определите молярную концентрацию эквивалентов NaOH в растворе, если на нейтрализацию 0,035л 0,3н. раствора H3PO4 израсходовано 0,02л раствора NaОН.
Решение. Произведение молярной концентрации эквивалентов вещества В на объем раствора VР равно количеству эквивалентов этого вещества. Поэтому для реакции, в которой участвуют равные количества эквивалентов веществ А и В, можно записать: .
В нашем случае .
Следовательно, .
Находим СЭК(NaOH):
Пример 4. Какой объем раствора H2SO4 с концентрацией W и с плотностью r=1,84 г/см3потребуется для приготовления 3л 0,4н. раствора H2SO4?
Решение. Молярная масса эквивалентов H2SO4 равна
г/моль.
Для приготовления 3л 0,4н. раствора H2SO4 требуется H2SO4:
49,04 г/моль × 0,4 моль/л × 3 л=58,848 г.
Масса 1см3 раствора H2SO4 с концентрацией w равна 1,84 г.
В этом растворе содержится 1,84 г × 0,96= 1,766 г H2SO4.
Отсюда для приготовления 3 л 0,4 н. раствора H2SO4 нужно взять
исходного раствора H2SO4.
Контрольные вопросы
151.Сколько граммов Na2SO3 потребуется для приготовления 5л раствора с концентрацией w =0,08 и плотностью 1,075 г/см3? Ответ: 430 г.
152.Из 400 г раствора H2SO4 с концентрацией w =0,5 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе? Ответ: 66,7 %.
153. Сколько граммов раствора NaCl с концентрацией w =0,3 нужно добавить к 300 г H2O, чтобы получить раствор с концентрацией w =0,1? Ответ:150 г.
154. Сколько граммов HCl содержится в 0,25 л раствора HCl с концентрацией wHCl=0,1052 и с плотностью 1,05 г/см3? Ответ: 27,6 г.
155. Вычислите молярную концентрацию K2SO4 в растворе, если в 0.02 л этого раствора содержится 2,74 г растворенного K2SO4. Ответ: 0.786 моль/л.
156. Раствор KOH с концентрацией wKOH=0,26 имеет плотность 1.24 г/см3. Какое количество вещества KOH содержится в 5 л этого раствора? Ответ: 28,7 моль.
157. Водный раствор содержит 577 г H2SO4 в одном литре. Плотность раствора равна 1,335 г/см3. Вычислить массовую долю, молярную концентрацию, молярную концентрацию эквивалентов и моляльность H2SO4 в растворе. Ответ: 43,22 %; 5,88 моль/л; 11,76 моль/л; 7,76 моль/кг.
158.Плотность 0,8 М раствора Fe2(SO4)3 равна 1 г/см3. Определите молярную концентрацию эквивалентов, моляльность, массовую долю Fe2(SO4)3 в растворе. Чему равен титр этого раствора? Ответ: 4,8 моль/л; 1,18 моль/кг; 32 %; 0,32 г/мл.
159. Вычислите массовую долю и моляльность HNO3 в 8н. растворе HNO3 с плотностью 1,246 г/см3. Ответ: 40,45 %; 10,8 моль/кг.
160. Сколько граммов Na2CO3 содержится в 500 мл 0,25н. раствора? Ответ: 6,63 г.
161. Сколько литров 0,1н. раствора HNO3 можно приготовить из 0,07 л раствора HNO3 с концентрацией w =0,3 и с плотностью 1,18 г/см3? Ответ: 3,93 л.
162. Из 5 л раствора KOH с концентрацией WKOH=0,5 и с плотностью 1,538 г/см3 надо приготовить раствор с концентрацией WKOH=0,18. Сколько литров H2O потребуется для этого? Ответ: 13,67 л.
163. Сколько литров 5н. раствора NaOH можно приготовить из 4 л раствора NaOH с концентрацией wNaOH=0,5 и с плотностью 1,525 г/см3? Ответ: 15,25 л.
164. Сколько миллилитров 0,5 М раствора H2SO4 можно приготовить из 15 мл 2,5 М раствора? Ответ: 75 мл.
165. В каком объеме 1 М раствора и в каком объеме 1н. раствора содержится 114 г Al2(SO4)3? Ответ: 0,333 л; 2 л.
166. Какой объем 6,0 М раствора HCl нужно взять для приготовления 25 мл 2,5 М раствора HCl? Ответ: 10,4 мл.
167. Сколько миллилитров концентрированной соляной кислоты с плотностью 1,19 г/см3 и с концентрацией wHCl=0,38 нужно для приготовления 1 л 2н. раствора? Ответ: 161,5 мл.
168. Сколько миллилитров раствора H2SO4 с концентрацией w =0,1 и с плотностью 1,07 г/см3 потребуется для нейтрализации раствора, содержащего 16 г NaOH? Ответ: 183,2 мл.
169. Какой объем 0,2н. раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0,5н. раствора FeCl3? Ответ: 0,25 л.
170. Для нейтрализации 20 мл 0,1н. раствора кислоты потребовалось 8 мл раствора NaOH. Сколько граммов NaOH содержит 1 л этого раствора? Ответ: 10 г.
171. К 1 л раствора КОН с концентрацией wKOH=0,1 и с плотностью 1,092 г/см3 прибавили 0,5 л раствора КОН с концентрацией wKOH=0,05 и с плотностью 1,045 г/см3. Объем смеси довели до 2-х литров. Вычислите молярную концентрацию КОН в полученном растворе. Ответ: 1,2 моль/л.
172. На нейтрализацию 31 см3 0,16н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны молярная концентрация эквивалентов H2SO4 в растворе и титр раствора H2SO4? Ответ: 0,023 моль/л; 1,12×10–3 г/мл.
173. Какой объем 0,3н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3.
174. На нейтрализацию 40 мл раствора щелочи израсходовано 25 мл 0,5н. раствора H2SO4. Какова молярная концентрация эквивалентов щелочи в растворе? Какой объем 0,5н. раствора HCl потребовался бы для той же цели? Ответ: 0,3 моль/л; 24 мл.
175. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2н. раствора HCl. Какова молярная концентрация эквивалентов AgNO3 в растворе? Какая масса AgCl выпала в осадок? Ответ: 0,1 моль/л; 1,433 г.
Êîíöåíòðàöèÿ ðàñòâîðà ìîæåò âûðàæàòüñÿ êàê â áåçðàçìåðíûõ åäèíèöàõ (äîëÿõ, ïðîöåíòàõ), òàê è â ðàçìåðíûõ âåëè÷èíàõ (ìàññîâûõ äîëÿõ, ìîëÿðíîñòè, òèòðàõ, ìîëüíûõ äîëÿõ).
Êîíöåíòðàöèÿ – ýòî êîëè÷åñòâåííûé ñîñòàâ ðàñòâîðåííîãî âåùåñòâà (â êîíêðåòíûõ åäèíèöàõ) â åäèíèöå îáúåìà èëè ìàññû. Îáîçíà÷èëè ðàñòâîðåííîå âåùåñòâî — Õ, à ðàñòâîðèòåëü — S. ×àùå âñåãî èñïîëüçóþ ïîíÿòèå ìîëÿðíîñòè (ìîëÿðíàÿ êîíöåíòðàöèÿ) è ìîëüíîé äîëè.
Ñïîñîáû âûðàæåíèÿ êîíöåíòðàöèè ðàñòâîðîâ.
1. Ìàññîâàÿ äîëÿ (èëè ïðîöåíòíàÿ êîíöåíòðàöèÿ âåùåñòâà) – ýòî îòíîøåíèå ìàññû ðàñòâîðåííîãî âåùåñòâà m ê îáùåé ìàññå ðàñòâîðà. Äëÿ áèíàðíîãî ðàñòâîðà, ñîñòîÿùåãî èç ðàñòâîð¸ííîãî âåùåñòâà è ðàñòâîðèòåëÿ:
 ,
,
ãäå:
ω – ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà;
mâ-âà – ìàññà ðàñòâîð¸ííîãî âåùåñòâà;
mð-ðà – ìàññà ðàñòâîðèòåëÿ.
Ìàññîâóþ äîëþ âûðàæàþò â äîëÿõ îò åäèíèöû èëè â ïðîöåíòàõ.
2. Ìîëÿðíàÿ êîíöåíòðàöèÿ èëè ìîëÿðíîñòü – ýòî êîëè÷åñòâî ìîëåé ðàñòâîð¸ííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà V:
 ,
,
ãäå:
C – ìîëÿðíàÿ êîíöåíòðàöèÿ ðàñòâîð¸ííîãî âåùåñòâà, ìîëü/ë (âîçìîæíî òàêæå îáîçíà÷åíèå Ì, íàïðèìåð, 0,2 Ì HCl);
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
V – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîð íàçûâàþò ìîëÿðíûì èëè îäíîìîëÿðíûì, åñëè â 1 ëèòðå ðàñòâîðà ðàñòâîðåíî 1 ìîëü âåùåñòâà, äåöèìîëÿðíûì – ðàñòâîðåíî 0,1 ìîëÿ âåùåñòâà, ñàíòèìîëÿðíûì – ðàñòâîðåíî 0,01 ìîëÿ âåùåñòâà, ìèëëèìîëÿðíûì – ðàñòâîðåíî 0,001 ìîëÿ âåùåñòâà.
3. Ìîëÿëüíàÿ êîíöåíòðàöèÿ (ìîëÿëüíîñòü) ðàñòâîðà Ñ(x) ïîêàçûâàåò êîëè÷åñòâî ìîëåé n ðàñòâîðåííîãî âåùåñòâà â 1 êã ðàñòâîðèòåëÿ m:
 ,
,
ãäå:
Ñ (x) – ìîëÿëüíîñòü, ìîëü/êã;
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
mð-ëÿ – ìàññà ðàñòâîðèòåëÿ, êã.
4. Òèòð – ñîäåðæàíèå âåùåñòâà â ãðàììàõ â 1 ìë ðàñòâîðà:
 ,
,
ãäå:
T – òèòð ðàñòâîð¸ííîãî âåùåñòâà, ã/ìë;
mâ-âà – ìàññà ðàñòâîðåííîãî âåùåñòâà, ã;
Vð-ðà – îáú¸ì ðàñòâîðà, ìë.
5. Ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà – áåçðàçìåðíàÿ âåëè÷èíà, ðàâíàÿ îòíîøåíèþ êîëè÷åñòâà ðàñòâîðåííîãî âåùåñòâà n ê îáùåìó êîëè÷åñòâó âåùåñòâ â ðàñòâîðå:
 ,
,
ãäå:
N – ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà;
n – êîëè÷åñòâî ðàñòâîð¸ííîãî âåùåñòâà, ìîëü;
nð-ëÿ – êîëè÷åñòâî âåùåñòâà ðàñòâîðèòåëÿ, ìîëü.
Ñóììà ìîëüíûõ äîëåé äîëæíà ðàâíÿòüñÿ 1:
N(X) + N(S) = 1.
ãäå N(X) — ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà Õ;
N(S) — ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà S.
Èíîãäà ïðè ðåøåíèè çàäà÷ íåîáõîäèìî ïåðåõîäèòü îò îäíèõ åäèíèö âûðàæåíèÿ ê äðóãèì:

ω(X) — ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà, â %;
Ì(Õ) – ìîëÿðíàÿ ìàññà ðàñòâîðåííîãî âåùåñòâà;
ρ= m/(1000V) – ïëîòíîñòü ðàñòâîðà.6. Íîðìàëüíàÿ êîíöåíòðàöèÿ ðàñòâîðîâ (íîðìàëüíîñòü èëè ìîëÿðíàÿ êîíöåíòðàöèÿ ýêâèâàëåíòà) – ÷èñëî ãðàìì-ýêâèâàëåíòîâ äàííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà.
Ãðàìì-ýêâèâàëåíò âåùåñòâà – êîëè÷åñòâî ãðàììîâ âåùåñòâà, ÷èñëåííî ðàâíîå åãî ýêâèâàëåíòó.
Ýêâèâàëåíò – ýòî óñëîâíàÿ åäèíèöà, ðàâíîöåííàÿ îäíîìó èîíó âîäîðîäà â êèñëîòîíî-îñíîâíûõ ðåàêöèÿõ èëè îäíîìó ýëåêòðîíó â îêèñëèòåëüíî – âîññòàíîâèòåëüíûõ ðåàêöèÿõ.
Äëÿ çàïèñè êîíöåíòðàöèè òàêèõ ðàñòâîðîâ èñïîëüçóþò ñîêðàùåíèÿ í èëè N. Íàïðèìåð, ðàñòâîð, ñîäåðæàùèé 0,1 ìîëü-ýêâ/ë, íàçûâàþò äåöèíîðìàëüíûì è çàïèñûâàþò êàê 0,1 í.
 ,
,
ãäå:
ÑÍ – íîðìàëüíàÿ êîíöåíòðàöèÿ, ìîëü-ýêâ/ë;
z – ÷èñëî ýêâèâàëåíòíîñòè;
Vð-ðà – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîðèìîñòü âåùåñòâà S — ìàêñèìàëüíàÿ ìàññà âåùåñòâà, êîòîðàÿ ìîæåò ðàñòâîðèòüñÿ â 100 ã ðàñòâîðèòåëÿ:

Êîýôôèöèåíò ðàñòâîðèìîñòè – îòíîøåíèå ìàññû âåùåñòâà, îáðàçóþùåãî íàñûùåííûé ðàñòâîð ïðè êîíêðåòíîé òåìïåðàòóðå, ê ìàññå ðàñòâîðèòåëÿ:

Вопросы к контрольной работе
для студентов I курса заочной формы обучения
фармацевтического факультета
1. Основные способы приготовления растворов из фиксаналов, по навеске реактива, разбавлением более концентрированного раствора данного вещества. Как приготовить растворы, используемые в медико-санитарной практике: а) 0,1М HCl; б) 0,9% NaCl; в) 5%NH3*H2O;
г) 0,1н (КMnO4); д) 0,1н. NaOH.
2. Способы выражения концентрации растворов: массовая доля, молярная концентрация. Применение в медицине. Рассчитайте массовую долю вещества в растворе с молярной концентрацией уксусной кислоты
5,6 моль/л (r = 1,034 г/мл).
3. Способы выражения концентрации растворов: молярная концентрация эквивалента, титр. Молярная концентрация окислителя в растворе равна
0,03 моль/л. Определите молярную концентрацию эквивалента окислителя, принимая во внимание химизм реакции:
KMnO4 + H2O2 + H2SO4 ® MnSO4 + …
4. Дайте определение: «раствор», «растворитель», «растворенное вещество». Ответ поясните на примерах. Какой объем 0,1М раствора Н3РО4, можно приготовить из 85 мл раствора с молярной концентрацией эквивалента Н3РО4 равной 0,75н. (f(Н3РО4) = 1/3)?
5. Сколько миллилитров концентрированной соляной кислоты с массовой долей 40% и r = 1,198 г/мл следует взять для приготовления 1,0 л 2,5н. HCl? Опишите способ приготовления растворов методом разбавления концентрированных растворов.
6. Кальций хлорид используется как кровоостанавливающиее средство. Как приготовить 200 мл 3% раствора СаCl2 из кристаллического СаCl2*6Н2О, если плотность полученного раствора 1,0 г/мл? Какова молярная концентрация СаCl2 в полученном растворе. Опишите способ приготовления растворов из фиксаналов.
7. В 2,5 л раствора содержится 18,55 г алюмокалиевых квасцов KAl(SO4)3*12H2O. Рассчитайте: а) молярную концентрацию квасцов в растворе; б) молярную концентрацию эквивалента квасцов в растворе (fквасцов = 1/4). Опишите способ приготовления растворов из навески твердого вещества.
8. Рассчитайте массу кристаллического натрий хлорида, которая необходима для приготовления раствора с молярной концентрацией натрий хлорида 0,75М. Выразите концентрацию приготовленного раствора через массовую долю и титр (r = 1,034 г/мл). Опишите способ приготовления такого раствора.
9. Какой объем 0,1М раствора Н3РО4, можно приготовить из 40 мл раствора с молярной концентрацией эквивалента Н3РО4, равной 0,9 моль (f(Н3РО4) = 1/3)?
10. Вычислите молярную концентрацию и молярную концентрацию эквивалента H2SO4 в растворе, если массовая доля H2SO4 в этом растворе равна 58% (r = 1,48 г/мл). Медико-биологичес-кое значение растворов.
11. Молярная концентрация натрия карбоната в растворе 0,15 моль/л (r = 1,0 г/мл). Вычислите молярную концентрацию эквивалента, титр и массовую долю Na2CO3 в растворе. Дайте определение понятию «моляльность раствора».
12. При некоторых заболеваниях в кровь вводят 0,9% раствор NaCl (r =
1 г/мл). Вычислите: а) молярную концентрацию и титр этого раствора; б) массу соли, введенную в организм при вливании 600 мл этого раствора.
13. К 100 мл 96% (по массе) H2SO4 (r = 1,84 г/мл) прибавили 410 мл воды, получили раствор с r = 1,22 г/мл. Вычислите молярную концентрацию эквивалента и массовую долю H2SO4 в этом растворе с учетом, что (f(Н2SО4) = 1/2). Каким способом приготовлен этот раствор? Опишите методику приготовления такого раствора.
14. 5 мл раствора с молярной концентрацией H2SO4 1 моль/л разбавили водой до 250 мл. Рассчитайте w(H2SO4); c(H2SO4) и c(1/2H2SO4) для полученного раствора, если его плотность равна 1 г/мл.
15. Найдите молярность и моляльность 36,2% (по массе) раствора HCl, плотность которого 1,18 г/мл. Сколько мл этого раствора необходимо взять для приготовления 5 л 0,1н. раствора HCl?
16. Какой объем 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5н. раствора? Дайте определения понятиям: эквивалент, фактор эквивалентности, количество вещества эквивалента, молярная концентрация эквивалента. (fэк(H2SO4) = )
17. Найдите массу NaNO2, необходимую для приготовления 300 мл 0,2М раствора. Опишите способ приготовления такого раствора из навески твердого вещества.
18. Плотность 40% (по массе) раствора HNO3 равна 1,25 г/мл. Рассчитайте молярность, моляльность и титр этого раствора. Как приготовить раствор из фиксанала?
19. 6,8 г карбоната натрия растворили в 104 г воды. Вычислите массовую и молярную доли растворенного вещества в растворе. Опишите способ приготовления раствора с определенной массовой долей растворенного вещества.
20. Найдите моляльность и молярную долю растворенного вещества в 67%-ном (по массе) растворе сахарозы С12Н22О11. Дайте определение понятиям «молярная концентрация эквивалента» и «молярная концентрация».
21. В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114 г Al2(SO4)3. Опишите способы приготовления этих растворов.
22. Какой объем 6,0М раствора HCl нужно взять для приготовления 25 мл 2,5М раствора HCl. Определите титр полученного раствора.
23. Рассчитайте молярную массу эквивалента: а) фосфорной кислоты в реакции полного обмена протонов; б) сульфата железа(III) в реакции полного обмена ионов железа; в) гидрокарбоната кальция в реакции частичного обмена ионов кальция; г) дигидрофосфата аммония в реакции частичного обмена протонов.
24. При отравлениях цианидами внутривенно вводят 2%-ный раствор нитрата натрия (r = 1,011 г/мл). Вычислите молярную концентрацию, титр и моляльность этого раствора.
25. Водный раствор сульфата меди с массовой долей 1% (r = 1,009 г/мл) назначают в малых дозах для улучшения кроветворной функции. Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, титр и моляльность этого раствора?
26. Какую массу калий бромида нужно прибавить к 5 кг 16% раствора, чтобы получить 20% раствор? Рассчитайте молярную концентрацию и молярную концентрацию эквивалента полученного раствора?
27. Сколько граммов 30% раствора гидроксида калия надо прибавить к 200 г 90% раствора, чтобы получить 50% раствор гидроксида калия?
28. В лаборатории имеются растворы с массовой долей хлорида натрия 10% и 20%. Какую массу каждого раствора надо взять для получения 300 г раствора с массовой долей соли 12%?
29. Какой объем раствора с массовой долей серной кислоты 60% (r =
1,5 г/мл) и раствора с массовой долей серной кислоты 30% (r = 1,2 г/мл) надо взять для приготовления раствора H2SO4 массой 240 г с массовой долей кислоты 50%?
30. Какие объемы раствора NaCl с w1 = 5% и w2 = 24% нужно взять для приготовления 250 мл раствора с w3 = 18%? (r1 = 1,03 г/мл; r2 =
1,18 г/мл; r3 = 1,13 г/мл).
31. Определите массу раствора с массовой долей CuSO4 10% и массу воды, которые требуются для приготовления раствора массой 500 г с массовой долей CuSO4 2%.
32. Какая масса воды и раствора с массовой долей хлорида магния 0,2 потребуется для приготовления 300 г раствора с массовой долей MgCl2 0,04?
33. На нейтрализацию 40 мл раствора едкого натра израсходовано 25 мл
0,5 н. раствора серной кислоты. Определите молярную концентрацию эквивалента едкого натра.
34. Сколько литров 0,03 н. раствора Н3РО4 способно прореагировать с 250 г
4%-ного раствора NaOH с образованием дигидроортофосфата натрия?
35. Какой объем 3 н. раствора H2SO4 требуется для нейтрализации 8,415 г КОН?
36. Сколько граммов Na2CO3 требуется для взаимодействия с 600 мл 0,5 н. раствора HNO3?
37. Какой объем 4 н. раствора HCl требуется для нейтрализации 10 г NaOH?
38. Сколько граммов 5%-ного раствора AgNO3 требуется для обменной реакции со 120 мл 0,6 н. AlCl3?
