В какой реакции хлор проявляет окислительные свойства
Õëîð – ýëåìåíò VII ïîäãðóïïû Ïåðèîäè÷åñêîé òàáëèöû Ä.È.Ìåíäåëååâà. Íà âíåøíåì óðîâíå – 7 ýëåêòðîíîâ, ïîýòîìó ïðè âçàèìîäåéñòâèè ñ âîññòàíîâèòåëÿìè, õëîð ïîêàçûâàåò ñâîè îêèñëèòåëüíûå ñâîéñòâà, ïðèòÿãèâàÿ ê ñåáå ýëåêòðîí ìåòàëëà.
Ôèçè÷åñêèå ñâîéñòâà õëîðà.
Õëîð ïðåäñòàâëÿåò ñîáîé æåëòûé ãàç. Èìååò ðåçêèé çàïàõ.
Õèìè÷åñêèå ñâîéñòâà õëîðà.
Ñâîáîäíûé õëîð î÷åíü àêòèâåí. Îí ðåàãèðóåò ñî âñåìè ïðîñòûìè âåùåñòâàìè, êðîìå êèñëîðîäà, àçîòà è áëàãîðîäíûõ ãàçîâ:
Si + 2Cl2 = SiCl4 + Q.
Ïðè âçàèìîäåéñòâèè ñ âîäîðîäîì ïðè êîìíàòíîé òåìïåðàòóðå ðåàêöèè ïðàêòè÷åñêè íåò, íî êàê òîëüêî îñâåùåíèå âûñòóïàåò â êà÷åñòâå âíåøíåãî âîçäåéñòâèÿ, âîçíèêàåò öåïíàÿ ðåàêöèÿ, êîòîðàÿ íàøëà ñâîå ïðèìåíåíèå â îðãàíè÷åñêîé õèìèè.
Ïðè íàãðåâå õëîð ñïîñîáåí âûòåñíèòü éîä èëè áðîì èç èõ êèñëîò:
Cl2 + 2HBr = 2HCl + Br2.
Ñ âîäîé õëîð ðåàãèðóåò, ÷àñòè÷íî ðàñòâîðÿÿñü â íåé. Ýòó ñìåñü íàçûâàþò õëîðíîé âîäîé.
Ðåàãèðóåò ñ ùåëî÷àìè:
Cl2 + 2NaOH = NaCl + NaClO + H2O (õîëîä),
Cl2 + 6KOH = 5KCl + KClO3 + 3 H2O (íàãðåâ).
Ïîëó÷åíèå õëîðà.
1. Ýëåêòðîëèç ðàñïëàâà õëîðèäà íàòðèÿ, êîòîðûé ïðîòåêàåò ïî ñëåäóþùåé ñõåìå:
2. Ëàáîðàòîðíûé ñïîñîá ïîëó÷åíèÿ õëîðà:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå ýëåìåíòû | |
| Õèìè÷åñêèå ýëåìåíòû Ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà, ñâîéñòâà, âàëåíòíîñòü õèìè÷åñêèõ ýëåìåíòîâ | |
| Õèìè÷åñêèå ýëåìåíòû | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õëîðèäû ìåòàëëîâ. | |
| Õëîðèä ìåòàëëîâ ýòî ïðîèçâîäíîå îò õëîðîâîäîðîäíîé êèñëîòû è àòîìîì ìåòàëëà. | |
| Õëîðèäû ìåòàëëîâ. | |
30-Окт-2012 | комментариев 6 | Лолита Окольнова
или подгруппа фтора
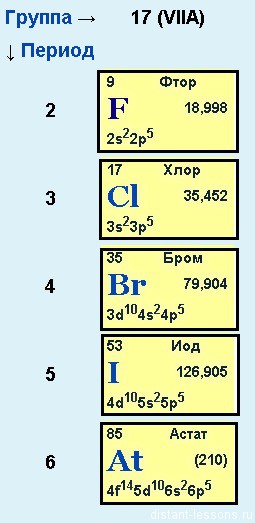
Фтор, хлор, бром, йод и астат
Общее электронное строение:
nS2 np5
И, как всегда, все не так просто, как хотелось бы…
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
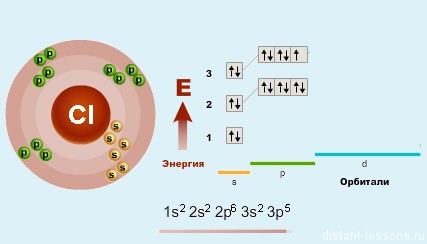
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора (!!!) возможны степени окисления +1, +3, +5 и +7.
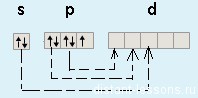
Итак, выводы:
- Валентность элементов:
- валентность фтора = 1,
- валентность хлора и остальных галогенов — 1,3,5 и 7
- Степени окисления:
- степень окисления фтора = -1 — типичный неметалл, самый сильный неметалл — просто КОРОЛЬ неметаллов — самый верхний в группе и самый левый в периоде.;
- степень окисления хлора и остальных галогенов = -1 (минимальная степень окисления), +1 , +3, +5 и +7 (максимальная степень окисления) в минимальной с.о. элементы будут проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства галогенов
- Фтор — F2 — светло-желтый газ;

- Хлор Cl2 — желто-зеленый газ;
- Бром — Br2 — бурая жидкость;
- Йод — J2 — темно-фиолетовые кристаллы, металлический блеск.
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
1. Взаимодействие с водородом:
F2 + H2 = 2HF — плавиковая кислота
2. Взаимодействие с металлами:
F2 + 2Li = 2LiF — фторид лития (галогениды)
3. Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
4.Окислительный свойства:
Сl2 + H2S = S + 2HCl
5. Взаимодействие с водой:
раствор HF — плавиковая кислота
Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора
Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
- сверху вниз в подгруппе восстановительные свойства усиливаются.
- сила кислот сверху вниз увеличивается
- с увеличением степени окисления элемента в оксосоединениях усиливаются окислительные свойства.
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
Тест «Галогены»
1. Йод по сравнению с хлором проявляет:
более металлические свойства
более неметаллические свойства
окислительные свойства
амфотерные свойства
2. У всех элементов 7 группы главной подгруппы:
одинаковое количество электронов
одинаковый радиус
одинаковое количество электронов на внешнем уровне
одинаковое количество электронных слоев
3. При нормальных условиях агрегатное состояние — твердое, цвет — почти черный характерно для:
фтора
хлора
брома
йода
4. Степени окисления хлора в соединениях: Cl2, HClO4, HCl и HClO равны соответственно:
0, +7, -1, +1
0, +5, -1, +1
0, -1, -1, +1
+1 и -1, +7, -1, 0
5. При взаимодействии MnO2 и HCl образуются:
MnCl4 и HCl
MnCl2 и HCl
MnCl2, Cl2 и H2O
MnCl2 и Cl2
6. Соляная кислота НЕ реагирует с:
NaOH
Zn
CuO
Cu
7. В реакции горячего раствора NaOH с Cl2 образуются:
NaCl и H2O
NaClO и H2O
NaCl, NaClO3 и H2O
NaClO3 и H2O
8. В соединении OF2 степень окисления кислорода:
+2
-2
-1
9. В каком из перечисленных соединений массовая доля хлора больше:
HCLO4
HCl
HClO
CaCl2
10. Кислую среду имеет раствор:
NH4Cl
AgCl
NaCl
NaClO4
Категории:
|
Обсуждение: «Химические свойства галогенов»
(Правила комментирования)
Задача 823.
Как изменяются в ряду HOCl — HClO2 — HClO3 — HClO4: а) устойчивость; б) окислительные свойства; в) кислотные свойства?
Решение:
а) С увеличением степени окисления хлора устойчивость его кислородных кислот растёт в ряду HOCl — HClO2 — HClO3 — HClO4. Объясняется это тем, что при
возрастании степени окисления хлора увеличивается заряд ионов , что усилит его притяжение к иону О2-, связь Cl—O будет усиливаться.
б) С увеличением степени окисления хлора окислительные свойства кислородных кислот в ряду HOCl — HClO2 — HClO3 — HClO4 будут усиливаться. Объясняется это тем, что при увеличении степени окисления атома хлора будет уменьшаться способность его отдавать электроны. Так в HCO атом хлора находится в своей степени окисления +1, а в HClO2 – в степени окисления +3, поэтому ион хлора Cl+ может отдать шесть электронов, а ион Сl3+ — четыре электрона; присоединить ион Cl+ может один или два электрона, а ион Сl3+ — три или четыре. Таким образом, окислительная способность ионов уменьшается с увеличением степени окисления атомов хлора.
в) С увеличением степени окисления хлора сила его кислородсодержащих кислот возрастают в ряду HOCl — HClO2 — HClO3 — HClO4. Из всех гидроксидов хлора самая слабая кислота это HOCl. При возрастании степени окисления хлора увеличивается заряд иона , что усилит его притяжение к иону О2- и, тем самым, затруднит диссоциацию гидроксида по типу основания. Вместе с тем усилится взаимное отталкивание одноимённо заряжённых ионов и Н+, что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисления хлора усиливаются кислотные свойства и ослабевают основные свойства его гидроксидов.
Задача 824.
Как изменяются кислотные и окислительно-восстановительные свойства в ряду НОСl — НОВг — НОI?
Решение:
Увеличение радиуса иона Гn+ при неизменном его заряде приведёт к возрастанию расстояний между центром этого иона и центром ионов О2- и Н+. В результате взаимное электростатическое притяжение ионов Гn+ и О2- станет более слабым, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов Гn+ и Н+, так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона галогена (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства. Поэтому изменение кислотных свойств в ряду
НОСl — НОВг — НОI будет идти в сторону уменьшения. Хлорноватистая кислота будет самой сильной, иодноватистая – самой слабой, бромноватистая – промежуточной по силе кислотой из трёх рассматриваемых кислот.
Ионная схема молекулы гидроксида ГОН:

Задача 825.
Почему из всех галогенов только йод образует многоосновные кислородные кислоты? Указать тип гибридизации АО галогенов в их высших кислородных кислотах.
Решение:
Из всех галогенов йод имеет самый большой заряд ядра атома и самое большое количество промежуточных энергетических уровней. У йода, как у атома, так и иона, самый большой радиус из всех галогенов. В результате у йода самое большое межмолекулярное дисперсионное взаимодействие, что обуславливает большую прочность его соединений. Из-за большого атомного объёма йода электростатическое взаимодействие между ионами и становится более слабым, чем между ионами других галогенов и , что, естественно, облегчает диссоциацию кислоты по основному типу; одновременно уменьшится взаимное отталкивание ионов и Н+, что, естественно, затрудняет диссоциацию гидроксида по кислотному типу. Поэтому гидроксиды йода будут являться более сильными основаниями, чем гидроксиды других галогенов, например, хлора и брома. В гидроксиде йода, где атом йода находится в своей высшей степени окисления, в водных растворах возможно образование многоосновных кислот. При взаимодействии йодной кислоты с водой, в зависимости от условий, может образоваться несколько соединений общей формулы (НIO4)n . (Н2О)m. Во всех этих соединениях водород воды способен замещаться на металл так же, как и водород самого гидроксида йода (VII). В связи с этим соединения подобного типа обычно рассматриваются как сложные кислоты и приписывают им следующие форомулы: HIO4 (n = 1, m = 0); H3IO5 (n = 1, m = 1);
H4I2O9 (n = 2, m = 1); H5IO6 (n = 1, m = 2); HIO5 (n = 1, m = 2). Например, были получены H4I2O9 и следующие серебряные соли: оранжевая AgIO4, красная Ag2HIO5, чёрная Ag3IO5, зеленовато-жёлтая Ag2HIO5, чёрная Ag5IO6. В последней из перечисленных выше солей H5IO6 выступает как пятиосновная кислота. Молекула H5IO6 представляет собой несколько искажённый октаэдр. В кристалле между такими молекулами осуществляются водородные связи. При нагревании H5IO6 в вакууме до 80 0С получается H4I2O9. Свободная H3IO5 не выделена. Строение отвечает октаэдру с йодом в центре, а иона — тетраэдру с йодом в центре.
Типы гибридизации АО галогенов в их кислотах:
а) НГО – тип гибридизации отсутствует;
б) НГО2 — тип гибридизации отсутствует;
в) НГО3 — тип гибридизации sp3;
г) НГО4 — тип гибридизации sp3;
д) Н5IO6 — тип гибридизации sp3d2.
sp3d2 – гибридные орбитали направлены к вершине октаэдра.
Задача 826.
Как получить НIО3, исходя из свободного йода, диоксида марганца и соляной кислоты? Составить уравнения соответствующих реакций.
Решение:
Получение НIО3 из свободного йода, диоксида марганца и соляной кислоты:
а) При действии раствора соляной кислоты на диоксид марганца можно получить хлор:
4HCl + MnO2 ↔ Cl2 + MnCl2 + 2H2O;
б) Йодноватую кислоту можно получить окислен7ием хлора йодом:
Cl2 + I2 + 6H2O ↔ 2HIO3 +10HCl.
По этой реакции хлороводород выделяется в виде газа, который отводят из системы, а раствор выпаривают и получают кристаллическую кислоту НIО3. Йодноватая кислота довольно стойкое вещество, представляющее собой бесцветные кристаллы, которые вполне устойчивые при обычных условиях.
9.1. Îñîáåííîñòè ñòðîåíèÿ è
ïðî÷íîñòü ñâÿçè Cl-O â îêñîàíèîíàõ.
 âîäíûõ ðàñòâîðàõ îêñîêèñëîòû õëîðà
äèññîöèèðóþò, ìíîãèå èç íèõ èçâåñòíû òîëüêî â
ðàñòâîðå, ïîýòîìó, çà èñêëþ÷åíèåì ñëàáîé HClO,
èìååò ñìûñë ñðàâíèâàòü ñòðîåíèå (còðîåíèå
ãàçîîáðàçíîé HClO4óñòàíîâëåíî
ýëåêòðîíîãðàôè÷åñêè: àòîìû êèñëîðîäà
ðàñïîëîæåíû â âåðøèíàõ èñêàæåííîãî òåòðàýäðà) è
ñâîéñòâà îêñîàíèîíîâ. Â ðÿäó HClO-HClO2—HClO3—HClO4
ïðîñòðàíñòâåííîå ñòðîåíèå àíèîíîâ èçìåíÿåòñÿ
(òàáë.7) îò ëèíåéíîãî â ñëó÷àå äîòåòðàýäðè÷åñêîãî â .
Ñëåäóåò îòìåòèòü óìåíüøåíèå ìåæàòîìíîãî
ðàññòîÿíèÿ è óâåëè÷åíèå ýíåðãèè ñâÿçè Cl-O â
àíèîíàõ ïî ìåðå óâåëè÷åíèÿ â íèõ ÷èñëà àòîìîâ
êèñëîðîäà. Ñ ïîçèöèè ìåòîäà ÌÎ ËÊÀÎ ýòî ñâÿçàíî ñ
óâåëè÷åíèåì ÷èñëà ýëåêòðîíîâ íà ñâÿçûâàþùèõ
ìîëåêóëÿðíûõ îðáèòàëÿõ. Ñ òî÷êè çðåíèÿ ìåòîäà
âàëåíòíûõ ñâÿçåé (ÌÂÑ), ïîâûøåíèå ïðî÷íîñòè ñâÿçè
Cl-O â ðÿäó HClO-
ìîæåò áûòü ñâÿçàíî ñ óâåëè÷åíèåì ñâÿçûâàíèÿ çà
ñ÷åò âàêàíòíûõ , -îðáèòàëåé õëîðà è
ýëåêòðîíîâ 2ðõ -è 2ðy-îðáèòàëåé
êèñëîðîäà, íå ó÷àñòâóþùèõ â îáðàçîâàíèè -ñâÿçåé.
9.3. Ñòàáèëüíîñòü îêñîêèñëîò õëîðà è
èõ ñîëåé.
Áîëüøèíñòâî îêñîêèñëîò ãàëîãåíîâ ñóùåñòâóþò
òîëüêî â âîäíûõ ðàñòâîðàõ. Õèìè÷åñêèå ñâîéñòâà
êèñëîò è èõ ñîëåé îïðåäåëÿþòñÿ ñòàáèëüíîñòüþ,
èëè óñòîé÷èâîñòüþ, àíèîíîâ â êèñëûõ, íåéòðàëüíûõ
è ùåëî÷íûõ ñðåäàõ.
Ñóùåñòâóþò äâà ïîäõîäà ê îïðåäåëåíèþ
ñòàáèëüíîñòè — òåðìîäèíàìè÷åñêèé è êèíåòè÷åñêèé.
Ñîåäèíåíèå íàçûâàþò òåðìîäèíàìè÷åñêè
óñòîé÷èâûì, åñëè îíî ñàìîïðîèçâîëüíî íå
ìîæåò ïðåâðàòèòüñÿ â äðóãèå ñîåäèíåíèÿ. Ýòî
îïðåäåëåíèå îñíîâàíî íà çàêîíàõ òåðìîäèíàìèêè è
îòíîñèòñÿ ê ðàâíîâåñèþ ñîåäèíåíèÿ ñ ïðîäóêòàìè
åãî ðàñïàäà èëè ïðåâðàùåíèÿ. Òåðìîäèíàìè÷åñêèé
ïîäõîä ñâÿçàí ñ ïðåäñòàâëåíèåì î íà÷àëå è êîíöå
ðåàêöèè. Îí îïðåäåëÿåò âîçìîæíóþ ñòåïåíü
ïðåâðàùåíèÿ èñõîäíûõ âåùåñòâ â êîíå÷íûå, òî åñòü
êîíñòàíòó ðàâíîâåñèÿ Êðàâí.. Â ñâîþ
î÷åðåäü, âåëè÷èíà Êðàâí. ñâÿçàíà ñ
ðàçëè÷èåì ýíåðãèé Ãèááñà êîíå÷íûõ è èñõîäíûõ
âåùåñòâ óðàâíåíèåì:
×åì ìåíüøå ðàçíèöà rGo,
òåì áîëüøå Êðàâí, à, ñëåäîâàòåëüíî,
ñîåäèíåíèå òåðìîäèíàìè÷åñêè ìåíåå ñòàáèëüíî
(óñòîé÷èâî) ïî îòíîøåíèþ ê ïðîäóêòàì ðàñïàäà.
Ñîåäèíåíèå ñ÷èòàåòñÿ êèíåòè÷åñêè
óñòîé÷èâûì, åñëè îíî íå èçìåíÿåòñÿ âî
âðåìåíè. Êèíåòè÷åñêèé ïîäõîä ñâÿçàí ñ îïèñàíèåì
ñêîðîñòè óñòàíîâëåíèÿ òåðìîäèíàìè÷åñêîãî
ðàâíîâåñèÿ, òî åñòü ñ ìåõàíèçìîì ðåàêöèé. Åñëè
âðåìÿ ñóùåñòâîâàíèÿ ñîåäèíåíèÿ, òî åñòü âðåìÿ
ïðåâðàùåíèÿ åãî â êîíå÷íûå ñîåäèíåíèÿ,
äîñòàòî÷íî âåëèêî, íàïðèìåð, áîëüøå âðåìåíè,
êîòîðîå íåîáõîäèìî äëÿ åãî èäåíòèôèêàöèè ñ
ïîìîùüþ òåõ èëè èíûõ ïðèáîðîâ, ìîæíî ãîâîðèòü î
êèíåòè÷åñêîé óñòîé÷èâîñòè äàííîãî ñîåäèíåíèÿ.
Êîãäà ðå÷ü èäåò î ðàâíîâåñèè, òî ìîæíî
èñïîëüçîâàòü òåðìèí òåðìîäèíàìè÷åñêàÿ
ñòàáèëüíîñòü, èëè ïðîñòî ñòàáèëüíîñòü.
Äëÿ õàðàêòåðèñòèêè êèíåòè÷åñêîé óñòîé÷èâîñòè
èñïîëüçóåòñÿ òåðìèí èíåðòíîñòü, à äëÿ
êèíåòè÷åñêîé íåóñòîé÷èâîñòè — òåðìèí ëàáèëüíîñòü.
Ðèñ.6. Äèàãðàììà îêèñëèòåëüíûõ ñîñòîÿíèé õëîðà
ïðè ðÍ=0 (ñïëîøíàÿ ëèíèÿ) è ðÍ=14 (ïóíêòèðíàÿ
ëèíèÿ). Òî÷êàìè óêàçàí ñòàíäàðòíûé ïîòåíöèàë Åî=
1.23 Â ñèñòåìû Î2+4H++4=2H2O.
 ðàñòâîðàõ âçàèìíîå ïðåâðàùåíèå îêñîêèñëîò
õëîðà ñîïðîâîæäàåòñÿ èçìåíåíèåì ñòåïåíè
îêèñëåíèÿ (ÑÎ) àòîìà õëîðà. Ïîýòîìó
ñòàáèëüíîñòü è îêèñëèòåëüíûå (ñì.11.4)
ñâîéñòâà îêñîêèñëîò õëîðà óäîáíî îáñóäèòü,
èñïîëüçóÿ äèàãðàììó îêèñëèòåëüíûõ ñîñòîÿíèé
(ðèñ.6) (äèàãðàììû ÂÝ-ÑÎ)(còàíäàðòíûå îêèñëèòåëüíûå
ïîòåíöèàëû Åî äàþòñÿ îòíîñèòåëüíî
ïîòåíöèàëà ïðîöåññà H++= 1/2H2. Ìåòîäèêà ïîñòðîåíèÿ
äèàãðàìì ÂÝ-ÑÎ è èõ èñïîëüçîâàèå îïèñàíû â 4-ì
âûïóñêå ìåòîäè÷åñêîãî ïîñîáèÿ ïî íåîðãàíè÷åñêîé
õèìèè äëÿ ñòóäåíòîâ 1-ãî êóðñà. Ì., ÌÃÓ, 1993, ñ.24-30.),
ïðåäëîæåííóþ Ôðîñòîì (A.Frost. Oxidation Potåntial-Free Energy
Diagrams. J.Am.Chem.Soc. 1951. V.73. P.2680-2682)
Äèàãðàììà îêèñëèòåëüíûõ ñîñòîÿíèé (ÎÑ) õëîðà
(ðèñ.6) ïðåäñòàâëÿåò ãðàôè÷åñêóþ çàâèñèìîñòü
âîëüò-ýêâèâàëåíòàÂÝ = nEo, ãäå Eî
— ñòàíäàðòíûé ïîòåíöèàë (Â), n — êîëè÷åñòâî (â
ìîëÿõ) ýëåêòðîíîâ, ïàðû ÷àñòèö, íàïðèìåð, HClOï 1/2Cl2
, îò ñòåïåíè îêèñëåíèÿ. Âåëè÷èíà nEoïðîïîðöèîíàëüíà
ñòàíäàðòíîé ýíåðãèè Ãèááñà Go
ðåàêöèè ïðåâðàùåíèÿ ÷àñòèö HClO â Cl2 : Go = -nEoF, ãäå F =
96500 êàë/ìîëü — ÷èñëî Ôàðàäåÿ. Èñõîäÿ èç ýòîãî
äèàãðàììó ÂÝ-ÑÎ ìîæíî ðàññìàòðèâàòü êàê
çàâèñèìîñòü ñòàíäàðòíîé ýíåðãèè îáðàçîâàíèÿ fGo ÷àñòèö îò
ñòåïåíè îêèñëåíèÿ. Âåëè÷èíû fGo
ïðåäñòàâëåíû íà ïðàâîé îñè îðäèíàò ðèñ.6.
Òåðìîäèíàìè÷åñêè óñòîé÷èâîé ê
äèñïðîïîðöèîíèðîâàíèþ íà äèàãðàììå
îêèñëèòåëüíûõ ñîñòîÿíèé áóäåò ìîëåêóëà (èîí),
ýíåðãèÿ Ãèááñà êîòîðîé (ïðàâàÿ îðäèíàòà íà ðèñ.6)
ëåæèò íèæå ëèíèè, ñîåäèíÿþùåé ýíåðãèè Ãèááñà
äâóõ ñîñåäíèõ ôîðì. Íàïðèìåð, ïðè ðÍ = 0 õëîð (Cl2)
îêàçûâàåòñÿ òåðìîäèíàìè÷åñêè ñòàáèëüíåå, ÷åì
ñìåñü +HClO. Òåðìîäèíàìè÷åñêè
ýòî îçíà÷àåò, ÷òî ýíåðãèÿ Ãèááñà fG o( C l 2) ìåíüøå,
÷åì ñóììà fG o( C l -) è
fG o( HC l O). Ýòî
ñîîòâåòñòâóåò è èçâåñòíîìó ôàêòó, ÷òî ðàâíîâåñèå
Cl2+H2O H++ + HClO ïðè ðÍ=0 ñìåùåíî âëåâî, òàê êàê Êðàâí.
= 4. 10-9.
Ñðàâíèì òåðìîäèíàìè÷åñêóþ óñòîé÷èâîñòü
îêñîêèñëîò õëîðà ïðè ðÍ=0. Ýòî ýêâèâàëåíòíàÿ
îöåíêà òåðìîäèíàìè÷åñêîé âîçìîæíîñòè
ïðîòåêàíèÿ ïðîöåññîâ
3HClO = HClO3 + 2HCl (1),
3HClO2 = 2HClO3 + HCl (2),
4HClO3 = 3 HClO4 + HCl (3),
èñïîëüçóÿ âåëè÷èíû ñòàíäàðòíûõ ýëåêòðîäíûõ
ïîòåíöèàëîâ, ïðèâåäåííûå â òàáë.7 è íà ñõåìå ðèñ.7.
Ðèñ.7. Ïîòåíöèàëüíàÿ äèàãðàììà (ÑÂ), èëè
äèàãðàììà Ëàòèìåðà (ðÍ=0).
Ðåøåíèå.
Òåðìîäèíàìè÷åñêèì óñëîâèåì ïðîòåêàíèÿ ðåàêöèè
ñ òî÷êè çðåíèÿ òåðìîäèíàìèêè ÿâëÿåòñÿ rG<0, òî åñòü . Äëÿ ðåøåíèÿ çàäà÷è ðàññ÷èòàåì
âåëè÷èíû ðåàêöèé (1)-(3)
; .
Èç äèàãðàìì Ëàòèìåðà (ðèñ.7) ñëåäóåò, ÷òî
Òàêèì îáðàçîì,
Âî âñåõ ñëó÷àÿõ Åî >Î, ñëåäîâàòåëüíî, rGo<Î, à
ñëåäîâàòåëüíî, è êèñëîðîäíûå êèñëîòû õëîðà HClO, HClO2,
HClO3 ïðè ðÍ=0 òåðìîäèíàìè÷åñêè íåñòàáèëüíû è
äèñïðîïîðöèîíèðóþò ïî ðåàêöèÿì (1)-(3). Òàê êàê Å3>Å2>Å1,
òî òåðìîäèíàìè÷åñêàÿ ñòàáèëüíîñòü óìåíüøàåòñÿ â
ðÿäó HClO — HClO2 — HClO3.
Àíàëîãè÷íûì îáðàçîì ìîæíî äîêàçàòü è
âîçìîæíîñòü ïðîòåêàíèÿ ðåàêöèé
5HClO = 2Cl2 + HClO3 +2H2O (4)
7HClO3 = Cl2 + 5HClO4 + H2O (5).
Êðîìå òîãî, ïîòåíöèàë âîññòàíîâëåíèÿ êèñëîðîäà
O2 + 4H+ + 4e = 2H2O (6)
(ïðè ðÍ = 0 è (ñì. ðèñ.6)) ìåíüøå, ÷åì
ïîòåíöèàëû ðåàêöèé (1)-(5), ïîýòîìó âîçìîæíî, ÷òî,
íàïðèìåð, HClO áóäåò îêèñëÿòü âîäó ñ âûäåëåíèåì
êèñëîðîäà ( óðàâíåíèå ðåàêöèè (7) íåòðóäíî
ïîëó÷èòü êîìáèíèðîâàíèåì ðåàêöèé , à ðàñ÷åò åå ïîòåíöèàëà ïðèâåäåí
äàëåå)
HClO = HCl + 1/2O2 (7).
Èç ðèñ.6 ñëåäóåò, ÷òî ïðè ðÍ=0 íàèáîëåå
óñòîé÷èâûìè ôîðìàìè ÿâëÿþòñÿ HClO4 è Cl2,òàê
êàê îíè îêàçûâàþòñÿ êîíå÷íûìè ïðîäóêòàìè âñåõ
ðåàêöèé äèñïðîïîðöèîíèðîâàíèÿ (1-5) â
ðàññìàòðèâàåìîé ñèñòåìå.
 ùåëî÷íîé ñðåäå ïîòåíöèàë è ýíåðãèè Ãèááñà
ïîëóðåàêöèé, âêëþ÷àþùèõ èîíû âîäîðîäà,
óìåíüøàþòñÿ (ðèñ.6). Ñîëè îêñîêèñëîò ïîýòîìó
îêàçûâàþòñÿ ñòàáèëüíåå, ÷åì ñàìè êèñëîòû.
Êîíå÷íûìè ïðîäóêòàìè ðàñïàäà îêàçûâàþòñÿ
õëîðèäû è ïåðõëîðàòû.
Ðàññìîòðèì êèíåòè÷åñêóþ ñòàáèëüíîñòü
îêñîêèñëîò è èõ ñîëåé, òî åñòü ñêîðîñòü ðåàêöèé
(1-5, 7). Îíà îïðåäåëÿåòñÿ òðåìÿ ôàêòîðàìè:
- ðîñòîì ýíåðãèè ñâÿçè Cl-O â ðÿäó HClO -HClO2 ——;
- óâåëè÷åíèåì ýêðàíèðîâàíèÿ àòîìà õëîðà àòîìàìè
êèñëîðîäà, òî åñòü óìåíüøåíèåì åãî äîñòóïíîñòè ê
âçàèìîäåéñòâèþ ñ äðóãèìè àòîìàìè (èëè èõ
ãðóïïèðîâêàìè); - òðóäíîñòüþ çàðîæäåíèÿ ãàçîâîé ôàçû â æèäêîì
ðàñòâîðå.
Ôàêòîðû 1 è 2 ïîâûøàþò ýíåðãèþ àêòèâàöèè è
çàìåäëÿþò ñêîðîñòü ðåàêöèè (1-3) â ðÿäó HClO>HClO2>, òàê ÷òî íàèáîëåå
ìåäëåííîé îêàçûâàåòñÿ ðåàêöèÿ (3). Êèíåòè÷åñêè
íàèáîëåå ëàáèëüíûìè (íåóñòîé÷èâûìè) áóäóò
êèñëîòû HClO è HClO2, à íàèáîëåå
èíåðòíîé — õëîðíîâàòàÿ êèñëîòà HClO3. Â
÷àñòíîñòè, ïîëó÷èòü â ðàñòâîðå õëîðíóþ êèñëîòó HClO4
ïóòåì äèñïðîïîðöèîíèðîâàíèÿ HClO3 íåâîçìîæíî
èìåííî ïî êèíåòè÷åñêèì ïðè÷èíàì. Ôàêòîð 3
ïðèâîäèò ê òîìó, ÷òî ïðîöåññû (4,5,7) îêàçûâàþòñÿ
çàòîðìîæåííûìè, òàê êàê ãåòåðîãåííûå ðåàêöèè,
ñîïðîâîæäàþùèåñÿ âûäåëåíèåì õëîðà è êèñëîðîäà,
ïðîòåêàþò ãîðàçäî ìåäëåííåå, ÷åì ãîìîãåííûå
ðåàêöèè äèñïðîïîðöèîíèðîâàíèÿ.
 öåëîì, âñå îêñîêèñëîòû õëîðà
òåðìîäèíàìè÷åñêè è êèíåòè÷åñêè íåñòàáèëüíû.
Ñîëè îêñîêèñëîò õëîðà, íàîáîðîò,
òåðìîäèíàìè÷åñêè è êèíåòè÷åñêè áîëåå óñòîé÷èâû.
Ýòî ñâÿçàíî ñ òåì, ÷òî òâåðäûå ñîëè ïîñòðîåíû èç
èîíîâ, ýëåêòðîñòàòè÷åñêîå âçàèìîäåéñòâèå
êîòîðûõ ïîâûøàåò ýíåðãèþ êðèñòàëëè÷åñêîé
ðåøåòêè è, ñîîòâåòñòâåííî, ñòàáèëüíîñòü.
9.4. Îêèñëèòåëüíàÿ ñïîñîáíîñòü
îêñîêèñëîò õëîðà.
Îêèñëèòåëüíàÿ ñïîñîáíîñòü îêñîêèñëîò õëîðà
ñâÿçàíà ñ âîçìîæíîñòüþ ïîíèæåíèÿ ñòåïåíè
îêèñëåíèÿ â àíèîíå êèñëîòû HXOn, n =
1,2,3,4. Ñ òåðìîäèíàìè÷åñêîé òî÷êè çðåíèÿ
çàêîíîìåðíîñòè èçìåíåíèÿ îêèñëèòåëüíîé
ñïîñîáíîñòè, êàê è ñòàáèëüíîñòè, îêñîêèñëîò
õëîðà óäîáíî ïðîàíàëèçèðîâàòü ñ ïîìîùüþ
äèàãðàììû îêèñëèòåëüíûõ ñîñòîÿíèé (ðèñ.6) .
1.Âñå oêñîêèñëîòû ÿâëÿþòñÿ ñèëüíûìè
îêèñëèòåëÿìè, î ÷åì ñâèäåòåëüñòâóåò
ïîëîæèòåëüíûé íàêëîí ëèíèé, ñîåäèíÿþùèõ
âîëüò-ýêâèâàëåíòû (ýíåðãèè Ãèááñà) îêèñëåííûõ è
âîññòàíîâëåííûõ ôîðì íà ðèñ.6.
2. Èõ îêèñëèòåëüíàÿ ñïîñîáíîñòü ñîîòâåòñòâóåò
ñëåäóþùåé ïîñëåäîâàòåëüíîñòè: Cl2 <HClO
HClO2 >HClO3 > HClO4,
÷òî îòâå÷àåò íàêëîíàì ëèíèé äëÿ ïàð 1/2. Íàïðèìåð, ðàñòâîð ñîëè NaClO
îêèñëÿåò äî Br2
â êèñëîé, íåéòðàëüíîé è ùåëî÷íîé ñðåäàõ:
NaClO + 2KBr + H2O = NaCl +Br2 +2KOH (â ùåëî÷íîé
ñðåäå ïðîèñõîäèò äàëüíåéøåå îêèñëåíèå Br2
äî ).
C ïîìîùüþ NaClO3 îêèñëÿåòñÿ òîëüêî â êèñëîé ñðåäå:
NaClO3+ 6KBr +3H2SO4 = 3Br2 + NaCl + 3K2SO4
+ 3Í2Î.
3. Ñ óâåëè÷åíèåì ðÍ = -lg[H+] îêèñëèòåëüíàÿ
ñïîñîáíîñòü óìåíüøàåòñÿ. Íàïðèìåð, äëÿ ðåàêöèè
â ñîîòâåòñòâèè ñ óðàâíåíèåì Íåðíñòà
.
âåëè÷èíà ïîòåíöèàëà óìåíüøàåòñÿ îò Åî =
1.02  ïðè ðÍ= 0 äî Åî= +0.37ïðè ðÍ=14.
Òàêèì îáðàçîì, îêèñëèòåëüíàÿ ñïîñîáíîñòü ñîëåé
íèæå, ÷åì ñîîòâåòñòâóþùèõ êèñëîò.
Ñ òî÷êè çðåíèÿ êèíåòèêè äëÿ ñîïîñòàâëåíèÿ
îêèñëèòåëüíîé ñïîñîáíîñòè êèñëîò è îêñîàíèîíîâ
õëîðà íåîáõîäèìî ðàññìîòðåòü îñîáåííîñòè
ìåõàíèçìà ðåàêöèé. Èçìåíåíèå ñòåïåíè îêèñëåíèÿ
ìîæåò ïðîèñõîäèòü äâóìÿ ñïîñîáàìè:
- ïóòåì ïðÿìîãî ïåðåíîñà ýëåêòðîíîâ ìåæäó
ìîëåêóëÿðíûìè îðáèòàëÿìè îêèñëèòåëÿ è
âîññòàíîâèòåëÿ áåç èçìåíåíèé â ñòðîåíèè àíèîíîâ; - ïóòåì ïåðåíîñà îòäåëüíûõ àòîìîâ èëè ãðóïï
àòîìîâ.
Îáà âàðèàíòà îïèñàíèÿ ðàâíîïðàâíû. Ñ òî÷êè
çðåíèÿ ìåòîäà ìîëåêóëÿðíûõ îðáèòàëåé (ÌÌÎ) ïðè
ýòîì âàæåí ôàêò ïåðåõîäà ýëåêòðîíîâ ñ
íåñâÿçûâàþùèõ îðáèòàëåé íà ñâÿçûâàþùèå è
íàîáîðîò ( ñëó÷àå êîìïëåêñíûõ ñîåäèíåíèé
ïåðåõîäíûõ ìåòàëëîâ âîçìîæåí ïåðåõîä ýëåêòðîíîâ
ìåæäó íåñâÿçûâàþùèìè îðáèòàëÿìè) .  ëþáîì ñëó÷àå
äëÿ îñóùåñòâëåíèÿ
îêèñëèòåëüíî-âîññòàíîâèòåëüíîé ðåàêöèè ñíà÷àëà
äîëæåí áûòü óñòàíîâëåí êîíòàêò ìåæäó ÷àñòèöàìè —
êàíàë, ïî êîòîðîìó ìîæåò ïðîèçîéòè ïåðåõîä
ýëåêòðîíîâ îò âîññòàíîâèòåëÿ íà ñâîáîäíûå
ìîëåêóëÿðíûå îðáèòàëè îêèñëèòåëÿ.
 êà÷åñòâå ïðèìåðà ïðèñîåäèíåíèÿ àòîìíîé
ãðóïïèðîâêè, ñîïðîâîæäàþùåãîñÿ ïåðåíîñîì
ýëåêòðîíîâ (ñïîñîá 2), ðàññìîòðèì ìåõàíèçì
îêèñëåíèÿ ñóëüôèò-èîíà
õëîðíîâàòèñòîé êèñëîòîé HClO. Ðåçóëüòàòû (K.D.Fogelman,
D.M.Walker, D.W.Margerum. Inorg.Chem, 1989, V.28, P.986-993) èçó÷åíèÿ
ñêîðîñòè ðåàêöèè ïîêàçûâàþò, ÷òî ïåðâûé
ìåäëåííûé ýòàï — íóêëåîôèëüíîå (Íóêëåîôèëüíûå
(îò ëàòèíñêîãî ñëîâà «íóêëåóñ» — ÿäðî)
÷àñòèöû — ÷àñòèöû ñî ñâîáîäíîé ýëåêòðîííîé ïàðîé,
ñòðåìÿùèåñÿ ê îñòîâó (ÿäðó) äðóãîé ÷àñòèöû,
èìåþùåé ïóñòóþ îðáèòàëü)ïðèñîåäèíåíèå ê àòîìó
õëîðà èîíà , â êîòîðîì
èìåþòñÿ äâà ýëåêòðîíà íà ðàçðûõëÿþùåé îðáèòàëè.
Ïðè ýòîì îáðàçóåòñÿ õëîðîñóëüôàò-èîí:
(1)
 ïðîìåæóòî÷íîì êîìïëåêñå (èíòåðìåäèàòå) õëîð
âûñòóïàåò êàê ìîñòèê ìåæäó HO— è . Âòîðàÿ ñòàäèÿ — ãèäðîëèç
õëîðîñóëüôàòà — ïðîòåêàåò áûñòðî:
(2).
Ñêîðîñòü ðåàêöèè (1) îïðåäåëÿåòñÿ äîñòóïíîñòüþ
àòîìà õëîðà äëÿ íóêëåîôèëüíîé àòàêè. Â ðÿäó Cl2 HClO < HClO2 < HClO3 < HClO4
óâåëè÷èâàåòñÿ ýêðàíèðîâàíèå õëîðà àòîìàìè
êèñëîðîäà, à çíà÷èò, è óìåíüøàåòñÿ ñêîðîñòü
ðåàêöèè, ãäå óêàçàííûå ìîëåêóëû èëè èîíû
âûñòóïàþò êàê îêèñëèòåëè. Ýòî èíòåðåñíûé ôàêò,
ïîñêîëüêó â ðàññìàòðèâàåìîì ðÿäó îêèñëèòåëüíàÿ
ñïîñîáíîñòü óìåíüøàåòñÿ êàê ñ òî÷êè çðåíèÿ
òåðìîäèíàìèêè, òàê è ñ ïîçèöèé êèíåòèêè.
Ñëåäóåò òàêæå îòìåòèòü, ÷òî ñêîðîñòü ðåàêöèé,
â êîòîðûõ îêñîàíèîíû äåéñòâóþò êàê îêèñëèòåëè,
óñêîðÿåòñÿ èîíàìè âîäîðîäà. Ýòî ñâÿçàíî ñ
ïðîòîíèðîâàíèåì àòîìîâ êèñëîðîäà â îêñîàíèîíå è
îñëàáëåíèåì ñâÿçè Cl-O, à òàêæå ñ óâåëè÷åíèåì ýëåêòðîôèëüíîñòè
(ýëåêòðîôèëüíàÿ ÷àñòèöà — ÷àñòèöà ñ ïóñòîé
îðáèòàëüþ, êîòîðàÿñòðåìèòñÿ ê îñòîâó
äðóãîé ÷àñòèöû, èìåþùåé ñâîáîäíóþ ýëåêòðîííóþ
ïàðó) õëîðà ïî îòíîøåíèþ ê âîññòàíîâèòåëþ,
íåñóùåìó ýëåêòðîíû. Äåéñòâèòåëüíî,
êîíöåíòðèðîâàííàÿ HClO4,îñîáåííî
â ñìåñè ñ H2SO4, äåéñòâóåò êàê
ñèëüíûé îêèñëèòåëü è âçðûâàåòñÿ â ïðèñóòñòâèè
ñëåäîâ îðãàíè÷åñêèõ ñîåäèíåíèé (íàïðèìåð, ïðè
ïîïàäàíèè ïûëè).
