В какой массе naoh содержится столько же
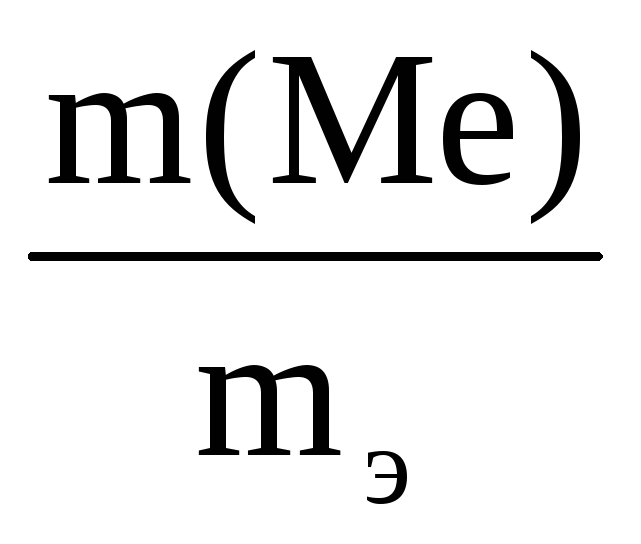
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr. Решение
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН. Решение с ключом
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Решение с ключом
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Решение с ключом
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. Решение с ключом
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Решение
7. Выразите в молях: а) 6,02·1022 молекул C2H2; б) 1,80·1024 атомов азота; в) 3,01·1023 молекул NH3. Какова мольная масса указанных веществ? Решение
8. Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. Решение
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла? Решение с ключом
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла. Решение с ключом
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида, вычислите эквивалентную массу этого металла. Решение
12. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций. Решение с ключом
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы. Решение
14. В каком количестве Сr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Решение
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы. Решение с ключом
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? Решение с ключом
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла. Решение с ключом
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Решение с ключом
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Решение с ключом
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании, расчета напишите уравнение реакции. Решение
Правила расчета эквивалентного числа в конкретных ситуациях.
1. Для кислот эквивалентное число равно числу замещаемых в конкретной реакции ионов водорода, а для оснований — числу замещаемых гидроксид-ионов.
Пример:
;
2. Эквивалентное число соли равно произведению количества замещаемых катионов металла на их заряд или произведению числа замещаемых анионов кислотных остатков на модуль их заряда.
Пример:
;
3. Эквивалентное число оксида равно произведению числа атомов элемента на валентность элемента.
Пример: .
4. Эквивалентное число в окислительно-восстановительных реакциях определяется числом электронов, которые отдает или принимает частица восстановителя или окислителя.
Пример:
1 2
3 6
; ; ; .
Количество вещества — это число структурных элементов (атомов, молекул, ионов, эквивалентов) в системе. Единицей измерения количества вещества является моль.
Моль — количество вещества системы, которое содержит столько структурных элементов (молекул, эквивалентов и др.), сколько атомов содержится в 0,012 кг изотопа углерода 12.
Число структурных единиц в моле называют числом Авогадро и для практических расчетов принимают равным 6,02 · 1023.
Массу одного моля вещества называют молярной массой М. Численно молярная масса равна молекулярной, но измеряется в г/моль. Например, молярная масса аммиака:
Молярную массу эквивалентов вещества В (в г/моль) можно рассчитать, исходя из молярной массы вещества, по формуле:
Количество вещества эквивалентов (в моль) находят отношением массы вещества к молярной массе его эквивалента:
Количественные соотношения между эквивалентами веществ, участвующих в химической реакции, задаются законом эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Согласно этому закону для реакции А + B = C + D должно выполняться соотношение:
,
где – количество молей эквивалентов соответствующего вещества.
Таким образом, для взаимодействующих веществ А и В можно записать:
или подставив значение , получим
; .
Пример 1. Определите молярную массу эквивалентов .
Решение: — средняя соль.
(число катионов кальция) ∙ 2(заряд катиона) = 2
.
Ответ: Молярная масса эквивалентов равна 50 г/моль.
Пример 2. Вычислите молярную массу эквивалентов магния, если 60 г его вытеснили из кислоты 56 л водорода (н. у.).
Решение:
По закону эквивалентов: .
Выразив количество молей эквивалентов магния через массу магния, а количество молей эквивалентов газообразного водорода через объем газа, получаем выражение:
Преобразуем выражение ;
Число эквивалентности ;
Ответ: Молярная масса эквивалентов магния равна 12 г/моль.
Пример 3. При окислении щелочно-земельного металла массой 5г образуется оксид массой 7 г. Назовите этот металл.
Решение:
По закону эквивалентов:
, ; ;
обозначим ; решив уравнение, получаем ; для двухвалентного щелочно-земельного металла Z(Ме)=2; г/моль
Ответ: Определяемый металл – кальций.
Контрольные вопросы
1. Определите молярные массы эквивалентов и в следующих реакциях:
а)
б)
в)
г)
2. Сколько молей эквивалентов содержится в а) 24,5 г ;
б) 12,3 г ; в) 150 г ; г) 8,6 г ; д) 79 г
3. Рассчитайте молярную массу эквивалентов кислоты, если на нейтрализацию 0,009 кг ее израсходовано 0,008 кг гидроксида натрия.
4. Определите молярную массу двухвалентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
5. На нейтрализацию 0,471 г фосфористой кислоты израсходовано
0,644 г КОН. Вычислите молярную массу эквивалентов кислоты.
6. Определите молярную массу эквивалентов следующих соединений:
7. При нагревании 20,06 г металла было получено 21,66 г его оксида. Найдите молярную массу эквивалентов металла, если молярная масса эквивалентов кислорода равна 8 г/моль.
8. Вычислите молярную массу эквивалентов цинка, если 1,196 г этого металла вытеснили из кислоты 438 мл водорода, измеренного при 17 °С и давлении 1 атм.
9. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить молярную массу эквивалентов металла и объем выделившегося водорода (н. у.).
10. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить молярные массы эквивалентов металла и его оксида.
11. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21,0 г магния, число эквивалентности которого равно 2?
12. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определить молярную массу эквивалентов кислоты.
13. В каком количестве NaOH содержится столько же молей эквивалентов, сколько в 140 г КОН?
14. В каком количестве содержится столько же молей эквивалентов, сколько в 156 г ?
15. 0,493 г хлорида некоторого металла после обработки нитратом серебра образовали 0,861 г AgCl. Вычислить молярную массу эквивалентов металла.
16. Из 0,432 г металла образовали 0,574 г его хлорида. Вычислить молярную массу эквивалентов металла, приняв молярную массу эквивалентов хлора равной 35,5 г/моль.
mэ(KOH)
= М(KOH)/кислотность
= 56/1 = 56 г/моль.
Эквивалентную
массы кислоты определим исходя из закона
эквивалентов: m(KOH)/m(кислоты)
=mэ(KOH)/mэ(кислоты)
![]() =
=
![]()
![]() =
=
![]() = 49 г/моль
= 49 г/моль
Пример 4.
Определите
массу металла, вступившего в реакцию с
кислотой, если при этом выделился водород
объёмом 260 мл при нормальных условиях.
Эквивалентная масса металла mэ(Ме)
= 9 г/моль.
Решение.
Согласно
закону эквивалентов массы (объёмы)
реагирующих друг с другом веществ
пропорциональны их эквивалентным массам
(объёмам).
![]() =
=![]() ,
,
где VЭ(H2)
– эквивалентный объём водорода равный
11,2 л.
m(Me)
=
![]()
= 90,26/11,2
= 0,2 г.
Пример 5.
Эквивалентная
масса металла составляет 63,5 г/моль.
Вычислите массовую долю металла
(Ме) в его оксиде.
Решение.
Массовая
доля кислорода в оксиде металла будет
равна
100 −
(Ме). Согласно закону эквивалентов:
![]() .
.
Эквивалентная
масса кислорода mэ(О)
= 16/2 = 8 г/моль.
Из уравнения
выразим массовую долю металла
![]() =
=
![]()
8(Ме)
= 6350 – 63,5 (Ме)
71,5(Ме)
= 6350
(Ме) =
![]() =
=
88,8 %
Пример 6. Из
3,85 г нитрата металла получено 1,60 г его
гидроксида. Вычислите эквивалентную
массу металла.
Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Эквивалент
(эквивалентная масса) гидроксида равен
сумме эквивалентов (эквивалентных масс)
металла и гидроксильной группы.
Эквивалент
(эквивалентная масса) соли равен сумме
эквивалентов (эквивалентных масс)
металла и кислотного остатка.
Согласно закону
эквивалентов:
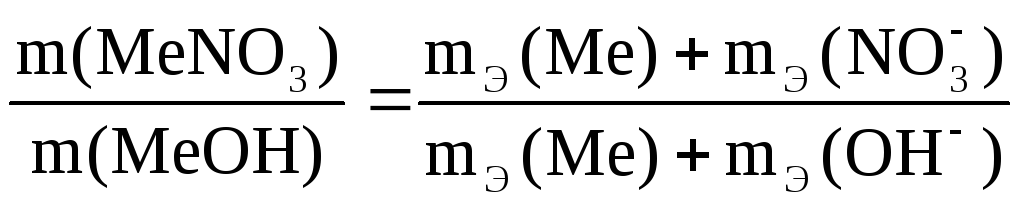
![]()
![]()
![]()
![]()
Вариант 1
Определите
эквивалентную массу металла в следующих
соединениях: Mn2O7,
Ba(OH)2,
Ca3(PO4)2,
FeSO47H2O.При восстановлении
водородом 1,34 г оксида металла до металла
образовалось 0,324 г воды. Определите
эквивалентную массу металла.Алюминий массой
0,752 г при взаимодействии с кислотой
вытеснил водород объёмом 0,936 л (н.у.).
Определите эквивалентную массу алюминия.
Вариант 2
Вычислите
эквивалентную массу гидроксида
висмута(III)
в реакциях взаимодействия с HCl
при получении хлорида висмута и
гидрохлорида висмута.Элемент образует
гидрид, где его массовая доля 75 %.
Определите эквивалентную массу элемента.При растворении
в кислоте металла массой 11,9 г выделился
водород объёмом 2,24 л (н.у.). Определите
эквивалентную массу металла.
Вариант 3
Чему равна
эквивалентная масса ZnSO4
в реакциях со щелочью, идущих с
образованием Zn(OH)2,
(ZnOH)2SO4,
Na2[Zn(OH)4].Для растворения
металла массой 16,86 г потребовалась
серная кислота массой 14,7 г. Вычислите
эквивалентную массу металла.На сжигание 0,5 г
двухвалентного металла требуется 0,23
л кислорода (н.у.). Определите эквивалентную
массу металла, укажите какой это металл.
Вариант 4
Определите
эквивалент и эквивалентную массу серы
в следующих соединениях: H2S,
SO2,
H2SO4.Металл массой
0,150 г вытесняет из раствора никелевой
соли никель массой 0,367 г, а из раствора
кислоты – водород объёмом 140 мл (н.у.).
Определите эквивалентную массу никеля.Оксид марганца
содержит 22,56 % кислорода. Вычислите
эквивалентную массу марганца в оксиде
и составьте его формулу.
Вариант 5
Эквивалентная
масса некоторого элемента равна 24,99
г/моль. Вычислите: а) массовую долю
кислорода в оксиде этого элемента;
б) объём водорода, который потребуется
для восстановления 4,95 г его кислородного
соединения.Вычислите
эквивалентную массу H3PO4
в реакциях взаимодействия с КОН при
получения: а) фосфата калия; б)
дигидрофосфата калия; в) гидрофосфата
калия.На нейтрализацию
1 г основания израсходовано 2,14 г соляной
кислоты. Определите эквивалентную
массу основания.
Вариант 6
Мышьяк образует
два оксида, массовая доля мышьяка в
которых соответственно равна 65,2 и 75,7
%. Рассчитайте эквивалентную массу
мышьяка в этих оксидах.Найдите эквивалентную
массу воды при реакции её а) с металлическим
натрием; б) с оксидом натрия.Вычислите
эквивалентную массу цинка, если 1,168 г
его вытеснили из кислоты 43,8 мл водорода,
измеренного при н.у.
Вариант 7
На нейтрализацию
0,943 г фосфористой кислоты H3PO4
израсходовано 1,291 г гидроксида калия.
Вычислите эквивалентную массу кислоты
и её основность.Вычислите эквивалент
и эквивалентную массу хлорида алюминия
в реакциях:
а)
AlCl3
+
2NaOH = Al(OH)2Cl
+ 2NaCl;
б)
AlCl3
+ 3NaOH = Al(OH)3
+ 3 NaCl.
3. Чему равна
эквивалентная масса металла, если его
навеска массой 20 г вытесняет из кислоты
водород объемом 7,01 л при н.у.
Вариант 8
На осаждение
хлорида, содержащегося в 0,666 г соли,
израсходовано 1,088 г. Вычислите
эквивалентную массу соли.
2. Определите
эквивалент и эквивалентную массу
гидроксида никеля в реакциях:
а)
Ni(OH)2
+ H2SO4
= NiSO4
+ 2H2O;
б)
2Ni(OH)2
+ H2SO4
=
(NiOH)2SO4
+ 2H2O.
3. Эквивалентная
масса металла равна 29,36 г/моль. Сколько
граммов этого металла необходимо для
вытеснения 105 мл водорода (н.у.) из кислоты?
Вариант 9
Определите
эквивалентную массу двухвалентного
металла, если из 48,15 г его оксида можно
получить 88,65 г его нитрата. Укажите,
какой это металл.Вычислите
эквивалентную массу металла в следующих
соединениях: Ag2O,
Al2(SO4)318H2O,
CuCl.Сколько эквивалентных
масс кислорода содержится в 33,6 л его
(н.у.)?
Вариант 10
Массовые доли
галогена в галогениде металла
соответственно равны 64,5 и 15,4 %. Определите
эквивалентную массу металла, массу
металла и объём выделившегося водорода
(н.у.).Для растворения
16,8 г металла потребовалось 14,7 г серной
кислоты. Определите эквивалентную
массу металла и объём выделившегося
водорода (н.у.).В каком количестве
Cr(OH)3
содержится столько же эквивалентов,
сколько в 174,96 г Mg(OH)2?
Вариант 11
Определите
эквивалент и эквивалентную массу
фосфора, кислорода и брома в соединениях
PH3,
H2O,
HBr.При пропускании
H2S
через раствор, содержащий 2,98 г хлорида
некоторого одновалентного металла,
образуется 2,2 г его сульфида. Вычислите
эквивалентную массу металла.Сколько металла,
эквивалентная масса которого 12,16 г/моль,
взаимодействует с 310 см3
кислорода (н.у.).
Вариант12
В состав оксида
серебра входит 93,09 % серебра, а в состав
иодида серебра – 45,95 % серебра. Найдите
эквивалентную массу йода.В какой массе
гидроксида натрия содержится столько
же эквивалентных масс, сколько содержится
в 140 г КОН.На сжигания 1,5 г
двухвалентного металла требуется 0,69
л кислорода (н.у.). Вычислите эквивалентную
массу и атомную массу этого металла.
Вариант 13
Напишите уравнения
реакций Fe(OH)3
с соляной кислотой, при которых
образуется: а) хлорид дигидроксожелеза;
б) хлорид железа (III).
Вычислите эквивалент и эквивалентную
массу Fe(OH)3
в этих реакциях.Определите
эквивалентную массу серы, если 6,48 г
металла образует 6,96 г оксида и 7,44 г
сульфида.При взаимодействии
3,24 г трёхвалентного металла с кислотой
выделяются 4,03 л водорода (н.у.). Вычислите
эквивалентную и атомную массы металла.
Вариант 14
Из 1,35 г оксида
металла получается 3,15 г его нитрата.
Вычислите эквивалентную массу этого
металла.Избытком соляной
кислоты подействовали на растворы: а)
гидрокарбоната кальция; б) дихлорида
гидроксоалюминия. Напишите уравнения
реакций этих веществ с HCl
и определите их эквивалентные массы.Сколько граммов
металла, эквивалентная масса которого
12 г/моль, взаимодействует с 3,1 л кислорода
(н.у.).
Вариант 15
4,086г металла
вытесняют из кислоты 1,4 л водорода,
измеренного при н.у. Эта же масса металла
вытесняет 12,95 г свинца из растворов его
солей. Вычислите эквивалентную массу
свинца.Вычислите эквивалент
и эквивалентную массу бора, хрома и
кальция в соединениях: B2O3;
Cr(OH)3;
Ca3(PO4)2.Сколько эквивалентных
масс содержится в 340 г нитрата серебра?
Вариант 16
При восстановлении
4,34 г оксида марганца алюминием получено
3,4 г оксида алюминия Al2O3.
Вычислите эквивалентную массу марганца,
его валентность и составьте формулу
оксида марганца.При окислении
0,24 г металла израсходовано 112 мл кислорода
(н.у.). Определите эквивалентные массы
металла и его оксида.Эквивалентная
масса элемента составляет 24,99 г/моль.
Вычислите, сколько граммов водорода
требуется для восстановления 4,95 г его
соли.
Вариант 17
Эквивалентная
масса металла равна 56,2 г/моль. Вычислите
процентное содержание этого металла
в его оксиде.
2. Определите
эквивалент и эквивалентную массу
гидроксида алюминия в реакциях:
а)
Al(OH)3
+ HNO3
= AlOH(NO3)2
+ H2O;
б)
Al(OH)3
+ 3HNO3
= Al(NO3)3
+ 3H2O.
3. Одна и та же
масса металла соединяется с 1,591 г галогена
и с 70,2 мл кислорода (н.у.). Вычислите
эквивалент галогена.
Вариант 18
На восстановление
2,33 г хлорида циркония до свободного
израсходовано 0,48 г магния. Эквивалентная
масса магния равна 12 г/моль. Определите
эквивалент циркония и его валентность.Вычислите
эквивалентную массу KHSO4
в следующих реакциях:
а)
KHSO4
+ BaCl2
= BaSO4
+ KCl + HCl;
б)
KHSO4
+ KOH = K2SO4
+ H2O.
3. Элемент образует
оксид, содержащий 31,58 % кислорода.
Вычислите эквивалент элемента.
Вариант 19
Определите
эквивалентные массы следующих кислот:
HClO;
H2SiO3;
HMnO4;
H2SnO3.Вещество содержит
39 % серы, эквивалентная масса которой
16 г/моль и мышьяк. Вычислите эквивалентную
массу и валентность мышьяка, составьте
формулу этого вещества.1 г металла
соединяется с массой хлора, занимающей
объём 336 мл (н.у.). Вычислите эквивалент
металла.
Вариант 20
При сгорании серы
в кислороде образовалось 12,8 г SO2.
Сколько эквивалентов кислорода требуется
на эту реакцию. Чему равны эквиваленты
серы и её оксида.Определите
эквивалентную массу H2SO3
в реакциях образования: а) сульфита
лития; б) гидросульфита лития.0,934 г металла
вытеснили из соляной кислоты 348 мл
водорода (н.у.). Вычислите эквивалент
металла.
Вариант 21
Путём разложения
нагреванием 0,26 г оксида серебра получено
0,243 г металлического серебра. Определите
эквивалентную массу серебра.Вычислите
эквивалентную массу гидроксида меди(II)
в реакциях взаимодействия с HCl
при получении а) хлорида меди; б)
гидроксохлорида меди.Эквивалент металла
равен 8,99. Какой объём водорода (н.у.)
выделится при взаимодействии 0,4495 г
металла с соляной кислотой.
Вариант 22
При взаимодействии
ортофосфорной кислоты со щелочью
образовалось соль Na2HPO4.
Найти для этой реакции эквивалентную
массу ортофосфорной кислоты.В состав метана
входит 25 % водорода и 75 % углерода. Чему
равна эквивалентная масса углерода.Вычислите эквивалент
металла и его оксида, зная, что 0,304 г
металла вытесняет из кислоты 0,282л
кислорода (н.у.).
Вариант 23
Определите
эквивалентную массу гидроксида магния
в реакциях:
а)
Mg(OH)2
+ HBr = MgOHBr +H2O;
б)
Mg(OH)2
+ 2HBr = MgBr2
+ 2 H2O.
2. При восстановлении
1,506 г оксида олова водородом образовалось
0,36 г воды. Определите эквивалентную
массу олова и его валентность. Напишите
формулу оксида олова.
3. Какой объём
водорода (н.у.) выделится при взаимодействии
3,6 г металла с кислотой, эквивалентная
масса которого равна 12 г/моль?
Вариант 24
Определите
эквивалентные массы следующих солей:
NaNO2,
Cr2(SO4)3,
CH3COOH,
MgOHNO3,
LiHSO4.Эквивалентная
масса металла равна 56,2 г/моль. Вычислите
процентное содержание этого металла
в его оксиде.При взаимодействии
3,182 г галогена израсходовано 140,4 мл
кислорода (н.у.). Вычислите эквивалент
галогена и назовите его.
Вариант 25
Эквивалентная
масса металла равна 29,36 г/моль. Сколько
граммов этого металла необходимо для
вытеснения 105 мл водорода (н.у.)?Определите
эквивалент фосфора в соединениях: PH3,
P2O5,
P2O3,
H3PO3.Одна и та же масса
металла соединяется с 1,591 г галогена и
70,2 см3
кислорода при н.у. Вычислите эквивалентную
массу галогена.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
