В каких витаминах содержится бром

Этот неметалл был обнаружен французским исследователем А.Ж. Баларом, когда тот изучал состав рассолов средиземноморской воды на соляных промыслах.
Им была выделена жидкость красновато-бурого цвета, отличительной особенностью которой был отвратительный запах.
Кстати, именно благодаря своему свойству раздражать обоняние человека, бром и был назван именно так. В переводе с греческого языка это слово значит «вонючий», «зловонный».
Да, как ни удивительно, но наш организм содержит эту, мягко скажем, дурно пахнущую жидкость, причем в довольно ощутимых объемах. Так, в теле взрослого человека может присутствовать до 300 мг брома, при этом в крови – до 10 мг на литр.
К содержанию
Где спрятан бром внутри нас?
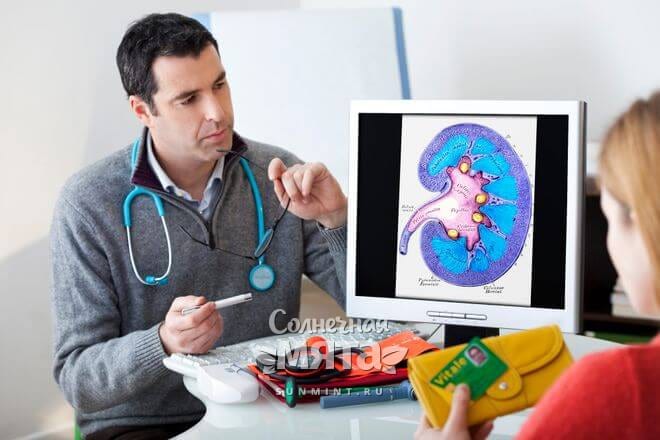 Бром скапливается в почках и щитовидной железе.
Бром скапливается в почках и щитовидной железе.
Преимущественно он концентрируется в таких органах, как почки, щитовидная железа, гипофиз, а также в крови, в мышцах и в костной ткани. Очень важно регулярно пополнять запасы данного микроэлемента, так как он в своем естественном виде без труда выводится из тела с мочеиспусканием и потоотделением.
Конечно, самые лучшие источники любых питательных веществ – это свежая растительная пища, ведь природа уже позаботилась обо всем наилучшим образом. И бром в продуктах в данном случае не является исключением.
К содержанию
Какие продукты содержат бром?
 Водоросли — один из натуральных источников брома.
Водоросли — один из натуральных источников брома.
Этот минерал широко распространен в природе – в морской воде, в соляных озерах, в подземных источниках, в горных породах и даже в атмосфере, а потому некоторым растениям не составляет особого труда накапливать его.
Вот почему продукты, богатые бромом, в основном имеют растительное происхождение. Из злаков выделяют пшеницу и ячмень. Я бы посоветовала вам приобретать не магазинные каши, которые в большинстве своем лишены ценной оболочки, а цельные зерна указанных растений.
Просто замочите горсть пшеницы или ячменя на ночь в чистой воде, утром промойте зерна проточной водой и оставьте без жидкости до вечера – на ужин вы получите проростки, полезные свойства которых известны всем. В них будет не только природный бром, но и целый комплекс витаминов и минералов, сбалансированный самой природой.
 Проростки также содержат большое количество брома.
Проростки также содержат большое количество брома.
Можно оставлять ростки длиной 1-2 мм, а можно выращивать из указанных злаков зелень, чтобы затем добавлять ее в коктейли и салаты. Тем более, интересующий нас минерал имеет свойство концентрироваться именно в зеленой части растений. А наши нехитрые действия улучшают усвоение брома.
Способны накапливать это вещество и бобовые – чечевица, фасоль, горох, арахис. Продукты, в которых содержится бром: орехи, особенно грецкие, а также миндаль и фундук, приобретенные в скорлупе. Кстати, орешки, как и злаки, тоже нужно есть размоченными в воде.
Это особенно актуально в том случае, если они не являются свежим урожаем, а хранились довольно длительное время. Вода разрушает защитные ингибиторы орехов и высвобождает кладезь «полезностей» для нашего организма.
Выше я озвучила природное местонахождение брома, так что, вполне логично, что мы можем получать этот микроэлемент из морских водорослей, а также из натуральной морской или неочищенной каменной соли. Это естественные источники брома.
Примечательно, что люди, живущие у моря, ежедневно пополняют свои запасы этого минерала во время прогулок по пляжу или по набережной, просто вдыхая морской воздух.
Как видите, бром в питании – явление не такое уж и редкое. Уверена, в ежедневном меню сыроеда или вегетарианца содержится достаточное количество данного вещества.
К содержанию
Для чего нужен бром нашему организму?
 Павлов Иван Петрович
Павлов Иван Петрович
О том, что бром для здоровья нам необходим, говорил еще знаменитый русский физиолог Иван Петрович Павлов. Он утверждал, что с помощью этого уникального вещества, или, как его называл сам ученый, «бесценного препарата», можно эффективно лечить расстройства ЦНС.
Действительно, соли данного минерала – бромиды, попадая в наш организм, оказывают седативное воздействие на центральную нервную систему, несколько затормаживая ее работу.
Однако в этом месте я считаю нужным подчеркнуть, что сам Павлов говорил о сверхмалых дозах брома и о его строго индивидуальном расчете, который зависел от природных данных больного и от его текущего состояния.
В своем натуральном виде, то есть бром в еде, также способен успокаивать нервную систему и снимать возбужденные состояния.
Одним из ярчайших симптомов нехватки брома является повышенная раздражительность.
К содержанию
Для чего полезен бром в организме человека?
- Оказывает на весь организм успокаивающее и снотворное воздействие, а также обладает противосудорожным эффектом.
- Благотворно влияет на поджелудочную железу – повышает активность важнейших ферментов, таких, как: пепсин, липаза, амилаза, что повышает качество процесса пищеварения и способствует хорошему усвоению жиров и углеводов.
- Нормализует уровень кислотности желудочного сока, а потому нередко используется в лечении заболеваний данного органа – например, при язвах.
Некоторое время назад считалось, что действие брома на мужской организм способно уменьшать половое влечение. Его даже планировали использовать в армии для коррекции возбудимости у военнослужащих. Хорошо, что сторонники необоснованной теории не успели этого сделать.
 Бром для солдата как валерьянка для кота.
Бром для солдата как валерьянка для кота.
Исследователи опровергли указанные ошибочные утверждения – функции брома не имеют отношения к мужской потенции, а, как я уже отметила выше, просто погружают весь организм в состояние покоя и сонливости. Таким образом, солдаты избежали рассеянности, которое может быть очень опасным для службы в армии.
Более того, препараты на основе брома не следует принимать тем людям, чья работа связана с повышенной концентрацией внимания – работникам производства, монтажникам-высотникам, водителям транспортных средств.
К содержанию
Чем вреден бром?
 Если что не так с бромом — отвечать щитовидке.
Если что не так с бромом — отвечать щитовидке.
Хочу акцентировать ваше внимание еще на одной особенности данного минерала. Дело в том, что он является антагонистом йода – то есть, веществом, которое препятствует его усвоению. Бром конкурирует с ним за рецепторы и сдерживает захват йода в щитовидной железе, что, в свою очередь, угнетает ее деятельность.
Казалось бы, в случае гиперфункции данного органа, это вроде бы и неплохо, однако такой механизм в итоге может спровоцировать развитие гипотериоза, то есть, стойкого недостатка гормонов «щитовидки».
При избытке гормонов этой железы существует другая опасность – увеличение ее в размерах с целью захватить-таки как можно больше йода. Это заболевание называется «эндемический зоб». Регулярное поступление брома в организм считается профилактикой данного недуга. Но чем выше уровень брома, тем меньше йода, а, значит, щитовидная железа все же разрастается.
Более того, вытеснение йода из организма чревато развитием онкологических и аутоиммунных заболеваний. Вот почему так важно регулировать количество брома, поступающего в наш организм извне.
К содержанию
Может ли быть полезным токсичное вещество?
 Раздражены? Бром вас успокоит.
Раздражены? Бром вас успокоит.
В самом начале статьи я озвучила некое противоречие: «Бром нам необходим для жизни, но он токсичен». Так и есть! Вот только следует различать формы данного вещества.
Все полезные свойства брома присущи тому его виду, который содержится в пище и в морской воде, то есть, в его естественных источниках. И именно в такой природной форме лучше всего употреблять данный минерал при беременности.
В медицинской практике это вещество применяют при неврологических расстройствах, при повышенной раздражительности, истериках, бессоннице, эпилептических припадках, а также в случаях нервного перенапряжения.
Имейте в виду, что здесь речь идет не о чистом броме, а слабых растворах его солей (бромида натрия или калия). Именно об аптечном препарате говорил Иван Павлов и именно эти вещества в крошечных концентрациях используется в медицине. Их суточная норма должна быть строго рассчитана – как я уже говорила, с учетом физиологических особенностей пациента.
Выделенный чистый или элементарный бром – сильнодействующий яд, высокотоксичное вещество, которое нельзя применять в качестве лекарства.
Однако потребность в данном минерале никто не отменял, ведь дефицит брома может иметь негативные последствия – такие, как:
- ухудшение качества желудочного сока;
- понижение гемоглобина в крови;
- отсутствие сна;
- чрезмерная раздражительность;
- повышенная возбудимость нервной системы.
Суточная потребность в броме для взрослых мужчин и женщин — примерно 0,5–1 г. Если превысить указанную дозу, то можно нажить серьезные проблемы со здоровьем, ведь избыток брома в организме гораздо опаснее, чем его недостаток.
Он выражается следующими симптомами:
- тошнотой и рвотой;
- головокружениями;
- кожными высыпаниями;
- раздражением слизистых оболочек;
- носовыми кровотечениями;
- расстройством пищеварения;
- диареей;
- проблемами с речью;
- нервными расстройствами;
- ухудшением памяти;
- кашлем и спазмами органов дыхания.
К содержанию
Как уменьшить вредные свойства токсичного брома?
 Работать на токсичном производстве — это так романтично! ????
Работать на токсичном производстве — это так романтично! ????
На вредном производстве при непосредственном контакте с бромом важно соблюдать технику безопасности – использовать специальную одежду, защитные перчатки и противогаз.
Опасной для здоровья дозой данного вещества являются 14 мг на кг массы тела.
Однако не стоит думать, что, если вы работаете в офисе или даже занимаетесь фрилансом дома, то отравление бромом вам не грозит. Современный мир, в котором доминирует все искусственное, таит в себе множество опасностей. Это токсичное вещество может встретиться вам:
- в бассейне – в качестве компонента дезинфицирующего средства;
- в компьютере – он входит в состав пластмассы;
- в еде, обработанной пестицидами в виде бромистого метила;
- в безалкогольных напитках промышленного производства с «цитрусовым» вкусом и ароматом;
- в аптечных спреях для носа и обезболивающих средствах;
- в собственном доме и на рабочем месте – в коврах, мягкой мебели, тканях в составе антипренов (противопожарных средств).
При этом вовсе не обязательно бросать цивилизацию и уходить жить в глушь, хотя именно об этом мечтают многие осознанные люди, в том числе и сыроеды.
В ваших силах минимизировать вредное воздействие брома на свое здоровье. Скажем, от мебели, штор и компьютера вы вряд ли сможете отказаться, а вот прекратить пить вредную газировку и употреблять чудеса фармацевтической продукции вы вполне можете.
Также можно вымачивать продукты, содержащие пестициды, в подсоленной воде, чтобы уменьшить их вред.
А что делаете вы, чтобы сбалансировать поступление брома в свой организм?
У этого термина существуют и другие значения, см. Бром (значения).
У этого термина существуют и другие значения, см. Br.
| Бром | ||||
|---|---|---|---|---|
| ← Селен | Криптон → | ||||
| ||||
| Красно-бурая жидкость с сильным неприятным «тяжёлым» запахом | ||||
| Название, символ, номер | Бром / Bromum (Br), 35 | |||
| Атомная масса (молярная масса) | [79,901; 79,907][комм 1][1]. а. е. м. (г/моль) | |||
| Электронная конфигурация | [Ar] 3d10 4s2 4p5 | |||
| Ковалентный радиус | 114 пм | |||
| Радиус иона | (+5e)47 (-1e)196 пм | |||
| Электроотрицательность | 2,96 (шкала Полинга) | |||
| Электродный потенциал | ||||
| Степени окисления | +7, +5, +3, +1, 0, −1 | |||
| Энергия ионизации (первый электрон) | 1142,0 (11,84) кДж/моль (эВ) | |||
| Плотность (при н. у.) | 3,102 (25 °C) г/см³ | |||
| Температура плавления | 265,9 К (−7,25 °C) | |||
| Температура кипения | 331,9 К (58,6 °C) | |||
| Уд. теплота плавления | (Br—Br) 10,57 кДж/моль | |||
| Уд. теплота испарения | (Br—Br) 29,56 кДж/моль | |||
| Молярная теплоёмкость | 75,69[2] Дж/(K·моль) | |||
| Молярный объём | 23,5 см³/моль | |||
| Структура решётки | орторомбическая | |||
| Параметры решётки | a = 6,67, b = 4,48, c = 8,72 Å | |||
| Теплопроводность | (300 K) 0,005 Вт/(м·К) | |||
| Номер CAS | 7726-95-6 | |||
Бром (от др.-греч. βρῶμος — «зловонный», «вонючий») — химический элемент с атомным номером 35[3]. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 79,901…79,907 а. е. м.[1] [комм 1]. Обозначается символом Br (от лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях является тяжёлой едкой жидкостью красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно иода и хлора. Летуч, ядовит. Молекула брома двухатомна (формула Br2).
История[править | править код]
Бром был независимо открыт[4] двумя химиками: Карлом Якобом Лёвихом[en] (нем. Carl Jacob Löwig) в 1825 году[5], и Антуаном Жеромом Баларом в 1826 году[6]. Открытие Балара, молодого преподавателя колледжа города Монпелье, сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что, огорчённый тем, что в открытии брома никому не известный Антуан Балар опередил самого Юстуса фон Либиха, последний воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это утверждение неточно: фраза принадлежала не фон Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия[править | править код]
Название элемента происходит от др.-греч. βρῶμος — «дурной запах, зловоние»[7].
Нахождение в природе[править | править код]
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br)[8]. Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома не может надёжно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде солёных озёр, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
- морская вода (65 мг/л[9]),
- рассолы соляных озёр,
- щёлок калийных производств,
- подземные воды нефтяных и газовых месторождений.
Получение[править | править код]
Бром получают химическим путём из природных рассолов и других растворов, содержащих ион Br−, окисляя его газообразным хлором:
Затем молекулярный бром выделяют из раствора потоком водяного пара или воздуха и конденсируют[10].
Физические свойства[править | править код]
При обычных условиях бром — красно-бурая летучая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. Плотность при 0 °C — 3,19 г/см³. Температура плавления брома равна −7,2 °C. Температура кипения составляет +58,6 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br2/Br− в водном растворе равен +1,065 В.
Твёрдый бром образует молекулярные (состоящие из молекул Br2)[10] кристаллы ромбической сингонии, параметры ячейки a = 0,667 нм, b = 0,448 нм, c = 0,872 нм.
Изотопы[править | править код]
Природный бром состоит из двух стабильных изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства[править | править код]
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г на 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром. Реакция протекает при кипении:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF, BrF3 и BrF5, с хлором — BrCl, с иодом — IBr и IBr3, получен также бромид астата AtBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3[11]:
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Реагирует с родановодородом:
Бромсодержащие кислоты[править | править код]
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение[править | править код]
В химии[править | править код]
- Вещества на основе брома широко применяются в органическом синтезе.
- «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
Промышленное применение[править | править код]
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя.
Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
- Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
- Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
- Растворы бромидов используются в нефтедобыче.
- Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации.
- Многие броморганические соединения применяются как инсектициды и пестициды.
В медицине[править | править код]
- В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия[править | править код]
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие[править | править код]
Бром и его пары сильно токсичны. Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, носовые кровотечения, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома — 0,5 мг/м³ в соответствии с ГОСТ 12.1.005-88. ЛД50 при пероральном введении для крыс составляет 2600 мг/кг, для морских свинок 5500 мг/кг[12]. Для человека смертельная доза перорально составляет 14 мг/кг[13]. При вдыхании паров брома половинная летальная концентрация для мышей составляет 750 ppm (9 минут) и 240 ppm (2 часа)[12]. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух (в как можно более ранней стадии показаны ингаляции кислорода); для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Рекомендуются ингаляции тиосульфата натрия в виде 2 % водного раствора, обильное питьё теплого молока с минеральной водой или содой, кофе. Особенно опасно отравление парами брома людей, страдающих астмой и заболеваниями лёгких, так как при вдыхании паров брома очень высока вероятность отёка лёгких. Жидкий бром при попадании на кожу вызывает болезненные и долго не заживающие ожоги.
Биологическое значение[править | править код]
В 2014 году исследование показало, что бром (в форме бромид-иона) является необходимым кофактором в ходе биосинтеза коллагена IV, делая элемент существенным в архитектуре базальной мембраны и развитии тканей у животных[14]. Тем не менее, не было отмечено никаких чётких симптомов или синдромов дефицита при полном удалении брома из пищи[15]. В других биологических функциях бром может не быть необходимым, но всё же приносить пользу, особенно когда он заменяет хлор. Например, в присутствии перекиси водорода H2O2 синтезируемая эозинофилами с ионами хлорида или бромида эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких, как, например, нематодные черви, участвующие в филяриозе) и некоторые бактерии, такие как бактерии туберкулёза). Эозинофильная пероксидаза — это галопероксидаза, которая более эффективно использует бром, а не хлор для этой цели, производя гипобромит (бромводородную кислоту), хотя использование хлорид-иона также возможно[16]. Хотя α-галоэфиры, как правило, считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в биоорганическом синтезе, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил-4-бром-3-оксобутаноата, которые присутствуют в их спинномозговой жидкости и, вероятно, играют пока неясную роль в возникновении быстрого сна[17].
Морские организмы являются основным источником броморганических соединений, и именно в этих организмах роль брома могла бы быть намного более высокой. Более 1600 таких броморганических соединений были идентифицированы к 1999 году. Наиболее распространённым является метилбромид (CH3Br), около 56 000 тонн которого синтезируется за год морскими водорослями[18]. Эфирное масло гавайской водоросли Asparagopsis taxiformis состоит из 80 % бромоформа[19]. Большинство таких броморганических соединений в море синтезируется водорослями под действием уникального фермента, ванадийбромпероксидазы[20].
Особенности работы[править | править код]
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Проливы брома целесообразно посыпать карбонатом натрия:
либо влажной пищевой содой:
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не рекомендуется[источник не указан 1600 дней]. Лучше всего[источник не указан 1600 дней] для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3—5-процентный тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы, легенды, заблуждения и их опровержения[править | править код]
Существует широко распространённая городская легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно неизвестно.
Препараты брома имеют солёный вкус и оказывают седативный (успокаивающий) и снотворный эффект[21].
Ни в коем случае не следует путать «аптечный бром» (водные растворы бромида калия или натрия), который применяют при расстройствах нервной системы, и элементарный бром, который является весьма токсичным веществом с раздражающим действием. Принимать элементарный бром внутрь ни в коем случае не следует — это сильнейший яд[22].
См. также[править | править код]
- Утечка брома в Челябинске
Комментарии[править | править код]
- ↑ 1 2 Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе
Примечания[править | править код]
- ↑ 1 2 Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265—291. — doi:10.1515/pac-2015-0305.
- ↑ Ксензенко В. И., Стасиневич Ц. С. Бром // Химическая энциклопедия: в 5 т. / И. Л. Кнунянц (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 318. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Таблица Менделеева на сайте ИЮПАК.
- ↑ Weeks, Mary Elvira (англ.)русск.. The discovery of the elements: XVII. The halogen family (англ.) // Journal of Chemical Education (англ.)русск. : journal. — 1932. — Vol. 9, no. 11. — P. 1915. — doi:10.1021/ed009p1915. — Bibcode: 1932JChEd…9.1915W.
- ↑ Löwig, Carl Jacob. Das Brom und seine chemischen Verhältnisse (нем.) : magazin. — Heidelberg: Carl Winter, 1829.
- ↑ Vauquelin, L. N.; Thenard, L. J.; Gay-Lussac, J. L. Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance (фр.) // Annales de Chimie et de Physique (англ.)русск. (2nd series) : magazine. — 1826. — Vol. 32. — P. 382—384.
- ↑ Большой древнегреческий словарь (αω).
- ↑ Эмболит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ J. P. Riley, Skirrow G. Chemical Oceanography, V. 1, 1965.
- ↑ 1 2 Greenwood N. N., Earnshaw A. Chemistry of the Elements. — 2nd Ed. — Elsevier, 2012. — 1600 с. — ISBN 9780080501093.
- ↑ Лидин Р. А. и др. Химические свойства неорганических веществ. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ 1 2 Bromine. Immediately Dangerous to Life or Health Concentrations (IDLH). The National Institute for Occupational Safety and Health (NIOSH). May 1994.
- ↑ Каталог химических реактивов фирмы MERCK (Германия), 2008—2010 г.
- ↑ McCall A. S. et al. Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture (англ.) // Cell : journal. — Cell Press (англ.)русск., 2014. — Vol. 157, no. 6. — P. 1380—1392. — doi:10.1016/j.cell.2014.05.009. — PMID 24906154.
- ↑ Nielsen F. H. Possibly Essential Trace Elements // Clinical Nutrition of the Essential Trace Elements and Minerals: The Guide for Health Professionals. — 2000. — С. 11—36. — ISBN 978-1-61737-090-8. — doi:10.1007/978-1-59259-040-7_2.
- ↑ Mayeno A. N., Curran A. J., Roberts R. L., Foote C. S. Eosinophils preferentially use bromide to generate halogenating agents (англ.) // J. Biol. Chem. : journal. — 1989. — Vol. 264, no. 10. — P. 5660—5668. — PMID 2538427.
- ↑ Gribble, Gordon W. The diversity of naturally occurring organobromine compounds (англ.) // Chemical Society Reviews (англ.)русск. : journal. — 1999. — 1 January (vol. 28, no. 5). — P. 335. — ISSN 1460-4744. — doi:10.1039/A900201D.
- ↑ Gribble G. W. The diversity of naturally occurring organobromine compounds (англ.) // Chemical Society Reviews (англ.)русск. : journal. — 1999. — Vol. 28, no. 5. — P. 335—346. — doi:10.1039/a900201d.
- ↑ Burreson B. J., Moore R. E., Roller P. P. Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta) (англ.) // Journal of Agricultural and Food Chemistry (англ.)русск. : journal. — 1976. — Vol. 24, no. 4. — P. 856—861. — doi:10.1021/jf60206a040.
- ↑ Butler A., Carter-Franklin J. N. The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products (англ.) // Natural Product Reports (англ.)русск. : journal. — 2004. — Vol. 21, no. 1. — P. 180—188. — doi:10.1039/b302337k. — PMID 15039842.
- ↑ Машковский М. Д. Лекарственные средства. — 15-е изд. — М.: Новая Волна, 2005. — С. 89-90. — 1200 с. — ISBN 5-7864-0203-7.
- ↑ Сергей Уфимцев. Утечка брома сорвала праздник знаний в школах Челябинска. Комсомольская правда. Дата обращения 24 февраля 2013. Архивировано 25 февраля 2013 года.
Литература[править | править код]
- Львов М. Д. Бром, химический элемент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Справочник для химиков, инженеров, врачей. Вредные вещества в промышленности. Том 3. — Л.: Химия, 1977. — С. 22—24.
Ссылки[править | править код]
- Бром на WebElements.com
- Бром в Популярной библиотеке химических элементов
- График теплопроводности брома (англ.)
- Вязкость брома при определённых условиях (англ.)
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
