В ядрах каких элементов содержится равное число протонов и нейтронов


Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
Количество нейтронов соответствует определённому изотопу того или иного элемента. Изотопы – это элементы с одинаковым атомным номером (одинаковым количеством протонов и электронов), но с разным массовым числом. Массовое число – общее количество нейтронов и протонов в ядре атома (обозначается латинской буквой А). При записи формул массовое число указывается вверху символа элемента с одной из сторон: He42/42He (Изотоп Гелия – Гелий — 4)
Таким образом, чтобы узнать число нейтронов в том или ином изотопе, следует от общего массового числа отнять число протонов. Например, нам известно, что в атоме Гелия-4 He42 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He42 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He42), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He42 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He42) «бомбардировались» ядра изотопа азота (N147), вследствие чего образовался изотоп оксигена (O178) и один протон (p11)
Данная ядерная реакция выглядит следующим образом:
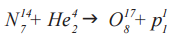
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
— количество протонов указано в нижнем показателе;
— количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
— умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
— умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
— сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He42), провёденная Э. Резерфордом в 1919 году)
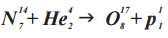
ДО РЕАКЦИИ (N147 + He42)
N147
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He42
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N147 + He42
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O178) и один протон (p11):
O178
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p11
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O178 + p11):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
| До реакции | После реакции |
| 405 | 405 |
Количества фантомных частичек По до и после реакции равны.
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Здесь и далее расчёты количества фантомных частичек По приведены в сокращённой форме, в которой отображено общее количество фантомных частичек По в каждом ядре, а также их сумма до и после реакции.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
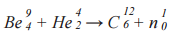
213 + 90 → 270 + 33 — количество фантомных частичек По в каждом из ядер
303 = 303 — общая сумма фантомных частичек По до и после реакции
Количества фантомных частичек По до и после реакции равны.
Назад
Вперёд
Оглавление
- ИСКОННАЯ ФИЗИКА АЛЛАТРА
- История
- О докладе
- Атомы
- Об эфире
- Элементарные частицы
- Человеческое восприятие
- О нематериальном начале
- Определения ИСКОННОЙ ФИЗИКИ АЛЛАТРА
- Эзоосмическая решётка
- Эзоосмическая ячейка
- Эзоосмическая мембрана
- Септонное поле
- Реальная (стационарная) частичка По
- Фантомная частичка По
- Основные отличия реальных и фантомных частичек ПО
- Эзоосмос
- Процесс Эзоосмоса
- Передача и распределение энергии и информации
- Свободная энергия
- Ассоциативные примеры процесса эзоосмоса, передачи и распределения энергии и информации
- Структура элементарных частиц
- Аллат
- Фотон
- Нейтрино
- Электрон
- Проверка известных формул и реакций
- Состав ядра атома. Расчет протонов и нейтронов
- Формы записи ядерных реакций
- Формулы реакций, лежащие в основе управляемого термоядерного синтеза
- Формулы реакций протон-протонного цикла (pp-цикл)
- Формулы реакций углеродного цикла (CN-цикл)
- Формулы фотоядерных реакций
- Формулы ядерных реакций с участием нейтронов
- Формулы реакций с участием α–частиц
- ЗАКЛЮЧЕНИЕ
Àòîìíîå ÿäðî — ýòî öåíòðàëüíàÿ ÷àñòü àòîìà, ñîñòîÿùàÿ èç ïðîòîíîâ è íåéòðîíîâ (êîòîðûå âìåñòå íàçûâàþòñÿ íóêëîíàìè).
ßäðî áûëî îòêðûòî Ý. Ðåçåðôîðäîì â 1911 ã. ïðè èññëåäîâàíèè ïðîõîæäåíèÿ α-÷àñòèö ÷åðåç âåùåñòâî. Îêàçàëîñü, ÷òî ïî÷òè âñÿ ìàññà àòîìà (99,95%) ñîñðåäîòî÷åíà â ÿäðå. Ðàçìåð àòîìíîãî ÿäðà èìååò ïîðÿäîê âåëè÷èíû 10-13-10-12 ñì, ÷òî â 10 000 ðàç ìåíüøå ðàçìåðà ýëåêòðîííîé îáîëî÷êè.
Ïðåäëîæåííàÿ Ý. Ðåçåðôîðäîì ïëàíåòàðíàÿ ìîäåëü àòîìà è ýêñïåðèìåíòàëüíîå íàáëþäåíèå èì ÿäåð âîäîðîäà, âûáèòûõ α -÷àñòèöàìè èç ÿäåð äðóãèõ ýëåìåíòîâ (1919-1920 ãã.), ïðèâåëè ó÷åíîãî ê ïðåäñòàâëåíèþ î ïðîòîíå. Òåðìèí ïðîòîí áûë ââåäåí â íà÷àëå 20-õ ãã XX ñò.
Ïðîòîí (îò ãðå÷. protons — ïåðâûé, ñèìâîë p) — ñòàáèëüíàÿ ýëåìåíòàðíàÿ ÷àñòèöà, ÿäðî àòîìà âîäîðîäà.
Ïðîòîí — ïîëîæèòåëüíî çàðÿæåííàÿ ÷àñòèöà, çàðÿä êîòîðîé ïî àáñîëþòíîé âåëè÷èíå ðàâåí çàðÿäó ýëåêòðîíà e= 1,6 · 10-19 Êë. Ìàññà ïðîòîíà â 1836 ðàç áîëüøå ìàññû ýëåêòðîíà. Ìàññà ïîêîÿ ïðîòîíà mð= 1,6726231 · 10-27 êã = 1,007276470 à.å.ì.
Âòîðîé ÷àñòèöåé, âõîäÿùåé â ñîñòàâ ÿäðà, ÿâëÿåòñÿ íåéòðîí.
Íåéòðîí (îò ëàò. neuter — íè òîò, âè äðóãîé, ñèìâîë n) — ýòî ýëåìåíòàðíàÿ ÷àñòèöà, íå èìåþùàÿ çàðÿäà, ò. å. íåéòðàëüíàÿ.
Ìàññà íåéòðîíà â 1839 ðàç ïðåâûøàåò ìàññó ýëåêòðîíà. Ìàññà íåéòðîíà ïî÷òè ðàâíà (íåçíà÷èòåëüíî áîëüøå) ìàññå ïðîòîíà: ìàññà ïîêîÿ ñâîáîäíîãî íåéòðîíà mn = 1,6749286 · 10-27êã = 1,0008664902 à.å.ì. è ïðåâîñõîäèò ìàññó ïðîòîíà ïà 2,5 ìàññû ýëåêòðîíà. Íåéòðîí, íàðÿäó ñ ïðîòîíîì ïîä îáùèì íàçâàíèåì íóêëîí âõîäèò â ñîñòàâ àòîìíûõ ÿäåð.

Íåéòðîí áûë îòêðûò â 1932 ã. ó÷åíèêîì Ý. Ðåçåðôîðäà Ä. ×åäâèãîì ïðè áîìáàðäèðîâêå áåðèëëèÿ α-÷àñòèöàìè. Âîçíèêàþùåå ïðè ýòîì èçëó÷åíèå ñ áîëüøîé ïðîíèêàþùåé ñïîñîáíîñòüþ (ïðåîäîëåâàëî ïðåãðàäó èç ñâèíöîâîé ïëàñòèíû òîëùèíîé 10-20 ñì) óñèëèâàëî ñâîå äåéñòâèå ïðè ïðîõîæäåíèè ÷åðåç ïàðàôèíîâóþ ïëàñòèíó (ñì. ðèñóíîê). Îöåíêà ýíåðãèè ýòèõ ÷àñòèö ïî òðåêàì â êàìåðå Âèëüñîíà, ñäåëàííàÿ ñóïðóãàìè Æîëèî-Êþðè, è äîïîëíèòåëüíûå íàáëþäåíèÿ ïîçâîëèëè èñêëþ÷èòü ïåðâîíà÷àëüíîå ïðåäïîëîæåíèå î òîì, ÷òî ýòî γ-êâàíòû. Áîëüøàÿ ïðîíèêàþùàÿ ñïîñîáíîñòü íîâûõ ÷àñòèö, íàçâàííûõ íåéòðîíàìè, îáúÿñíÿëàñü èõ ýëåêòðîíåéòðàëüíîñòüþ. Âåäü çàðÿæåííûå ÷àñòèöû àêòèâíî âçàèìîäåéñòâóþò ñ âåùåñòâîì è áûñòðî òåðÿþò ñâîþ ýíåðãèþ. Ñóùåñòâîâàíèå íåéòðîíîâ áûëî ïðåäñêàçàíî Ý. Ðåçåðôîðäîì çà 10 ëåò äî îïûòîâ Ä. ×åäâèãà. Ïðè ïîïàäàíèè α-÷àñòèö â ÿäðà áåðèëëèÿ ïðîèñõîäèò ñëåäóþùàÿ ðåàêöèÿ:

Çäåñü  — ñèìâîë íåéòðîíà; çàðÿä åãî ðàâåí íóëþ, à îòíîñèòåëüíàÿ àòîìíàÿ ìàññà ïðèáëèçèòåëüíî ðàâíà åäèíèöå. Íåéòðîí — íåñòàáèëüíàÿ ÷àñòèöà: ñâîáîäíûé íåéòðîí çà âðåìÿ ~ 15 ìèí. ðàñïàäàåòñÿ íà ïðîòîí, ýëåêòðîí è íåéòðèíî — ÷àñòèöó, ëèøåííóþ ìàññû ïîêîÿ.
— ñèìâîë íåéòðîíà; çàðÿä åãî ðàâåí íóëþ, à îòíîñèòåëüíàÿ àòîìíàÿ ìàññà ïðèáëèçèòåëüíî ðàâíà åäèíèöå. Íåéòðîí — íåñòàáèëüíàÿ ÷àñòèöà: ñâîáîäíûé íåéòðîí çà âðåìÿ ~ 15 ìèí. ðàñïàäàåòñÿ íà ïðîòîí, ýëåêòðîí è íåéòðèíî — ÷àñòèöó, ëèøåííóþ ìàññû ïîêîÿ.
Ïîñëå îòêðûòèÿ Äæ. ×åäâèêîì íåéòðîíà â 1932 ã. Ä. Èâàíåíêî è Â. Ãåéçåíáåðã íåçàâèñèìî äðóã îò äðóãà ïðåäëîæèëè ïðîòîííî-íåéòðîííóþ (íóêëîííóþ) ìîäåëü ÿäðà. Ñîãëàñíî ýòîé ìîäåëè, ÿäðî ñîñòîèò èç ïðîòîíîâ è íåéòðîíîâ. ×èñëî ïðîòîíîâ Z ñîâïàäàåò ñ ïîðÿäêîâûì íîìåðîì ýëåìåíòà â òàáëèöå Ä. È. Ìåíäåëååâà.
Çàðÿä ÿäðà Q îïðåäåëÿåòñÿ ÷èñëîì ïðîòîíîâ Z, âõîäÿùèõ â ñîñòàâ ÿäðà, è êðàòåí àáñîëþòíîé âåëè÷èíå çàðÿäà ýëåêòðîíà e:
Q = +Ze.
×èñëî Z íàçûâàåòñÿ çàðÿäîâûì ÷èñëîì ÿäðà èëè àòîìíûì íîìåðîì.
Ìàññîâûì ÷èñëîì ÿäðà À íàçûâàåòñÿ îáùåå ÷èñëî íóêëîíîâ, ò. å. ïðîòîíîâ è íåéòðîíîâ, ñîäåðæàùèõñÿ â íåì. ×èñëî íåéòðîíîâ â ÿäðå îáîçíà÷àåòñÿ áóêâîé N. Òàêèì îáðàçîì, ìàññîâîå ÷èñëî ðàâíî:
À = Z + N.
Íóêëîíàì (ïðîòîíó è íåéòðîíó) ïðèïèñûâàåòñÿ ìàññîâîå ÷èñëî, ðàâíîå åäèíèöå, ýëåêòðîíó — íóëåâîå çíà÷åíèå.
Ïðåäñòàâëåíèþ î ñîñòàâå ÿäðà ñîäåéñòâîâàëî òàêæå îòêðûòèå èçîòîïîâ.
Èçîòîïû (îò ãðå÷. isos — ðàâíûé, îäèíàêîâûé è topoa — ìåñòî) — ýòî ðàçíîâèäíîñòè àòîìîâ îäíîãî è òîãî æå õèìè÷åñêîãî ýëåìåíòà, àòîìíûå ÿäðà êîòîðûõ èìåþò îäèíàêîâîå ÷èñëî ïðîòîíîâ (Z) è ðàçëè÷íîå ÷èñëî íåéòðîíîâ (N).
Èçîòîïàìè íàçûâàþòñÿ òàêæå ÿäðà òàêèõ àòîìîâ. Èçîòîïû ÿâëÿþòñÿ íóêëèäàìè îäíîãî ýëåìåíòà. Íóêëèä (îò ëàò. nucleus — ÿäðî) — ëþáîå àòîìíîå ÿäðî (ñîîòâåòñòâåííî àòîì) ñ çàäàííûìè ÷èñëàìè Z è N. Îáùåå îáîçíà÷åíèå íóêëèäîâ èìååò âèä ……. ãäå X — ñèìâîë õèìè÷åñêîãî ýëåìåíòà, A = Z + N — ìàññîâîå ÷èñëî.
Èçîòîïû çàíèìàþò îäíî è òî æå ìåñòî â Ïåðèîäè÷åñêîé ñèñòåìå ýëåìåíòîâ, îòêóäà è ïðîèçîøëî èõ íàçâàíèå. Ïî ñâîèì ÿäåðíûì ñâîéñòâàì (íàïðèìåð, ïî ñïîñîáíîñòè âñòóïàòü â ÿäåðíûå ðåàêöèè) èçîòîïû, êàê ïðàâèëî, ñóùåñòâåííî îòëè÷àþòñÿ. Õèìè÷åñêèå (b ïî÷òè â òîé æå ìåðå ôèçè÷åñêèå) ñâîéñòâà èçîòîïîâ îäèíàêîâû. Ýòî îáúÿñíÿåòñÿ òåì, ÷òî õèìè÷åñêèå ñâîéñòâà ýëåìåíòà îïðåäåëÿþòñÿ çàðÿäîì ÿäðà, ïîñêîëüêó èìåííî îí âëèÿåò íà ñòðóêòóðó ýëåêòðîííîé îáîëî÷êè àòîìà.
Èñêëþ÷åíèåì ÿâëÿþòñÿ èçîòîïû ëåãêèõ ýëåìåíòîâ. Èçîòîïû âîäîðîäà 1Í — ïðîòèé, 2Í— äåéòåðèé, 3Í — òðèòèé ñòîëü ñèëüíî îòëè÷àþòñÿ ïî ìàññå, ÷òî è èõ ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà ðàçëè÷íû. Äåéòåðèé ñòàáèëåí (ò.å. íå ðàäèîàêòèâåí) è âõîäèò â êà÷åñòâå íåáîëüøîé ïðèìåñè (1 : 4500) â îáû÷íûé âîäîðîä. Ïðè ñîåäèíåíèè äåéòåðèÿ ñ êèñëîðîäîì îáðàçóåòñÿ òÿæåëàÿ âîäà. Îíà ïðè íîðìàëüíîì àòìîñôåðíîì äàâëåíèè êèïèò ïðè 101,2 °Ñ è çàìåðçàåò ïðè +3,8 ºÑ. Òðèòèé β-ðàäèîàêòèâåí ñ ïåðèîäîì ïîëóðàñïàäà îêîëî 12 ëåò.
Ó âñåõ õèìè÷åñêèõ ýëåìåíòîâ èìåþòñÿ èçîòîïû. Ó íåêîòîðûõ ýëåìåíòîâ èìåþòñÿ òîëüêî íåñòàáèëüíûå (ðàäèîàêòèâíûå) èçîòîïû. Äëÿ âñåõ ýëåìåíòîâ èñêóññòâåííî ïîëó÷åíû ðàäèîàêòèâíûå èçîòîïû.
Èçîòîïû óðàíà. Ó ýëåìåíòà óðàíà åñòü äâà èçîòîïà — ñ ìàññîâûìè ÷èñëàìè 235 è 238. Èçîòîï  ñîñòàâëÿåò âñåãî 1/140 ÷àñòü îò áîëåå ðàñïðîñòðàíåííîãî
ñîñòàâëÿåò âñåãî 1/140 ÷àñòü îò áîëåå ðàñïðîñòðàíåííîãî  .
.
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1] Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2] На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Как найти чисто протонов, электронов и нейтронов
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5] Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]. Атомная масса указана под символом элемента.
- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Расчет электронов с присутствующими ионами
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.
- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Об этой статье
Эту страницу просматривали 669 035 раз.
Была ли эта статья полезной?
Укажите массовое и зарядовое число частицы, которая рождается в результате
ядерной реакции:
Запишите в поле ответа последовательность цифр без пробелов и запятых в порядке, соответствующем величинам: массовое число, зарядовое число.
Это задание решали 74 раза. С ним справились 62% пользователей.
Во сколько раз число нейтронов в ядре превышает число протонов в этом ядре?
Ответ округлите до десятых.
Это задание решали 28 раз. С ним справились 32% пользователей.
В результате слияния ядра и протона образовалось неустойчивое ядро, которое через короткое время разделилось на два одинаковых ядра.
Чему равен заряд каждого из образовавшихся ядер?
Это задание решали 48 раз. С ним справились 83% пользователей.
Атом хрома испытывает -распада и -распада.
Запишите, сколько протонов и нейтронов содержит атом, получившийся в результате этих распадов.
Цифры запишите подряд без пробелов, запятых и других знаков препинания.
Это задание решали 31 раз. С ним справились 52% пользователей.
Ядро совершает несколько радиоактивных распадов и превращается в ядро
Какое число — и -распадов произошло с атомом?
Запишите в поле для ответа последовательность цифр в порядке, соответствующем величинам: число -распадов, число -распадов.
Это задание решали 38 раз. С ним справились 79% пользователей.
На рисунке представлен фрагмент Периодической системы элементов Д. И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наименее
распространённого из основных стабильных изотопов бора.
Запишите в поле для ответа последовательность цифр в порядке, соответствующем величинам: число протонов, число нейтронов.
Цифры запишите подряд без пробелов, запятых и других знаков препинания.
Это задание решали 77 раз. С ним справились 27% пользователей.
Ядро фтора захватило электрон.
Определите зарядовое число и массовое число ядра, образовавшегося в
результате этой реакции.
В поле для ответа запишите получившиеся значения в порядке, соответствующем величинам: зарядовое число, массовое число ядра.
Это задание решали 59 раз. С ним справились 10% пользователей.
Радиоактивный радий при распаде превращается в изотоп радон
Укажите массовое число и заряд частицы, образовавшейся при этом
превращении.
Запишите в поле для ответа цифры, соответствующие полученным величинам в порядке: массовое число, заряд частицы.
Это задание решали 57 раз. С ним справились 40% пользователей.
Чему равно количество протонов и нейтронов в изотопе индия
Запишите в поле для ответа последовательность цифр, соответствующих величинам, в порядке: число протонов, число нейтронов.
Это задание решали 40 раз. С ним справились 45% пользователей.
Сколько электронов и нейтронов содержится в атоме изотопа хлора
Запишите в поле для ответа последовательность чисел, соответствующих количеству электронов и количеству нейтронов.
Это задание решали 37 раз. С ним справились 70% пользователей.
На рисунке изображена модель атома Резерфорда для атома азота Синими кружками обозначены электроны.
В соответствии со схемой определите число
протонов и нейтронов в атоме.
Запишите в поле для ответа последовательность цифр в порядке, соответствующем величинам: число протонов, число нейтронов в атоме.
Это задание решали 31 раз. С ним справились 55% пользователей.
Определите, сколько электронов и нейтронов содержит атом алюминия
Запишите в поле для ответа цифры, соответствующие последовательно числу электронов и числу нейтронов.
Это задание решали 54 раза. С ним справились 83% пользователей.
Определите количество нуклонов и электронов в атоме
Запишите в поле для ответа последовательность чисел, соответствующих количеству: нуклонов, электронов.
Числа запишите подряд без пробелов, запятых и других знаков препинания.
Это задание решали 12 раз. С ним справились 58% пользователей.
В результате серии радиоактивных распадов ядро плутония
превращается в изотоп висмута
Какое количество — и -распадов оно
испытывает при этом?
В поле для ответа запишите по порядку числа — и -распадов соответственно.
Это задание решали 293 раза. С ним справились 22% пользователей.
На рисунке изображена модель нейтрального атома. Масса атома
приблизительно равна а.е.м.
Сколько протонов и нейтронов содержит ядро
данного атома?
Запишите в поле для ответа последовательность цифр, соответствующих величинам: количество протонов, количество нейтронов.
Цифры запишите подряд, без пробелов и знаков препинания.
Это задание решали 51 раз. С ним справились 51% пользователей.
