Укажите образование каких продуктов определяет направление реакции

Температура наступления равновесия системы
Задача 10.
Термохимическое уравнение реакции: СО(г) + 2H2(г) = CH3OH(ж) + 128 кДж.
Вычислите, при какой температуре наступает равновесие в этой системе?
Решение:
Так как при реакции выделяется тепло, то это экзотермическая реакция. При экзотермических реакциях энтальпия системы уменьшается и ∆H < 0 (Н2 < H1). Тепловые эффекты выражаются через ∆H.
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Энтропия S, так же как энтальпия Н, является свойством вещества, пропорциональным его количеству. Энтропия является функцией состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса:
∆Sх.р. = ∆S0прод. – ∆S0исх.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка (– Т∆S). При Р = const и Т = const общую движущую силу процесса, которую обозначают ∆G, можно найти из соотношения:
∆G = (Н2 – H1) – (TS2 – TS1); ∆G = ∆H – T∆S.
Химическое равновесие — состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
В состояния равновесия:
∆G = 0 и ∆H = T∆S.
Находим ∆S. для данной системы:
S0(СО) = 197,55·10-3 кДж/моль·К;
S0(Н2) = 130,52·10-3 кДж/моль·К;
S0(СН3ОН) = 126,78·10-3 кДж/моль·К;
∆Sх.р. = 126,78·10-3-(197,55·10-3) + (2·130,52·10-3) = -331,81·10-3.
Из условия равновесия :
∆H = T∆S находим Т = ∆H/∆S.
Т = (-128 кДж/моль)/(-331,81·10-3 кДж/моль·К) = 385,7 K.
Ответ: при 385,7 K наступит равновесие в системе.
Определение направления протекания реакции
Задача 11.
Определить направление протекания реакции:
СН4(г) + СО2(г) ⇔ 2СО(г) + 2Н2(г) при стандартных условиях. Вычислить ∆G0298
Решение:
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования ∆Hобр продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов:
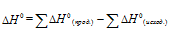
∆Нх.р. = [2∆Н(СО(г)] + [2∆Н(Н2(г)] — [∆Н(СН4(г)]+ [∆Н(СО2(г)]
т.к. ∆Н для простых веществ равна 0, то выражение принимает вид:
∆Нх.р. = [2∆Н(СО(г)] — [∆Н(СН4(г)]- [∆Н(СО2(г)]
∆Нх.р. = 2(-110,53)-(-74,85)-(-393,51) = 247,3 кДж/моль.
Энтропия — функция состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2)состояния и не зависит от пути процесса:
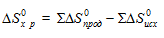
∆Sх.р. = [2∆S(СО(г)] + [2∆S(Н2(г)] — [∆S(СН4(г)] + [∆S(СО2(г)] =
= 2(197,55) + 2(130,52) — 186,27 — 213,66 = 256,26·10-3 кДж/моль·К.
∆G, можно найти из соотношения:
∆G = ∆H – T∆S.
Необходимо рассчитать возможность самопроизвольного протекания реакции при стандартных условиях (Т = 298 K), получим:
∆G = 247,3 — (298·256,26·10-3) = +170,9 кДж.
Ответ: ∆G = +170,9 кДж. Так как ∆G > 0, следовательно, при стандартных условиях невозможно протекание прямой реакции. Реакция может протекать в обратном направлении.
Егор Егоров · 28 марта
1,9 K
ООО «НПК «Диасел» — Профессиональная очистка воды · diasel.ru
Запишем цепочку превращений:
Ba + 2H2O = Ba(OH)2 + H2
исходные вещества: барий и вода
продукты реакции: гидроксид бария и волород
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
исходные вещества: гидроксид бария и соляная кислота
продукты реакции: хлорид бария и вода
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
исходные вещества: хлорид бария и сульфат натрия
продукты реакции: сульфат бария и хлорид натрия
Что такое реакция замещения в химии?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????Реакции замещения в химии????
✅Это химическая реакция, в результате которой атом простого вещества замещает атом одного из элементов в сложном веществе
✅Выглядит эта реакция так: AB+C➡️CB+A
✅Рассмотрим примеры:
Zn+2HCl➡️ZnCl2+H2
2Al+3CuSO4➡️Al2(SO4)3+3Cu
2Al+Cr2O3➡️Al2O3+2Cr
✅В эту реакцию вступают:
-щелочные/щелочноземельные металлы с водой
-металлы с кислотами
-металлы с солями в растворе
-металлотермия
✅Не забывайте смотреть на ряд активности металлов
В каком соотношении находятся равновесные и исходные концентрации веществ?
Researcher, Institute of Physics, University of Tartu
Тут какое-то недоопределение условий. Равновесные концентрации определяются константой равновесия и стехиометрией реакции, а исходные концентрации могут быть любые, поскольку никто не мешает взять вещества в любом соотношении.
Если мы исходно берем стехиометрические соотношения, то по стехиометрии процесса и зная константу равновесия можно вычислить соотношение между исходными концентрациями и равновесными. В общем случае сказать нельзя.
Какой химический элемент произошел бы от соединения всех остальных элементов?
Researcher, Institute of Physics, University of Tartu
Химический элемент — это некоторая абстрактная совокупность атомов с одинаковым числом протонов в ядре. То есть, где бы такие атомы не находились, в состав чего бы они ни входили, они будут атомами данного элемента. Грубо говоря, химический элемент — это сорт атомов. Как «антоновка» — это сорт яблок. Яблоко может расти на дереве или лежать в ящике, но все равно будет «антоновкой».
Реальным выражением этой абстрактной совокупности являются так называемые «простые вещества», то есть, вещества состоящие только из атомов одного «сорта». Скажем, железо. Кусок железа состоит только из атомов железа. Как на дереве антоновки растут только яблоки антоновки.
Но если мы возьмем ржавчину, оксид железа, то атомы железа в нем все равно останутся атомами химического элемента «железо», хотя кусок ржавчины не будет куском железа, а будет куском оксида железа, сложного вещества, то есть, вещества, состоящего из атомов разных элементов. Это как в ящик сложить яблоки антоновки и, например, грушевки. Будет ящик с двумя сортами яблок. И нельзя будет назвать какого-то одного сорта для всех этих яблок.
В связи с этим вопрос «какой химический элемент произошел бы от соединения всех остальных элементов?» не имеет смысла. От соединения атомов разных элементов получаются сложные вещества, а не химические элементы. Атомы разных сортов по определению не могут составлять «химического элемента», это было бы логическим противоречием с определением понятия «химический элемент». Это то же самое, что спросить «какой сорт яблок получится, если сложить в один ящик яблоки антоновки, гольден, семеренко и т.д.?» Никакого сорта не получится, будет просто ящик с разными яблоками.
Как ученым удалось выяснить строение макромолекул природного каучука?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Был проведет опыт, каучук нагрели и оказалось, что при нагревании каучук разлагается. Продукты разложения каучука поместили в бромную воду и та обесцветилась. Из этого был сделан вывод, что в продуктах разложения каучука содержатся непредельные углеводороды. Затем в ходе экспериментов было установлено, что это вещество — изопрен. Значит, макромолекулы каучука состоят из молекул изопрена.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
T | ↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
p | ↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
c | ↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |

Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) Cu(NO3)2 и Na2S
В) Cu(NO3)2 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) HCl и Al(OH)3
В) AgNO3 и KI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и H3PO4
Б) Zn(OH)2 и HCl
В) MnO2 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2CrO4 и H2SO4
Б) Cu(OH)2 и HCl
В) HCl и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaCl
Б) NaI и AgNO3
В) CuCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2S и H2SO4
Б) Fe(OH)2 и HCl
В) FeSO4 и Ba(NO3)2
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и KOH
Б) K2CO3 и BaCl2
В) Na2CO3 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CaCl2 и AgNO3
Б) CuCl2 и Ba(OH)2
В) FeCl3 и Ba(OH)2
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Al(NO3)3 и NaOH
Б) K2CO3 и HNO3
В) HBr и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NH4Cl
Б) NH4Cl и Ca(OH)2
В) CuSO4 и KOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Fe(NO3)2 и NaOH
Б) KOH и CuCl2
В) ZnCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и H2SO4(конц.)
Б) NaOH и NH4Cl
В) Na2CO3 и HI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CuSO4 и BaCl2
Б) CuSO4 и NaOH
В) FeSO4 и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) FeCl3 и AgNO3
Б) CaCl2 и Na2CO3
В) KOH и H3PO4
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) H2SO4 и Na2SO3
Б) HCl и Na2CO3
В) Cr(OH)3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) HNO3 и K2SiO3
Б) H2SO4 и BaCl2
В) Cu и H2SO4
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) BaI2 и AgNO3
Б) Ag и HNO3 (конц.)
В) Ag и H2SO4 (конц.)
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
