Селен какие свойства проявляет

| Селен | |
|---|---|
 Чёрные, серые и красные аллотропные модификации | |
| Название, символ, номер | Селен / Selenium (Se), 34 |
| Атомная масса (молярная масса) | 78,96(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s2 3d10 4p4 |
| Радиус атома | 140 пм |
| Ковалентный радиус | 116 пм |
| Радиус иона | (+6e) 42 (-2e) 198 пм |
| Электроотрицательность | 2,55 (шкала Полинга) |
| Электродный потенциал | |
| Степени окисления | -2, 0, +4, +6 |
| Энергия ионизации (первый электрон) | 940,4 (9,75) кДж/моль (эВ) |
| Плотность (при н. у.) | 4,79 г/см³ |
| Температура плавления | 490 K |
| Температура кипения | 958,1 K |
| Уд. теплота плавления | 5,23 кДж/моль |
| Уд. теплота испарения | 59,7 кДж/моль |
| Молярная теплоёмкость | 25,4 Дж/(K·моль) |
| Молярный объём | 16,5 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=4,364; c=4,959 Å |
| Отношение c/a | 1,136 |
| Температура Дебая | 90 K |
| Теплопроводность | (300 K) 0,52 Вт/(м·К) |
| Номер CAS | 7782-49-2 |
Селен — химический элемент 6-й группы (по устаревшей классификации — главной подгруппы VI группы), 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se (лат. Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). Относится к халькогенам.

История
Элемент открыт Й. Я. Берцелиусом в 1817.
Сохранился рассказ самого Берцелиуса о том, как произошло это открытие:
Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты.
В 1873 году Уиллоуби Смит обнаружил, что электрическое сопротивление серого селена зависит от освещённости. Это свойство стало основой для чувствительных к свету ячеек. Первый коммерческий продукт на основе селена был представлен на рынке в середине 1870-х годов Вернером фон Сименсом. Селеновая ячейка использовалась в фотофоне, созданном Александром Беллом в 1879 году. Электрический ток, проходящий через селен, пропорционален количеству света, падающему на его поверхность, — это свойство использовано в различных измерителях освещённости (экспонометрах). Полупроводниковые свойства селена нашли применение в других областях электроники В 1930-е годы началось развитие селеновых выпрямителей, которые пришли на смену медно-закисным выпрямителям благодаря высокой эффективности Селеновые выпрямители использовались до 1970-х годов, когда им на смену пришли кремниевые выпрямители.
В более позднее время была обнаружена токсичность селена. Были зарегистрированы случаи отравления людей, работавших на селеновых производствах, а также животных, поедавших богатые селеном растения. В 1954 году были обнаружены первые признаки биологического значения селена для микроорганизмов. В 1957 году была установлена важная роль селена в биологии млекопитающих. В 1970-е годы было показано наличие селена в двух независимых группах энзимов, а затем обнаружен селеноцистеин в белках. В 1980-е годы было установлено, что селеноцистеин кодируется кодоном UGA. Механизм кодирования был установлен сначала для бактерий, а затем для млекопитающих (SECIS-элемент).
Происхождение названия
Название происходит от греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Нахождение в природе

Содержание селена в земной коре — около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 0,4 мкг/л. На территории Кавказских Минеральных Вод есть источник с содержанием биогенного Se более 50 мкг/л.
Получение
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения: окислительный обжиг с возгонкой SeO2; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементного селена действием SO2.
Физические свойства

Монокристаллический селен (99,9999 %)
Твёрдый селен имеет несколько аллотропных модификаций:
- Серый селен (γ-Se, «металлический селен») — наиболее устойчивая модификация с гексагональной кристаллической решёткой;
- Красный кристаллический селен — три моноклинные модификации: оранжево-красный α-Se, тёмно-красный β-Se, красный γ-Se;
- Красный аморфный селен;
- Чёрный стекловидный селен.
При нагревании серого селена он даёт серый же расплав, а при дальнейшем нагревании испаряется с образованием коричневых паров. При резком охлаждении паров селен конденсируется в виде красной аллотропной модификации.
Химические свойства
Селен — аналог серы и проявляет степени окисления −2 (H2Se), +4 (SeO2) и +6 (H2SeO4). Однако, в отличие от серы, соединения селена в степени окисления +6 — сильнейшие окислители, а соединения селена (−2) — гораздо более сильные восстановители, чем соответствующие соединения серы.
Простое вещество селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно. Окислить селен удаётся только при дополнительном нагревании, при котором он медленно горит синим пламенем, превращаясь в двуокись SeO2. Со щелочными металлами селен реагирует (весьма бурно), только будучи расплавленным.
В отличие от SO2, SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + H2O → H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, более сильную, чем серная.
Биологическая роль
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. Является необходимым для жизни микроэлементом, но большинство соединений достаточно токсичны (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.

Роль селена в организме человека
В организме человека содержится 10—14 мг селена, бо́льшая его часть сконцентрирована в печени, почках, селезёнке, сердце, яичках и семенных канатиках у мужчин. Селен присутствует в ядре клетки.
Суточная потребность человека в селене составляет 70-100 мкг. Повышенное содержание селена в организме может приводить к депрессии, тошноте, рвоте, диарее, поражению ЦНС и др.
Согласно данным эпидемиологических исследований 1990-х годов, более чем у 80 % россиян наблюдается дефицит селена.
Селен в организме взаимодействует с витаминами, ферментами и биологическими мембранами, участвует в регуляции обмена веществ, в обмене жиров, белков и углеводов, а также в окислительно-восстановительных процессах. Селен является составным компонентом более 30 жизненно важных биологически активных соединений организма. Селен входит в активный центр ферментов системы антиоксидантно-антирадикальной защиты организма, метаболизма нуклеиновых кислот, липидов, гормонов (глутатионпероксидазы, йодотиронин-дейододиназы, тиоредоксинредуктазы, фосфоселенфосфатазы, фосфолипид-гидропероксид-глутатионпероксидазы, специфических протеинов Р и W и др.).
Селен входит в состав белков мышечной ткани, белков миокарда. Также селен способствует образованию трийодтиронина (гормонов щитовидной железы).
Селен является синергистом витамина E и иода. При дефиците селена иод плохо усваивается организмом. Согласно исследованиям, селен необходим для нормального функционирования иммунной системы. Он задействован в механизмах противодействия вирусным инфекциям, включая ВИЧ. Было доказано, что у пациентов, уже заразившихся ВИЧ, он замедляет переход заболевания в СПИД.

Применение
- Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Радиоактивный изотоп селен-75 используется в качестве источника гамма-излучения для дефектоскопии.
- Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл).
- Полупроводниковые свойства селена в чистом виде широко использовались в середине 20-го века для изготовления выпрямителей, особенно в военной технике по следующим причинам: в отличие от германия и кремния, селен малочувствителен к радиации, и, кроме того, селеновый выпрямительный диод самовосстанавливается при пробое: место пробоя испаряется и не приводит к короткому замыканию, допустимый ток диода несколько снижается, но изделие остается функциональным. К недостаткам селеновых выпрямителей относятся их значительные габариты.
- Соединения селена применяются для окрашивания стекла в красный и розовый цвет. Обычно используют металлический селен и селенистокислый натрий Na2SeO3. Красные стекла, окрашенные селеном, называют селеновым рубином. Селен применялся при производстве стекла рубиновых звёзд Московского Кремля.
Применение селена в медицине
Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Из-за его влияния на репарацию ДНК, апоптоз, эндокринную и иммунную системы, а также другие механизмы, включая его антиоксидантные свойства, селен может играть роль в профилактике рака. Согласно исследованиям, приём 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки на 58 %, опухолями простаты — на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.
Малые концентрации селена подавляют гистамин и за счёт этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.
Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе..
Токсичность
Общий характер воздействия селена и его соединений
Селен и его соединения ядовиты, по характеру действия несколько напоминает мышьяк; обладает политропным действием с преимущественным поражением печени, почек и ЦНС. Металлический селен менее ядовит. Из неорганических соединений селена наиболее токсичными являются селеноводород, диоксид селена (ЛД50 = 1,5 мг/кг, крысы, интратрахеально) и селениты натрия (ЛД50 = 2,25 мг/кг, кролик, перорально) и лития (ЛД50 = 8,7 мг/кг, крысы, перорально). Особенно токсичен селеноводород, однако, ввиду его отвратительного запаха, ощущаемого даже в ничтожных концентрациях (0,005 мг/л), удаётся избежать отравлений. Органические соединения селена, такие как алкил- или арил-производные (например, диметилселен, метилэтилселен или дифенилселен), являются сильнейшими нервными ядами, с очень отвратительными запахами; так, порог восприятия для диэтилселена составляет 0,0064 мкг/л.

Отравление
При попадании металлического порошкового селена в количестве 1 грамма перорально вызывает боль в животе в течение двух суток и учащённый стул, со временем симптомы проходят.
Действие на кожу
Соли селена при непосредственном соприкосновении с кожей вызывают ожоги и дерматиты. Диоксид селена при контакте с кожей способен вызывать резкую боль и онемение. При попадании на слизистые оболочки соединения селена могут вызывать раздражение и покраснение, при попадании в глаза резкую боль, слезотечение и конъюктивит.
Изотопы
Основная статья: Изотопы селена
Селен в природе состоит из 6 изотопов: 74Se (0,87 %), 76Se (9,02 %), 77Se (7,58 %), 78Se (23,52 %), 80Se (49,82 %), 82Se (9,19 %). Из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7⋅1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94. Из искусственных изотопов применение нашел 75Se как источник гамма-излучения для неразрушающего контроля сварных швов и целостности конструкций.
Периоды полураспада некоторых радиоактивных изотопов селена:
| Изотоп | Распространённость в природе, % | Период полураспада |
|---|---|---|
| 73Se | — | 7,1 час. |
| 74Se | 0,87 | — |
| 75Se | — | 120,4 сут. |
| 76Se | 9,02 | — |
| 77Se | 7,58 | — |
| 77mSe | — | 17,5 сек. |
| 78Se | 23,52 | — |
| 79Se | — | 6,5⋅104 лет |
| 79mSe | — | 3,91 мин. |
| 80Se | 49,82 | — |
| 81Se | — | 18,6 мин. |
| 81mSe | — | 62 мин. |
| 82Se | 9,19 | 9,7⋅1019 лет |
| 83mSe | — | 69 сек. |
| 83Se | — | 25 мин. |
Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Черный металлические кристаллы селена, образованный на горящем угольном отвале. Ширина изображения — 1,8 мм. Германия, Северный Рейн-Вестфалия, Аахен, Альсдорф, шахта Анна
Селен — хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). Относится к халькогенам. Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. В организме человека содержится 10—14 мг селена, большая его часть сконцентрирована в печени, почках, селезенке, сердце, яичках и семенных канатиках у мужчин. Селен входит в состав белков мышечной ткани, белков миокарда.
СТРУКТУРА
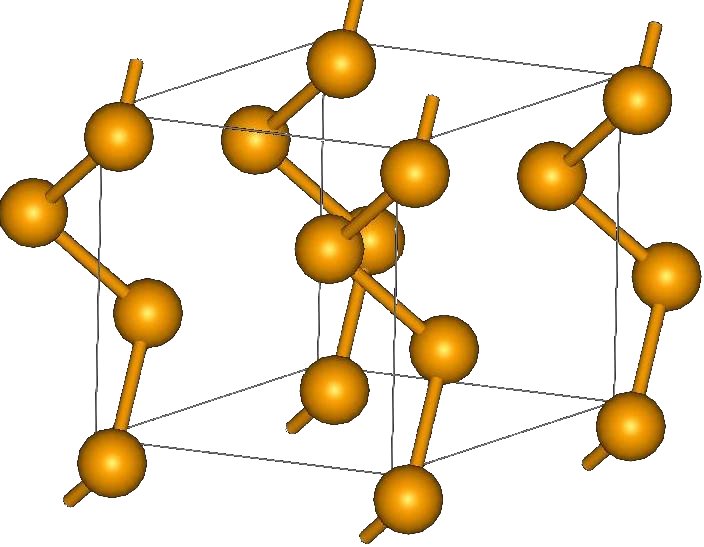
Кристаллическая структура селена
Существует две модификации селена:
1. Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
2. Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен — это одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты H2SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением. Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
СВОЙСТВА

Черный, стеклообразный аморфный и красный аморфный селен
Температура плавления вещества – 217 (α-Se) и 170–180 градусов Цельсия (β-Se), а закипает он при температуре 6850.
Степени окисления, что селен проявляет в реакциях: (-2), (+2), (+4), (+6), он устойчив к воздуху, кислороду, воде, соляной кислоте и разбавленной серной кислоте.
Поддается растворению в азотной кислоте высокой концентрации, «царской водке», более длительно растворяется в щелочной среде с окислением. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА

Селен
Поскольку селен примешен к сере, элемент извлекают из сульфата железа. Для этого даже делать особо ничего не надо. 34-ый металл накапливается в пылеочистительных камерах сернокислотных заводов. Забирают селен и из установок электролиза меди. После него остается анодный шлам. Из него-то и выделяют 34-ый элемент. Достаточно обработать шлам растворами гидроксида натрия и диоксида серы. Полученный селен нужно очистить. Для этого используют метод дистилляции. После, металл подсушивают.
ПРОИСХОЖДЕНИЕ

Отличные глянцевые кристаллы из горящих угольных отвалов. Ширина изображения — 1,8 мм. Германия, Северный Рейн-Вестфалия, Аахен, Альсдорф, шахта Анна
Содержание селена в земной коре — около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4·10-4 мг/л.
ПРИМЕНЕНИЕ

Селен
Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз). Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл). Полупроводниковые свойства селена в чистом виде широко использовались в середине 20-го века для изготовления выпрямителей, особенно в военной технике по следующим причинам: в отличие от германия, кремния, селен малочувствителен к радиации, и, кроме того, селеновый выпрямительный диод обладает уникальным свойством самовосстанавливаться при пробое: место пробоя испаряется и не приводит к короткому замыканию, допустимый ток диода несколько снижается, но изделие остается функциональным. К недостаткам селеновых выпрямителей относятся их значительные габариты.
Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Согласно исследованиям прием 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки — на 58 %, опухолями простаты на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.
Малые концентрации селена подавляют гистамин и за счет этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.
Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе
Селен (англ. Selenium) — Se
| Молекулярный вес | 78.96 г/моль |
| Происхождение названия | От греческого, Selene, «богиня Луны» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.53
| Strunz (8-ое издание) | 1/B.03-30 |
| Nickel-Strunz (10-ое издание) | 1.CC.10 |
| Dana (7-ое издание) | 1.3.3.1 |
| Dana (8-ое издание) | 1.3.4.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | серый переходящий в сероватый черный, красновато- серый, красный |
| Цвет черты | красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | ясная совершенная по {0112} |
| Твердость (шкала Мооса) | 2 |
| Прочность | гибкий |
| Плотность (измеренная) | 4.8 г/см3 |
| Радиоактивность (GRapi) | |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | одноосный (+) |
| Показатели преломления | nω = 3.000 nε = 4.040 |
| Максимальное двулучепреломление | δ = 1.040 |
| Оптический рельеф | очень высокий |
| Оптическая анизотропия | очень сильная |
| Цвет в отраженном свете | белый в воздухе, более темный белый до серовато- коричневого в иммерсии, красный напросвет |
| Плеохроизм | видимый от кремово-белого до коричневого |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 3 2 — трапецоэдральный |
| Пространственная группа | P31 2 1 |
| Сингония | тригональная |
| Параметры ячейки | a = 4.3662Å, c = 4.9536Å |
mineralpro.ru
13.07.2016
