При каком объемном отношении метана и хлора основным продуктом дихлорметан
Дихлóрмета́н (метиленхлорид, хлóристый метилéн, ДХМ, CH2Cl2) — органическое соединение, прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получение[править | править код]
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются ректификацией.
Свойства[править | править код]
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.[4]
Применение[править | править код]
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Также нашел применение для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории[править | править код]
- Промывают концентрированной серной кислотой, нейтрализуют щелочью и промывают водой. Сушат над поташом или безводным сульфатом магния и перегоняют. Для дополнительного обезвоживания используют молекулярные сита 4А[5].
- Кипятят с фосфорным ангидридом с последующей перегонкой. Хранят над молекулярными ситами 3А.
Специализированные применения[править | править код]
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность[править | править код]
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачнение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать интоксикацию данным веществом.[6]
На крысах показано, что дихлорметан может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³ (по ГОСТ 12.1.005-76), в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %. Не горюч, но поддерживает горение, от огня дает вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 970 дней].
Примечания[править | править код]
Литература[править | править код]
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с. — ISBN 5-98371-025-7.
- Ошин Л. А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с. — 8400 экз.
| Хлорметан | |
|---|---|
| Систематическое наименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Хим. формула | CH3Cl |
| Состояние | газ |
| Молярная масса | 50,49 г/моль |
| Плотность | 0,915 г/см³ |
| Энергия ионизации | 11,28 ± 0,01 эВ[1] |
| Температура | |
| • плавления | −97,7 °C |
| • кипения | −24,2 °C |
| • вспышки | −46 °C |
| • самовоспламенения | 625 °C |
| Пределы взрываемости | 8,1 ± 0,1 об.%[1] |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Растворимость | |
| • в воде | 5,325 г/100 мл |
| Гибридизация | тетраэдр |
| Рег. номер CAS | 74-87-3 |
| PubChem | 6327 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | ClC |
| InChI | 1S/CH3Cl/c1-2/h1H3 NEHMKBQYUWJMIP-UHFFFAOYSA-N |
| RTECS | PA6300000 |
| ChEBI | 36014 |
| Номер ООН | 1063 |
| ChemSpider | 6087 |
| Предельная концентрация | 10 мг/м³ |
| Токсичность | ядовит, огнеопасен, канцероген |
| NFPA 704 | 4 2 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Хлормета́н (монохлормета́н, метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
Производство[править | править код]
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение[править | править код]
Хлорметан был широкоприменяемым хладагентом. Данное его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность[править | править код]
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Примечания[править | править код]
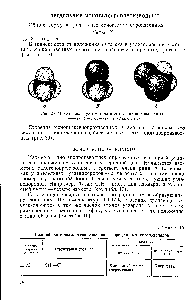
| Рис. 29. Модель. молекулы метана и его галогеиопроизводных а—метан б —хлорметан — дихлорметан |  |
Описание процесса (рис. 103). Хлорирование метана — экзотермическая реакция, которая проводится в трубчатом реакторе, работающем в адиабатическом режиме. Температуру реакции поддерживают в пределах 315—430°С рециркуляцией четыреххлористого углерода или смеси его с избытком низших хлорированных углеводородов. Метан вводят в реактор в одной точке, а хлор и разбавитель вводятся в нескольких точках по мере расходования его для повышения полноты протекания или для регулирования температуры реакции. Состав продуктов реакции зависит от суммарного отношения хлор метан. При молярном отношении хлор метан до 2 1 образуются в основном хлорметил, дихлорметан и хлороформ при молярном отношении от 2 1 до 4 1 — главным образом хлороформ и четыреххлористый углерод. [c.206]
Метан Хлорметан Дихлорметан Трихлорметан Тетрахлорметан [c.65]
Промышленное значение имеет также получение ацетилена ири высокотемпературном пиролизе метана (см. раздел 2.1.4). Кроме того, метан служит для получения целого ряда других соединений, таких как хлорметан, дихлорметан, хлороформ, четыреххлористый углерод, сероуглерод, метанол, формальдегид, нитрометан и др. [c.204]
Хлорирование метана не останавливается на стадии образования хлористого метила можно получить также продукты более глубокого хлорирования дихлорметан (хлористый метилен), трихлорметан (хлороформ) и тетра-хлорметан (четыреххлористый углерод). Практически в той или иной степени образуются все возможные продукты замещения относительные количества их зависят от используемого отношения хлора к метану. Если желательно получить монохлорзамещенный продукт, то следует использовать большой избыток углеводорода. [c.93]
Триэтилалюминий, реагируя с хлороформом, образует дихлорметан и этилхлорид, а с тетрахлорметаном реакция протекает с образованием смеси этана, этилена, дихлорметана и этилхлорида [64]. Реакционная способность хлорпроизводных метана резко снижается при переходе от четыреххлористого углерода к дихлор-метану. В случае проведения реакции триэтилалюминия с четыреххлористым углеродом необходимо применять очень разбавленные растворы, так как даже при таких условиях и комнатной температуре возможен взрыв [65]. С триизобутилалюминием реакция проходит более спокойно [66]. [c.25]
ЭТИХ условиях не является лишь инертом, поскольку он взаи-модействует с метаном (или хлорметанами). Количество добавляемого тетрахлорметана можно рассчитать таким образом, что в результате взаимодействия с метаном (или хлорметанами) он будет отсутствовать в продуктах реакции, а целевыми продуктами окажутся метилхлорид, дихлорметан и трихлорметан. [c.124]
Дихлордифенилтрихлорметнл метан (ДДТ) 524 Дихлорметан 453 Дихлофос 525 Дихроматы 40, 320 Дихромовая кислота 40, 319 Диэтиловый эфир 533 Доломит 285 Доменный процесс 306 Донор электронов 102 Дюралюминий 282 Едкие щелочи 230 Едкий натр 230 Едкое кали 230 Железный купорос 176, 374 Железняки 305, 316 Железо и его соединения 304 сл Железо луженое 284 Желтая кровяная соль 311 Жесткость воды 289 сл. [c.703]
Близкая методика была разработана для получения ди(арил-окси)метанов. Однако в системе жидкость — жидкость реакция идет медленно наиболее удовлетворительные результаты получают в системе твердая фаза — жидкость в дихлорметане (реагент и одновременпо растворитель) в присутствии измельченного КОН и катализатора межфазного переноса [c.76]
Чувствительность определения зависит от природы примеси и применяемого детектора и лежит в пределах 9,1-10 — 4,5-10 мол.%. Метод позволяет определять метан, этан, хлористый метил, хлористый этил, дихлорметан, 1,1-дихлорэтан, хлороформ, 1,2-дихлорэтап, бензол и 1,1,2-трихлорэтан. [c.192]
Собственная ось симметрии. Все молекулы имеют тривиальную ось i, поскольку в любом случае вращение на 360 возвращает молекулу в исходное состояние. Следовательно, операция i эквивалентна операции идентичносш i = E). Дихлорметан имеет ось Q, аммиак — ось С3, метан — четыре оси С3, тетра-1хлорплатинат — ось Q [c.17]
В результате получается смесь продуктов различно степени хлорирования — хлорметан СН С , дихлорметан СН,С1,, грихлор-метан СНС1, и тетрахлорметан СС1 . Процессы такого типа называют цепными, так как один свободный радикал хлора мог бы инициировать хлорирование всех молекул метана, имеющихся в реакционной среде. [c.66]
Толуол Смесь газов тетрахлорметан, трихлорметан, дихлорметан, трихлорфторметан, метан, lj, HF Этанол Метилциклогексан [гомологи толуола) Зам Обмен Хлортрифторметан, дихлорфторметан Конденсация с об н-Бутанол, ацетальдегид, этилен, Н,0 Катализатор и условия те же [1327[ ещение галогенами ThOj (10%) на AljOg, обработанной HF во флюиде, 470 С [1332) разованием С—С-связи ТЬОз—MgO в протоке, 227—527° С [1312] [c.633]
Метан Фторметан Хлорметан Бромметан Иодметан Дифторметан Фторхлорметан Дихлорметан Дибромметан Трифторметан (фреон-23) Дифторхлорметан (фреон-22) [c.146]
Органические галогениды представляют значительную ценность как растворители (например, дихлорметан, хлороформ), мономеры для производства полимеров (например, винилхлорид, тетрафторэтен разд. 4.9), пропелланты (улетучивающиеся компоненты) аэрозолей, хладоагенты (например, дихлордифтор-метан), а также как пестициды (например, ДДТ) (рис. 6.1). [c.122]
Понятие структура включает строение, конфигурацию и конформацию (ср. [6]). Для определени51 структуры таких молекул, как, например, метан, хлог роформ, дихлорметан и хлорбромиодметан, необхо- [c.10]
Заметим, что хлорбромиодметан содержит хиральный атом углерода и, следовательно, имеет две конфигурации отсюда возможны две структуры. Другие соединения (т е. метан, хлороформ и дихлорметан) имеют одну конфигурацию и одну струк туру, [c.11]
Дихлордифторметан. .. Дихлорметан Диэтиламин Закись азота Изобутан. Изопентан. Йодистый водород Кислород. . . Криптон…. Ксенон. … Метан. …. Монометиламин Монопропиламин Моноэтиламин Неон. … Озон. … Окись азота. Окись углерода н-Октан. и-Пентан Пропан. Пропилен Ртуть. . [c.750]
Та же реакция проводилась и в ацетонитриле. В общем выходы в этом растворителе невысоки, так как продукты внутримолекулярной циклизации окисляются легче, чем исходные соединения, а продукты окисления неустойчивы [122]. В смеси дихлорметан — трифторуксусная кислота катион-радикалы, полученные при окислении продуктов циклизации, стабильны, поэтому после восстановления переокисленных частиц нейтральные продукты циклизации могут быть выделены с высокими выходами [123]. Бис (3-метоксифенил) метан дает 2,7-димет-оксифлуорен (54) [реакция (4-28)]. Из (3,4-диметоксифенил)-(3-метоксифенил) метана получаются продукт внутримолекулярной циклизации, его димер и продукт межмолекулярного сочетания с выходами соответственно 36, 6 и 6% [124]. Анодное окисление 3,3, 4,4 -тетраметоксидибензила (55) приводит к промежуточному образованию дигидрофенантрена 56, который подвергается дальнейшему окислению, давая в качестве конечного продукта фенантрен 57 [реакция (4-29)]. При высокой плотно- [c.170]
Впервые холодильные машины с центробежными компрессорами появились в 1922 г., когда фирма Кэрриэр (США) начала выпускать машины этого типа, работавшие на дихлорметане и дихлорэтилене. Несколько позднее (в 1926 г.) фирмой Броун—Бо-вери были построены аммиачные холодильные машины с центробежными компрессорами. С 30-х годов в холодильных машинах с центробежными компрессорами применяют преимущественно фреоны. В настоящее время, кроме фреонов используют также аммиак, пропан-пропиленовую смесь, этилен, этан и метан. В СССР центробежные холодильные компрессоры, работающие на R12, аммиаке, [c.96]
При проведении аналогичной реакции между натриевым производным диметилстибина и дихлорметаном в среде жидкого аммиака был получен бис-(диметилстибил)метан — своеобразное соединение, в котором с одним атомом углерода связаны два атома сурьмы [c.89]
Основные хлорорганические растворители (1984) — [
c.120
]
