Перечислите физические свойства кислорода на каких из этих свойств

Пожалуй, среди всех известных химических элементов, именно кислород занимает ведущее значение, ведь без него попросту было бы невозможным возникновение жизни на нашей планете. Кислород – самый распространенный химический элемент на Земле, на его долю приходится 49% от общей массы земной коры. Также он входит в состав земной атмосферы, состав воды и состав более 1400 различных минералов, таких как базальт, мрамор, силикат, кремнезем и т. д. Примерно 50-80% общей массы тканей, как животных, так и растений состоит из кислорода. И, разумеется, общеизвестна его роль для дыхания всего живого.
История открытия кислорода
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Значение кислорода в природе
Именно наличие кислорода, в сочетании с водой привело к тому, что на нашей планете стало возможным возникновение жизни. Как мы заметили выше, основными поставщиками этого уникального газа являются различные растения, в том числе наибольшее количество выделяемого кислорода приходится на подводные водоросли. Выделяют кислород и некоторые виды бактерий. Кислород в верхних слоях атмосферы образует озоновый шар, который защищает всех жителей Земли от вредного ультрафиолетового солнечного излучения.
Строение молекулы кислорода
Молекула кислорода состоит из двух атомов, химическая формула имеет вид О2. Как образуется молекула кислорода? Механизм ее образования ковалентный неполярный, другими словами за счет обобществления электроном каждого атома. Связь между молекулами кислорода также ковалентная и неполярная, при этом она двойная, ведь у каждого из атомов кислорода есть по два неспаренных электрона на внешнем уровне.

Так выглядит молекула кислорода, благодаря своим характеристикам она весьма устойчива. Для многих химических реакций с ее участием нужны специальные условия: нагревание, повышенное давление, применение катализаторов.
Физические свойства кислорода
- Прежде всего, кислород является газом, из которого состоит 21% воздуха.
- Кислород не имеет ни цвета, ни вкуса, ни запаха.
- Может растворяться в органических веществах, поглощаться углем и порошками металлов.
- Температура кипения кислорода составляет -183 С.
- Плотность кислорода равна 0,0014 г/см3
Химические свойства кислорода
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Получение кислорода
Для получения кислорода в лабораторных условиях применяют метод термической обработки либо пероксидов либо солей кислосодержащих кислот. Под действием высокой температуры они разлагаются с выделением чистого кислорода. Также кислород можно получить с помощью перекиси водорода, даже 3% раствор перекиси под действие катализатор мгновенно разлагается, выделяя кислород.
2KClO3 = 2KCl + 3O2↑ – вот так выглядит химическая реакция получения кислорода.
Также в промышленности в качестве еще одного способа получения кислорода применяют электролиз воды, во время которого молекулы воды раскладываются, и опять таки выделяется чистый кислород.
Использование кислорода в промышленности
В промышленности кислород активно применяется в таких сферах как:
- Металлургия (при сварке и вырезке металлов).
- Медицина.
- Сельское хозяйство.
- Как ракетное топливо.
- Для очищения и обеззараживания воды.
- Синтеза некоторых химических соединений, включая взрывчатые вещества.
Кислород, видео
И в завершение образовательное видео про кислород.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Oxygen.
Введение
Каждый день мы вдыхаем такой необходимый нам воздух. А вы никогда не задумывались о том, из чего, точнее из каких веществ, состоит воздух? Больше всего в нем азота (78%), далее идет кислород (21%) и инертные газы (1%). Хоть кислород и не составляет самую основную часть воздуха, но без него атмосфера была бы непригодной для жизни. Благодаря ему на Земле существует жизнь, ведь азот и инертные газы вместе и по отдельности губительны для человека. Давайте рассмотрим свойства кислорода.
Физические свойства кислорода
В воздухе кислород просто так не различишь, так как в обычных условиях он является газом без вкуса, цвета и запаха. Но кислород можно искусственным путем перевести в другие агрегатные состояния. Так, при -183оС он становится жидким, а при -219оС твердеет. Но твердый и жидкий кислород может получить только человек, а в природе он существует лишь в газообразном состоянии. Жидкий кислород выглядит так (фото). А твердый похож на лед.

Физические свойства кислорода — это еще и строение молекулы простого вещества. Атомы кислорода образуют два таких вещества: кислород (О2) и озон (О3). Ниже показана модель молекулы кислорода.

Кислород. Химические свойства
Первое, с чего начинается химическая характеристика элемента — его положение в периодической системе Д. И. Менделеева. Итак, кислород находится во 2 периоде 6 группе главной подгруппе под номером 8. Его атомная масса — 16 а.е.м, он является неметаллом.
В неорганической химии его бинарные соединения с другими элементами объединили в отдельный класс неорганических соединений — оксиды. Кислород может образовывать химические соединения как с металлами, так и с неметаллами.
Поговорим о его получении в лабораториях.
Химическим путем кислород можно получить с помощью электролиза воды, разложения перманганата калия, пероксида водорода, бертолетовой соли, нитратов активных металлов и оксидов тяжелых металлов. Рассмотрим уравнения реакций при применении каждого из этих способов.
1. Электролиз воды:
2Н2О = 2Н2 + О2
2. Разложение перманганата калия (марганцовки) с помощью катализатора:
KMnO4 = K2MnO4 + KMnO2 + О2
3. Разложение бертолетовой соли:
2KClO3 = 2KCl + 3О2
4. Разложение пероксида водорода (перекиси водорода):
Н2О2 = Н2О + О2
5. Разложение оксидов тяжелых металлов (например, оксида ртути):
2HgO = 2Hg + O2
6. Разложение нитратов активных металлов (например, нитрата натрия):
2NaNO3 = 2NaNO2 + O2
Применение кислорода
С химическими свойствами мы закончили. Теперь пора поговорить о применении кислорода в жизни человека. Он нужен для сжигания топлива в электрических и тепловых станциях. Его используют для получения стали из чугуна и металлолома, для сварки и резки металла. Кислород нужен для масок пожарных, для баллонов водолазов, применяется в черной и цветной металлурги и даже в изготовлении взрывчатых веществ. Также в пищевой промышленности кислород известен как пищевая добавка Е948. Кажется, нет отрасли, где бы он не использовался, но самую важную роль он играет в медицине. Там он так и называется — «кислород медицинский». Для того чтобы кислород был пригоден для использования, его предварительно сжимают. Физические свойства кислорода способствуют тому, что его можно сжать. В подобном виде он хранится внутри баллонов, похожих на такие.

Его используют в реанимации и на операциях в аппаратуре для поддержания жизненных процессов в организме больного пациента, а также при лечении некоторых болезней: декомпрессионной, патологий желудочно-кишечного тракта. С его помощью врачи каждый день спасают множество жизней. Химические и физические свойства кислорода способствуют тому, что его используют так широко.
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]() С в электрической дуге, в природе – при грозовом разряде). Например:
С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t![]() );
);
4NH3 + 3O2 = 2N2↑ + 6H2O (t![]() );
);
4NH3 + 5O2 = 4NO↑ + 6H2O (t![]() , kat);
, kat);
2PH3 + 4O2 = 2H3PO4 (t![]() );
);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t![]() ).
).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t![]() );
);
2SO2 + O2 = 2SO3 (t![]() , V2O5);
, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t![]() ).
).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
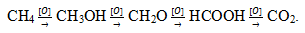
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]() С растворяется 3
С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
Лекция «Кислород –
химический элемент и простое вещество»
План
лекции:
1. Кислород – химический элемент:
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ
б)
Валентные возможности атома кислорода
в)
Распространённость химического элемента в природе
2. Кислород – простое вещество
а)
Получение кислорода
б)
Химические свойства кислорода
в)
Круговорот кислорода в природе
г)
Применение кислорода
«Dum spiro spero» (Пока дышу, надеюсь…), — гласит
латынь
Дыхание – это синоним
жизни, а источник жизни на Земле – кислород.

Подчёркивая важность кислорода для земных
процессов, Яков Берцелиус сказал: « Кислород – это вещество, вокруг которого
вращается земная химия»
Материал данной лекции обобщает
ранее полученные знания по теме «Кислород».
1.
Кислород – химический элемент
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород — элемент главной подгруппы шестой группы,
второго периода периодической системы химических элементов
Д. И. Менделеева, с атомным порядковым номером 8. Обозначается
символом O (лат. Oxygenium). Относительная
атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
б)
Валентные возможности атома кислорода
В соединениях кислород
обычно двухвалентен (в оксидах), валентность VI
не существует. В свободном виде
встречается в виде двух простых веществ: О2 («обычный» кислород) и О3
(озон). О2 — газ без цвета и запаха, с относительной молекулярной
массой =32. О3 – газ без цвета с резким запахом, с относительной
молекулярной массой =48.
Внимание! H2O2 (перекись водорода) – O (валентность II)
СО
(угарный газ) – О (валентность III)
в)
Распространённость химического элемента кислорода в природе

Кислород — самый
распространенный на Земле элемент, на его долю (в составе различных соединений,
главным образом силикатов), приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода —
85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по
объёму и 23% по массе. Более 1500 соединений земной коры в своем составе
содержат кислород.
Кислород входит в
состав многих органических веществ и присутствует во всех живых клетках. По
числу атомов в живых клетках он составляет около 20 %, по массовой
доле — около 65 %.
2.Кислород
– простое вещество
а) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C=K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2=2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток=2H2 + O2↑
2) Из воздуха
ВОЗДУХ давление, -183˚C=O2 (голубая жидкость)
В
настоящее время в промышленности кислород получают из воздуха. В лабораториях
небольшие количества кислорода можно получать нагреванием перманганата калия
(марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее
воздуха, поэтому его можно получать двумя способами:
·
вытеснением воды;
·
вытеснением воздуха (кислород будет собираться на
дне сосуда).
Существуют и другие способы получения
кислорода.
Посмотрите видео-сюжет
получение кислорода при разложении марганцовки (перманганата калия). Полученный
кислород можно обнаружить на дне сосуда тлеющей лучинкой – она вспыхнет.
б)
Химические свойства кислорода
Взаимодействие веществ с кислородом называется окислением.
В результате образуются оксиды –
сложные вещества, состоящие из двух элементов, одним из которых является
двухвалентный атом кислорода.
Реакции окисления, протекающие с выделением тепла и
света, называют реакциями горения. Кислород взаимодействует с простыми
веществами – металлами и неметаллами; а так же со сложными веществами.
Изучите алгоритм составления уравнений реакций
окисления на примере алюминия и метана CH4.

в)
Круговорот кислорода в природе
В природе кислород
образуется в процессе фотосинтеза, который происходит в зелёных растениях на
свету. В целях сохранения кислорода в воздухе вокруг городов и крупных
промышленных центров создаются зоны зелёных насаждений.

г)
Применение кислорода
Применение кислорода
основано на его свойствах: кислород поддерживает горение и дыхание.
В заключении ещё раз отметим важность
кислорода для всего живого на нашей планете такими поэтическими строками:
«
Он всюду и везде:
В
камне, в воздухе, в воде,
Он
и в утренней росе
И небес голубизне…»
