Основные свойства каких аминов выражены сильнее чем у аммиака

Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

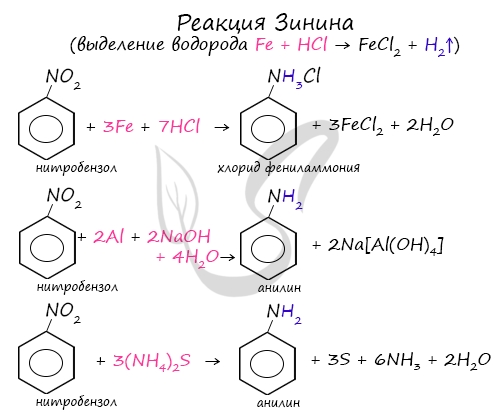
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Амины– азотсодержащие органические вещества,
производные аммиака (NH3), в молекулах
которых один или несколько атомов водорода замещены на углеводородный радикал
(- R или – CnH2n+1)
2. Функциональная
группа:
— NH2 аминогруппа
3. Классификация
аминов:
4. Нахождение
аминов в природе
Амины широко распространены в природе,
так как образуются при гниении живых организмов. Например, с триметиламином вы
встречались неоднократно. Запах селедочного рассола обусловлен именно этим
веществом. Обиходное словосочетание “трупный яд”, встречающиеся в
художественной литературе, связано с аминами.
5. Номенклатура аминов
1. В большинстве случаев названия аминов
образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов
используют приставки ди и три.
(CH3)2NH Диметиламин
2. Первичные амины часто называют как
производные углеводородов, в молекулах которых один или несколько атомов
водорода замещены на аминогруппы -NH2. В этом случае аминогруппа
указывается в названии суффиксами амин (одна группа -NH2),
диамин (две группы -NH2) и т.д. с добавлением цифр,
отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
6. Изомерия аминов
Структурная
изомерия
— углеродного скелета, начиная с С4H9NH2:
— положения аминогруппы, начиная с С3H7NH2:
— изомерия аминогруппы, связанная с
изменением степени замещенности атомов водорода при азоте, т.е. между типами
аминов:
Пространственная
изомерия
Возможна оптическая изомерия, начиная с
С4H9NH2:
7. Получение аминов
Из-за запаха низшие амины долгое время
принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на
воздухе с образованием углекислого газа. Он же синтезировал метиламин и
этиламин.
1842 г Н. Н. Зинин
получил анилин восстановлением нитробензола — в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Feв кислой среде →R-NH2 +3S↓
+6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1).
Промышленный
CH3Br + 2NH3 t, ↑p →
CH3-NH2 + NH4Br
2).
Лабораторный — Действие
щелочей на соли алкиламмония
(получение первичных, вторичных,
третичных аминов):
[R-NH3]Г + NaOH
t → R-NH2 + NaГ
+ H2O
3). Действием
галогеналканов на первичные алифатические и ароматические амины получают
вторичные и третичные амины, в том числе, смешанные.
8. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние
члены алифатического ряда — жидкости, высшие — твердые вещества. Низшие амины
имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому
первичные и вторичные амины образуют межмолекулярные водородные связи
(несколько более слабые, чем Н-связи с участием группы О–Н).
Это объясняет относительно высокую
температуру кипения аминов по сравнению с неполярными соединениями со сходной
молекулярной массой. Например:
Третичные амины не образуют
ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их
температуры кипения ниже, чем у изомерных первичных и вторичных аминов
(триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
По сравнению со спиртами алифатические
амины имеют более низкие температуры кипения (т. кип. метиламина
-6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о
том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность
водородных связей с атомом азота меньше, чем с участием более
электроотрицательного кислорода.
При обычной температуре только низшие
алифатические амины CH3NH2, (CH3)2NH
и (CH3)3N – газы (с запахом аммиака), средние гомологи –
жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных
связей с водой:
Поэтому низшие амины хорошо растворимы в
воде. С увеличением числа и размеров углеводородных радикалов растворимость
аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия
образованию водородных связей. Ароматические амины в воде практически не
растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из
ароматических аминов:
Анилин представляет собой бесцветную
маслянистую жидкость с характерным запахом (т. кип. 184 °С,
т. пл. – 6 °С). На воздухе быстро окисляется и приобретает
красно-бурую окраску. Ядовит.
ВИДЕО:
Изучениефизических свойств анилина
9. Свойства аминов
I. Основные свойства
Для аминов характерны основные свойства,
которые обусловлены наличием не поделённой электронной пары на атоме азота
Алифатические
амины
– более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают
электронную плотность на атоме азота за счет +I-эффекта. По этой причине
электронная пара атома азота удерживается менее прочно и легче взаимодействует
с протоном.
Ароматические
амины
являются более слабыми основаниями, чем аммиак, поскольку неподеленная
электронная пара атома азота смещается в сторону бензольного кольца, вступая в
сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH
————————————————-→
возрастание основных свойств
В растворах оснoвные свойства третичных
аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три
радикала создают пространственные препятствия для сольватации образующихся
аммониевых ионов. По этой же причине основность первичных и вторичных аминов
снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов
имеют щелочную реакцию (амины
реагируют с водой по донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+
+ OH-
ион алкиламмония
ВИДЕО:
Получениегидроксида диметиламмония и изучение его свойств
Анилин с водой не
реагирует и не изменяет окраску индикатора!!!
ВИДЕО:
Изучение среды раствора анилина
Взаимодействие с кислотами
(донорно-акцепторный
механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль — гидросульфатметиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль
— сульфат метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH
→ 2CH3-NH2
↑ + Na2SO4 + H2O
Способность
к образованию растворимых солей с последующим их разложением под действием
оснований часто используют для выделения и очистки аминов, не растворимых в
воде. Например, анилин, который практически не растворяется в воде, можно
растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив
раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном
состоянии.
II. Реакции окисления
Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические
амины легко окисляются даже кислородом воздуха. Являясь в чистом виде
бесцветными веществами, на воздухе они темнеют. Неполное окисление
ароматических аминов используется в производстве красителей. Эти реакции обычно
очень сложны.
ВИДЕО:
Получение диметиламина и его горение
III. Особые свойства анилина
Для анилина характерны реакции как по
аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным
влиянием атомов.
1).
Для анилина характерны свойства бензольного кольца – действие
аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в
кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо
ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и
даже с аммиаком.
С другой
стороны, под влиянием аминогруппы бензольное кольцо становится более активным в
реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина
(белый осадок). Эта реакция может использоваться для качественного и количественного
определения анилина:
ВИДЕО:
Бромированиеанилина
2). Свойства аминогруппы:
С6Н5NН2 +
HCl → [С6Н5NН3 ]+Сl-
хлорид фениламмония
ВИДЕО:
Взаимодействиеанилина с соляной кислотой
ВИДЕО:
Окисление анилина раствором хлорной извести – качественная реакция
Взаимодействие анилина с дихроматом калия – получение красителей
10. Применение
Амины используют при
получении лекарственных веществ, красителей и исходных продуктов для
органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой
кислотой дает полиамидные волокна.
Анилин находит широкое
применение в качестве полупродукта в производстве красителей, взрывчатых
веществ и лекарственных средств (сульфаниламидные препараты).
На данном уроке будет рассмотрена тема «Химические свойства аминов. Основность аминов». Вы узнаете химические свойства аминов на примере простейшего метиламина. Узнаете, что растворы аминов являются основаниями, поскольку они проявляют свойства основности. Сравните их со свойствами других групп химических веществ.
Горение аминов
Наиболее общие свойства всех органических соединений – способность их гореть. Сам аммиак горит и, в общем, легко, но поджечь его не всегда просто. В отличие от него амины загораются легко и горят чаще всего бесцветным или малоокрашенным пламенем. При этом азот аминов традиционно окисляется до молекулярного азота, поскольку оксиды азота малоустойчивы.
Амины загораются на воздухе легче, чем аммиак.
4NH3 + 3O2 = 2N2 + 6H2O;
4С2H5NH2 + 15O2 = 8CO2 + 14H2O + 2N2.
Основность аминов
Основные свойства
Первичные, вторичные и третичные амины обязательно содержат неподеленную электронную пару, как и полагается трехвалентному азоту. То есть амины в растворе проявляют основные свойства, или их растворы являются основаниями. Именно поэтому амины в водном растворе окрашивают лакмус в синий цвет, а фенолфталеин в малиновый. Рис. 1, 2.
Рис. 1. Окраска лакмуса с аминами
Рис. 2. Фенолфталеин с аминами
Благодаря этой электронной паре может образовываться донорно-акцепторная связь с ионом водорода:
С2Н5NH2 + H+ = C2H5NH3+.
Таким образом, подобно аммиаку, амины проявляют свойства оснований:
NH3 + H2O NH4OH;
С2Н5NH2 + H2O C2H5NH3OH.
С кислотами аммиак образует соли аммония, а амины – алкиламмония:
NH3 + HBr = NH4Br (бромид аммония)
С2Н5NH2 + HBr = C2H5NH3Br (бромид этиламмония)
Точно так же, как с кислотами аммиак образует соли аммония, амины образуют соответствующие соли. Эти соли могут быть образованы, как и в случае аммиака, не только при реакции водных растворов, но и в газовой фазе, если амины достаточно летучи.
То есть, если поставить рядом сосуды с концентрированной соляной кислотой или даже с органической летучей, например уксусной, и сосуд с летучим амином, то скоро между ними в пространстве появится нечто напоминающее дым без огня, т. е. будут образовываться кристаллики, соответствующие соли алкиламина. Рис. 3.
Рис. 3. Образование солей алкиламмония
Щелочи вытесняют амины, являющиеся, как и аммиак, слабыми основаниями, из солей алкиламмония:
NH4Cl + KOH = NH3 + KCl + H2O;
CH3NH3Cl + KOH = CH3NH2 + KCl + H2O.
Основные свойства аминов выше, чем у аммиака. Почему? Образование донорно-акцепторной связи с ионом водорода происходит тем легче, чем выше электронная плотность на атоме азота. Углеводородные радикалы содержат много электронов и охотно «делятся» ими с атомом азота (рис. 4).
Рис. 4. Донорно-акцепторная связь с ионом водорода
Однако основные свойства третичных аминов меньше, чем вторичных (сравните константы основности). Почему? В третичном амине атом азота со всех сторон окружен углеводородными радикалами, и его способность вступать в реакции затруднена.
Нуклеофильное замещение
Амины, подобно аммиаку, способны реагировать с галогеналканами, замещая атом галогена:
СН3Br + NH3 = CH3NH2 + HBr;
СH3NH2 + CH3Br = (CH3)2NH + HBr;
(CH3)2NH + CH3Br = (CH3)3N + HBr.
Замещать галоген могут и третичные амины, так что реакция может пойти и дальше. Образуется четвертичная аммониевая соль – бромид тетраметиламмония (CH3)4NBr:
(CH3)3N + CH3Br = (CH3)4N+ + Br-.
Подведение итога урока
На данном уроке была рассмотрена тема «Аминосоединения. Классификация, изомерия, названия и физические свойства». Вы повторили генезис кислородсодержащих органических соединений и вспомнили о некоторых общих свойствах аммиака и воды. Затем рассмотрели, как получить аминосоединения. Изучили их классификацию, изомерию, названия и присущие им физические свойства.
Список литературы
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. – М.: Дрофа, 2008. – 463 с.
- Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. – М.: Дрофа, 2010. – 462 с.
- Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Interneturok.ru (Источник).
- Chemistry.ssu.samara.ru (Источник).
- Химик.ру (Источник).
- Promobud.ua (Источник).
Домашнее задание
- №№ 3, 4 (с. 14) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Сравните свойства аминов предельного ряда и спиртов.
- Напишите уравнения реакций, подтверждающих основность аминов.
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3

Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:

Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) | 2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
 |  |  |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:

Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:

Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Аммиак :NH3 | Первичный амин R–:NH2 |
 |  |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
![]()
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:

1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
![]()
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
![]()
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
![]()
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
![]()
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
![]()
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:

Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.

Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилин
