На основании каких реакций можно доказать восстанавливающие свойства глюкозы

Получение глюкозы
В промышленности
Гидролизкрахмала:
(C6H10O5)n
+ nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории
Из формальдегида
(1861 г
А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе
Фотосинтез:
6CO2 + 6H2O
hν, хлорофилл → C6H12O6 +
6O2
Другие способы
Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза
глюкоза
C12H22O11 + H2O t,H+→ C6H12O6
+ C6H12O6
сахароза глюкоза
фруктоза
Химические свойства глюкозы
I.
Специфические свойства
Важнейшим свойством моносахаридов
является их ферментативное брожение, т.е. распад молекул на осколки под
действием различных ферментов. Брожение происходит в присутствии ферментов,
выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В
зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
3. Маслянокислоеброжение:
C6H12O6 → C3H7COOH
+ 2H2 ↑+ 2CO2↑
II. Свойства
альдегидов
1. Реакция серебряного зеркала:
Видео «Качественная реакция глюкозы саммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2t→ СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
3. Восстановление:
СH2OH(CHOH)4-COH
+ H2t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
III. Свойствамногоатомныхспиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии
газообразного хлористого водорода атом водорода гликозидного гидроксила
замещается на метильную группу.
α — глюкоза | + СH3ОН | HCl(газ)→ | + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько
капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида
меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае
глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт,
образуя комплексное соединение – ярко синего цвета.
Видео
«Качественная реакция глюкозы с гидроксидом меди (II)»
(глюкозат меди (II) – синий раствор)
Применение
Глюкоза является ценным питательным
продуктом. В организме она подвергается сложным биохимическим превращениям в
результате которых образуется диоксид углерода и вода, при это выделяется
энергия согласно итоговому уравнению:
C6H12O6
+ 6O2 → 6H2O
+ 6CO2 + 2800 кДж
Так как глюкоза легко усваивается
организмом, её используют в медицине в качестве укрепляющего лечебного средства
при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и
противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле
(изготовление мармелада, карамели, пряников и т. д.), в текстильной
промышленности в качестве восстановителя, в качестве исходного продукта при
производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных
сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например,
при квашении капусты, огурцов, молока происходит молочнокислое брожение
глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса
недостаточно уплотнена, то под влиянием проникшего воздуха происходит
маслянокислое брожение и корм становится непригоден к применению. На практике
используется также спиртовое брожение глюкозы, например при производстве пива.
ВИДЕО:
Окислениеглюкозы кислородом воздуха в присутствии метеленового голубого
Определениеглюкозы в виноградном соке
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Глюкоза
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
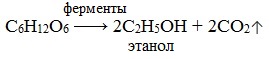
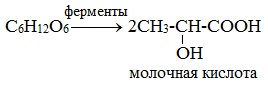
2) Молочнокислое брожение
 (образуется в организмах высших животных при мышечных сокращениях).
(образуется в организмах высших животных при мышечных сокращениях).
3) Маслянокислое брожение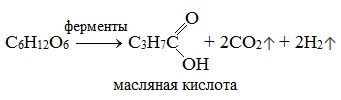
4) Лимоннокислое брожение
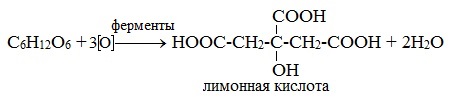
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
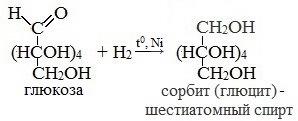
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
1) Окисление бромной водой
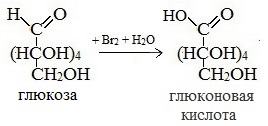
Качественные реакции на глюкозу как альдегид!
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала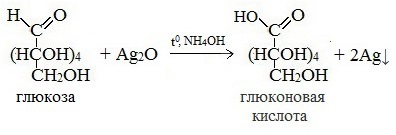
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
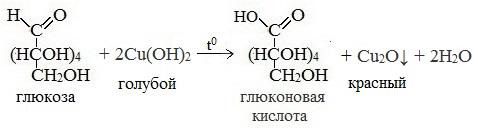
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
1. Взаимодействие с Cu (ОН)2с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
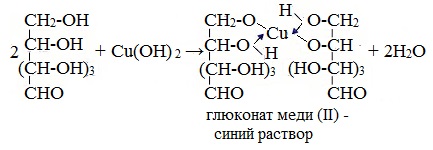
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
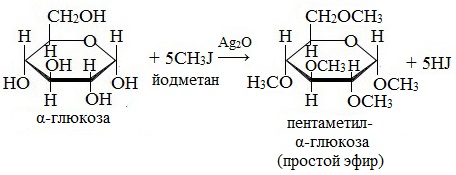
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты: 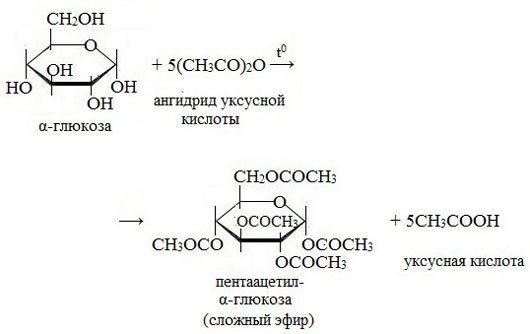
Реакции с участием полуацетального гидроксила
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
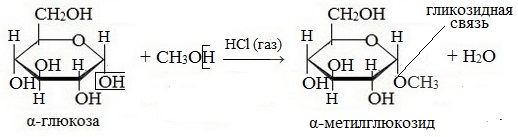
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
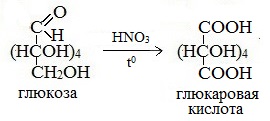
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Углеводы
Моносахариды
Химические свойства глюкозы
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
C6H12O6 → 2СH3-CH-COOH
│
OH
молочная кислота
3. Маслянокислое брожение:
C6H12O6 →C3H7COOH + 2H2 ↑+ 2CO2↑
II. Свойства альдегидов
1. Реакция серебряного зеркала:
СH2OH(CHOH)4-COH + Ag2O t.NH3→СH2OH(CHOH)4-COOH + 2Ag↓
глюконовая кислота
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 +H2O
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2t →СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
3. Восстановление:
СH2OH(CHOH)4-COH + H2t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
42. В водной среде глюкоза и фруктоза находятся в основном в циклической форме, циклизация молекулы происходит за счёт внутримолекулярного взаимодействия альдегидной группы в молекуле глюкозы и кетогруппы в молекуле фруктозы с одной гидроксильной группой этого же моносахарида.
Циклизация молекулы фруктозы:
Циклизация молекулы глюкозы:
α- и β-аномеры зависят от положения гидроксильной группы у первого атома углерода. α-аномеры имеют структуры с ОН-группой внизу плоскости молекулы.
β-аномеры имеют ОН-группу сверху, т.е. над плоскостью цикла.
Восстановление глюкозы происходит при очень высокой температуре до шестиатомного спирта сорбит.
43.
44. Сахароза-дисахарид из группы олигосахаридов, состоящий из двух моносахаридов – α-глюкозы и β-фруктозы.
Химические свойства:
1) Взаимодействие с водой
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
Взаимодействие сахарозы с водой носит название гидролиз, т.е сахароза при нагревании гидролизуется до глюкозы и фруктозы, из которых он состоит.
2) Сахароза не даёт реакции «серебряного зеркала» и не обладает восстановительными свойствами.
3) Окисляется ионами меди, серебра, ртути, образует озазоны и вступает во все реакции, характерные для соединений, содержащих свободные карбонильные группы.
4) Может быть окислена до диоксида углерода и воды. Под действием ферментов дрожжей сахароза даёт этанол.
45. Мальтоза-восстанавливающий дисахарид, образующийся при ферментативном гидролизе крахмала. Состоит из двух остатков D-глюкозы , соединённых гликозидной связью по положениям 1,4.
Целлобиоза
Целлобиоза – 4-(β-глюкозидо-)-глюкоза, дисахарид, состоящий из двух остатков глюкозы, соединённых β-гликозидной связью, основная структурная единица целлюлозы.
Для мальтозы и целлобиозы характерна реакция гидролиза(кислотный или под действием ферментов), расщепляются с образованием 2-х молекул глюкозы:
С12Н22О11 + Н2О → 2С6Н12О6
46. Мальтоза – восстанавливающий дисахарид, образующийся при ферментативном гидролизе крахмала. Состоит из двух остатков D-глюкозы, соединённых гликозидной связью по положениям 1,4.
Мальтоза является восстанавливающим сахаром, т.к. имеет незамещенную полуацетальную гидроксильную группу.
При кипячении мальтозы с разбавленной кислотой и при действии фермента мальтозы гидролизуется (образуется 2 молекулы глюкозы С6Н12О6).
С12Н22О11 + Н2О → 2С6Н12О6
Крахмал-(С6Н10О5)n – полисахариды амилозы и амилопектина, мономером которых является альфа-глюкоза.
Молекулы крахмала неоднородны по размерам.
Крахмал представляет собой смесь линейных и разветвлённых макромолекул.
При действии ферментов или нагревании с кислотами подвергается гидролизу.
(С6Н10О5)n + nH2O →(при участии H2SO4) → nС6Н12О6
Крахмал не даёт реакции серебряного зеркала.
Подобно сахарозе, не восстанавливает гидроксид меди II.
Взаимодействует с йодом(окрашивание в синий цвет).
47. Целлюлоза – углевод, полимер с формулой (С6Н10О5)n, белое твёрдое вещество, нерастворимое в воде, молекула имеет линейное (полимерное) строение, структурная единица – остаток β-глюкозы [С6Н7O2(ОH)3]n.
Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при гидролизе целлюлозы:
(С6Н10O5)n + nH2O → nС6Н12O6
Серная кислота с йодом, благодаря гидролизу, окрашивают целлюлозу в синий цвет. Один же йод – только в коричневый.
Целлюлоза состоит из длинных цепных молекул, образуемых повторяющимися единицами, состоящими из 2х 5-D-глюкозных остатков, соединённых гликозидными связями между первым и четвёртым углеродными атомами.
48. Алифатические нитросоединения – органические соединения, имеющие в своём составе алифатический радикал (предельный и непредельный) и одну или несколько нитрогрупп (NO2). Под нитросоединениями обычно подразумевают С-нитросоединения, в которых нитрогруппа связана с атомом углерода.
Получение:
1.Из галогенпроизводных C2H5Br + AgNO2 → C2H5NO2 +AgBr
2.Нитрование (реакция Коновалова) C2H6 + НNO3 → C2H5NO2 +Н2↑
Химические свойства:
По химическому поведению нитросоединения обнаруживают определённое сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
· Восстановление нитросоединений(реакция Зинина)
R-NO2+ 6H = R-NH2+2H2O
· Реакция конденсации
· Таутомерия нитросоединений
I. Получение глюкозы
1. В промышленности
- Гидролиз крахмала:
(C6H10O5)n + nH2O t,H+→ nC6H12O6
крахмал глюкоза
2. В лаборатории
- Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
3. В природе
- Фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
4. Другие способы
- Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза глюкоза
C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
II. Химические свойства глюкозы
1. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
2. Свойства альдегидов
1. Реакция серебряного зеркала:
Видео-опыт: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
Рис. 1 Cu2O↓
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
3. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
α — глюкоза | + СH3ОН | HCl(газ)→ | + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
Видео-опыт: «Качественная реакция глюкозы с гидроксидом меди (II)»
Рис. 2. Глюконат меди (II)
4. Реакции окисления
Видео-опыт: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео-опыт: “Определение глюкозы в виноградном соке”
Видео-опыт: “Распознавание глюкозы с помощью качественных реакций”
III. Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
IV. Тренажеры
Тренажер №1: “Химические свойства глюкозы”
ЦОРы
Видео: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
Видео: «Качественная реакция глюкозы с гидроксидом меди (II)»
Видео: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео: “Определение глюкозы в виноградном соке”
Видео: “Распознавание глюкозы с помощью качественных реакций”
Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Лактоза С12Н22О11 Мальтоза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
1. Горение
Все углеводы горят до углекислого газа и воды.
Например, при горении глюкозы образуются вода и углекислый газ
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода
C6H12O6 → 6C + 6H2O
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных.
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C6H12O6 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.

Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:

Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»

- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):

- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:

- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи.
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:

- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:

Маслянокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
![]()
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):

Простые эфиры глюкозы получили название гликозидов.
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы):

Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы).
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:

В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться.
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + 6H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.

