На каком свойстве ферментов основан метод электрофореза
Главная →
Энзимология
С лечебной целью ферменты вводят различными путями. Для ЛОР-клиники особый интерес представляет введение ферментов физическими методами. Наиболее часто применяется лекарственный электрофорез в постоянном электрическом поле, а также ингаляции аэрозолей.
Метод электрофореза, в котором сочетается действие фермента и небольших дозировок постоянного тока, имеет ряд преимуществ по сравнению с применением ферментных препаратов парентерально. С помощью электрофореза фермент можно вводить непосредственно в ткань патологического участка с нарушенным кровообращением из-за некрозов, инфильтратов, тромбоза сосудов, а также создать более высокие концентрации фермента в пораженном участке при меньших суммарных его дозах. При их введении методом электрофореза обычно не возникает местных и общих аллергических реакций, которые часто наблюдаются при парентеральном введении ферментов, так как последние, являясь для организма чужеродными белками, обладают антигенными свойствами.
Ниже изложены главным образом биохимические обоснования для применения ферментов методом электрофореза. Имеющиеся в руководствах сведения по электрофорезу часто не учитывают физико-химических свойств ферментов — веществ белковой природы, которые очень чувствительны к влиянию рН среды, температуры, ионов тяжелых металлов и другим воздействиям. Поэтому при лечебном применении ферментов методом электрофореза следует учитывать их устойчивость в растворителе, подвижность и полярность, что важно для правильного выбора полюса, с которого будет вводиться фермент.
Для определения полярности необходимо помнить, что ферменты — амфотерные электролиты: в их молекулах имеются свободные карбоксильные группы (-СООН), обладающие кислыми свойствами, благодаря отщеплению ионовводорода, и аминогруппы (-NH2), способные присоединять ионы водорода, приобретая при этом положительный заряд и придавая молекуле фермента щелочные свойства. Степень ионизации этих групп зависит от рН среды: карбоксильные группы полностью диссоциируют в щелочной среде, а аминные — в кислой. Значение рН среды, при котором белковая молекула имеет одинаковое количество положительно и отрицательно заряженных групп, называется ИЭТ. В ИЭТ белки, будучи электронейтральными, неподвижны в электрическом поле постоянного тока. Белки, как и другие лекарственные вещества, могут быть введены методом электрофореза не в молекулярной форме, а в виде ионов. Поэтому электрофорез должен проводиться в растворах с рН, удаленных от ИЭТ вводимого фермента в более кислую или щелочную зону. При этом белок приобретает положительный либо отрицательный заряд. Так, при добавлении водородных ионов (подкисление) подавляется диссоциация карбоксильных групп, белок приобретает катионные свойства и движется к катоду. Подщелачивание среды ведет к диссоциации —NH+ групп, которые превращаются в недиссоциированную форму (—NH2), что приводит к преобладанию в белковой молекуле отрицательно заряженных групп. В этом случае белок находится в форме аниона и передвигается в электрическом поле к аноду. Таким образом, при варьировании рН среды один и тот же фермент можно вводить как с положительного, так и с отрицательного полюса.
ИЭТ белков-ферментов может находиться в кислой, нейтральной, щелочной и даже сильно щелочной среде. ИЭТ трипсина, альфа-химотрипсина, рибонуклеазы, лизоцима, трасилола (ингибитор протеолитических ферментов белковой природы) лежит в щелочной зоне, следовательно, в среде с рН ниже ИЭТ (в частности, рН 7) эти белки являются катионами и должны вводиться с положительного полюса. В более щелочной зоне, чем ИЭТ, они приобретают отрицательный заряд и полюсом их введения становится катод. Ферменты гиалуронидаза и дезоксирибонуклеаза, у которых ИЭТ находится в кислой среде, при рН 7 заряжаются отрицательно и должны вводиться с катода. При значениях рН среды ниже ИЭТ они будут иметь положительный заряд и поэтому их следует вводить с анода.
Трипсин и альфа-химотрипсин в нейтральной среде (рН 7) обладают свойствами катиона и передвигаются к катоду, причем быстрее мигрирует трипсин, ИЭТ которого по сравнению с альфа-химотрипсином (ИЭТ 8,3-9,1) сдвинута в более щелочную сторону (рН 10,1). При смешивании двух ферментов их электрофоретические свойства не изменяются.
Для ферментного электрофореза важно правильно выбрать растворитель, чтобы рН раствора был отдален от ИЭТ, при этом белковая молекула будет обладать более высокой электрофоретической подвижностью. Например, при введении трипсина с ИЭТ 10,1 в качестве растворителя можно использовать физиологический раствор или еще лучше буферный раствор с рН 4-5. С другой стороны, при выборе растворителя необходимо знать рН стабильности фермента, который часто не соответствует рН-оптимуму действия. Так, точка максимальной устойчивости для трипсина находится при рН 2,3 а для химотрипсина — при рН 3-3,5, а рН-оптимум действия для двух протеиназ лежит при рН 7-8.
При повышении рН среды происходит автолиз этих ферментов, которым особенно выражен при рН свыше 8, при этом белок денатурируется с потерей энзиматической активности.
В предварительных опытах, предшествующих электрофорезу, необходимо также проверить влияние гальванического тока на активность используемого энзима. Кроме того, нужно помнить, что ряд катионов и анионов влияют на биологическую активность ферментов. Например, активность дезоксирибонуклеазы тормозится хлористым натрием, а ионы магния или марганца активируют белковые соединения.
Таким образом, применению электрофореза ферментов должны предшествовать тщательные исследования, включающие установление полярности, выбор растворителя и концентрации фермента.
Важной и нерешенной проблемой электрофореза ферментов является выяснение возможности проникновения белковых молекул с молекулярной массой в тысячи раз большей, чем неорганических ионов, в пораженную ткань через кожу и слизистую оболочку. Лишь при воспалении (повышении сосудистой проницаемости) могут создаваться условия для проникновения ферментов с помощью гальванического тока. Трудную задачу представляет собой количественное определение в тканях вводимых с помощью постоянного тока ферментов, поскольку их концентрация при этом незначительна.
Необходимо учитывать также, что ферменты быстро связываются с белками тканей, которые резко снижают их энзиматическую активность.
Другая новая область энзимофизиотерапии — применение ингибиторов ферментов в отоларингологии. Ингибиторы протеолитических ферментов показаны при тех патологических процессах, в генезе которых лежит активация протеолиза и фибринолиза.
В ЛОР-клинике до настоящего времени практически используется только эпсилон-АКК в качестве препарата, тормозящего процессы фибринолиза, а также как антиаллергическое средство.
Большие перспективы открываются при применении природных ингибиторов, которые в отличие от синтетических обладают более широким спектром действия: они подавляют активность многих протеолитических ферментов, активирующихся при ряде воспалительных и аллергических процессов. В частности, при реакции антиген — антитело освобождаются протеолитические ферменты, которые катализируют образование кининов.
Так как ингибиторы имеют белковоподобную природу, перед введением необходимо выяснить их полярность и электрофоретическую подвижность в различных растворителях. Поскольку выпускаемые препараты содержат примеси других неактивных белковоподобных соединений, которые могут изменять электрофоретические свойства, клиническому применению предшествовали биохимические исследования ингибиторов протеиназ. При растворении ингибиторов в физиологическом растворе (рН 6) пантрипин электрофоретически гетерогенен, он состоит из нескольких фракций, движущихся в сторону как анода, так и катода. Контрикал разделяется при электрофорезе на две катодные фракции; трасилол передвигается к катоду в виде одной фракции. Возникает вопрос, где же находится активная фракция? Предлагается определять специфическую ингибиторную активность во всех фракциях по их способности тормозить активность протеиназ. Опыты показали, что основная часть ингибирующей активности (примерно 90%) содержится в быстрой катодной фракции, в анодной фракции активность ингибитора не обнаружена.
На основании этих опытов можно сделать вывод о том, что ингибитор следует растворять в физиологическом растворе и вводить с положительного полюса.
Ингибиторы можно применять для лечения ряда аллергических и воспалительных заболеваний ЛОР-органов путем назального электрофореза. Учитывая дефицит препаратов ингибиторов, а также необходимость использования больших дозировок при парентеральном введении, в терапии регионарных воспалительных и аллергических процессов более целесообразно и экономически выгодно вводить ингибиторы непосредственно в очаг поражения с помощью постоянного тока (гальванический ток не влияет на активность ингибиторов). Так могут быть созданы более высокие концентрации ингибиторов в пораженных тканях, особенно при повышенной проницаемости слизистых оболочек, наблюдающейся при воспалительных и аллергических реакциях.
Приведенные материалы показывают, что успех ферментной физиотерапии в существенной мере зависит от знания физико-химических свойств используемых энзимов, а также возможности проникновения экзогенных ферментов в очаг поражения, длительности их пребывания и выведения их организма. Здесь еще много неясных вопросов, которые могут быть разрешены клиницистами совместно с физиотерапевтами, биохимиками, фармакологами, физиологами. Необходимо внедрение новых методов количественного определения ферментов в тканях, включая применение флюорохромированных ферментов, флюорохромированных антител, а также радиоактивных индикаторов для прослеживания вхождения ферментов в клетки и определения их активности в пораженных тканях.
Среди физических методов терапии ферментами ЛОР-заболеваний наряду с электрофорезом важное значение имеет введение энзимов и их ингибиторов с помощью ингаляций их аэрозолей. Использование ферментов путем ингаляций аэрозолей основано на том, что они могут непосредственно взаимодействовать со специфическими субстратами очага повреждения и вызывать их расщепление.
Методы электрофореза и ингаляций аэрозолей ферментов нашли применение в терапии заболеваний ЛОР-органов — ларингитов, ринитов, воспалений полости рта и глотки, стенозирующих ларинготрахеитов, бронхитов у детей и т.д.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 октября 2019;
проверки требуют 6 правок.
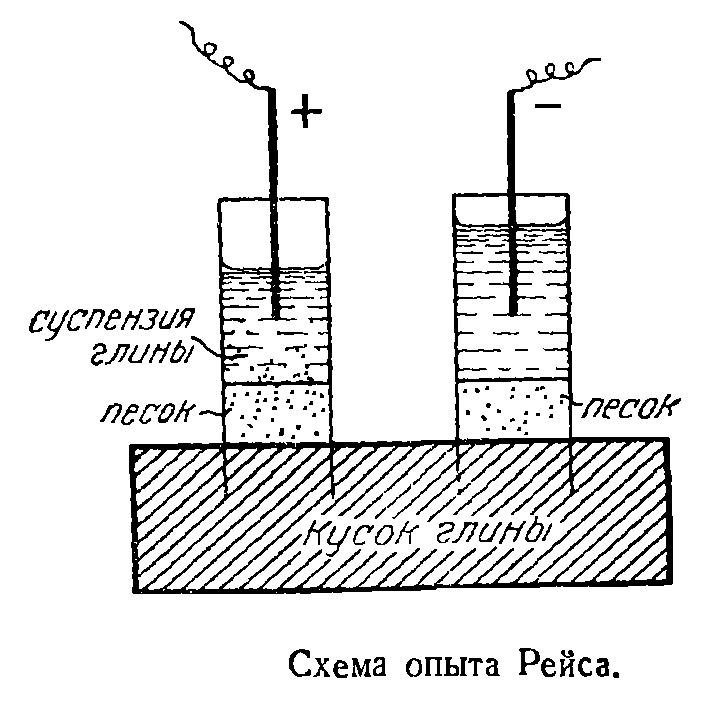
В кусок влажной глины вдавлены две стеклянные трубки и в полученные таким способом стаканчики насыпан хорошо промытый мелкий песок, а затем налита вода. После того, как в стаканчики с совершенно прозрачной над песком водой были опущены электроды от вольтова столба и подан ток, Рейс наблюдал, что в трубку с положительным электродом сквозь слой песка начали проникать частички глины, а вода постепенно снизу вверх мутнела. Перенос частиц глины к положительному электроду, свидетельствующий об их отрицательном заряде, есть проявление электрофореза, а понижение уровня воды в том стаканчике, куда проникала глина, и повышение уровня воды в другом стаканчике есть проявление электроосмоса
Электрофоре́з (от электро- + др.-греч. φορέω «переношу») — это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновение в углубления и поры. Различают две разновидности электрофореза: катафорез — когда обрабатываемая поверхность имеет отрицательный электрический заряд (то есть подключена к отрицательному контакту источника тока, являясь катодом) и анафорез — когда заряд поверхности положительный.
Электрофорез применяют в лечебных целях в физиотерапии. В химической промышленности он используется для осаждения дымов и туманов, для изучения состава растворов и др. Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
Одним из методов для подтверждения подлинности анализируемого белка и наличия белковых примесей в исследуемом образце является электрофоретическое исследование. Электрофорез занимает центральное место среди методов исследования белков и нуклеиновых кислот. Метод позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как размеры, пространственная конфигурация, вторичная структура и электрический заряд.
Трехмерная структура белков поддерживается за счет дисульфидных связей. При обработке всех образцов дитиотрейтолом DTT (восстанавливающие условия) происходит денатурация белков в результате разрыва S-S связей, разворачивания полипептидной цепи и последующего связывания с додецилсульфатом натрия SDS.
Обратное электрофорезу явление — эффект Дорна: появление разности потенциалов между находящимися на различных высотах слоями столба жидкости, в которой осаждаются взвешенные частицы.
Электрофорез в медицине (физиотерапии)[править | править код]
В советской и Российской физиотерапии электрофорез — это процедура с недоказанной эффективностью, назначаемая при легких или неопасных заболеваниях. Лечебное вещество наносится на прокладки электродов и под действием электрического тока, по замыслу физиотерапевта, должно проникнуть в организм через кожные покровы (в терапии, неврологии, травматологии и др.), но в действительности этого не происходит[1]. Даже в случае, если небольшая часть лекарственного средства через повреждения на коже все же попадет в тело, глубже кожи, дальше к больному органу, оно не попадет, так как, проникнув в капилляры и сосуды, будет унесено в системный кровоток[2]. Электрический ток также оказывает миостимулирующее и кратковременное легкое анестезирующее действие. Также применяется для введения лекарственных средств в слизистые оболочки (в стоматологии, ЛОР, гинекологии и др.) и влияет на физиологические и патологические процессы непосредственно в месте введения.
Преимущества лечебного электрофореза:
- кратковременный легкий обезболивающий эффект.
- при назначении ипохондрикам, возможен успокаивающий эффект от самого факта проведения процедуры.
Противопоказания к проведению электрофореза: острые гнойные воспалительные заболевания, СН II—III степени, ГБ III стадии, лихорадка, тяжёлая форма бронхиальной астмы, дерматит или нарушение целостности кожи в местах наложения электродов, злокачественные новообразования. Учитываются противопоказания для лечебного вещества.
Вещества, используемые при электрофорезе, физиотерапевты делят на:
- отрицательно заряженные, наносимые на катод (бромиды, йодиды, никотиновая кислота и другие);
- положительно заряженные, наносимые на анод (ионы металлов — магния, калия, кальция);
- наносимые на катод или анод (гумизоль, жижа из морской соли (бишофит) и другие).
Исследования, проведенные по международным стандартам доказательной медицины, не подтверждают эффективность электрофореза, например, при лечении латеральной эпикондилалгии («теннисного локтя»)[3] и тендинита [4].
Электрофорез в научных исследованиях[править | править код]
В биохимии и молекулярной биологии электрофорез используется для разделения макромолекул — белков и нуклеиновых кислот (а также их фрагментов). Различают множество разновидностей этого метода (см. статью Электрофорез белков). Этот метод находит широчайшее применение для разделения смесей биомолекул на фракции или индивидуальные вещества и используется в биохимии, молекулярной биологии, клинической диагностике, популяционной биологии (для изучения генетической изменчивости) и др.
Гальванофорез[править | править код]
Гальванофорез — введение ионов веществ (например: лекарств) в электропроводную среду посредством приложения электродвижущей силы (ЭДС). В стоматологии — гальванофорез — специальный метод для долговременной дезинфекции системы корневых каналов зубов.
Отличие от электрофореза — для создания ЭДС применяются не стационарные источники тока, а мобильные устройства малых размеров. Такие устройства могут быть например установлены в зуб пациенту на несколько дней или недель. В течение продолжительного периода гальванический элемент обеспечивает прохождение слабого электрического тока (в несколько микроампер) через ткани, в которые намечена доставка определённых веществ.
Электрофорез — процедура, которую проводят в медицинском кабинете. При гальванофорезе пациент находится вне лечебного учреждения.
Гальванофорез осуществляется при помощи специальных устройств, устанавливаемых в корневые каналы зубов. Устройства могут быть выполнены в виде штифта либо другой конструкции из металлов, составляющих гальванопару.
Устройства для гальванофореза создают ЭДС в среде корневых каналов, которая предварительно доводится до нужных значений концентрацией определённых ионов путём введения в корневые каналы специальных препаратов (например, гидроксид меди-кальция). Под воздействием электрических полей, создаваемых гальваническими штифтами (устройствами для гальванофореза), гидроокись меди-кальция (ГМК) мигрирует в микроканалы и дентинные трубочки, вызывает протеолиз находящихся там микробных тел и остатков клеточных структур больного зуба. ГМК присоединяет к иону меди серу, отнимая её у аминокислот белков, находящихся в структурах тканей зубов.
В отличие от распространённого метода депофореза, гальванофорез не требует применения дорогостоящих приборов, не вызывает боли в процессе его применения и создаёт в тканях зубов антимикробную среду на длительное время.
Аппараты, применяемые для электрофореза[править | править код]
В СССР и в современной РФ для электрофореза широко применяются аппараты «Поток-1».
Примечания[править | править код]
- ↑ Манихин, Сергей Анатольевич. 5 доказательств, что советская физиотерапия не работает // Letidor : [сайт]. — М. : ООО «Рамблер Групп», 2018. — Ноябрь.
- ↑ Meals, Roy A. Phonophoresis Versus Placebo for Carpal Tunnel Syndrome : [англ.] // The clinical journal of pain. — 2013. — Vol. 29, no. 10 (October). — P. 924. — [Письмо хирурга-ортопеда из Калифорнийского университета в Лос-Анджелесе в редакцию журнала «Клинический журнал боли» с критикой предположительного механизма действия электро и фонофореза. Пер. назв.: Фонофорез против плацебо в лечении синдрома запястного канала]. — ISSN 1536-5409. — doi:10.1097/AJP.0b013e318285bb43. — PMID 23446078.
- ↑ Bisset, L. A systematic review and meta-analysis of clinical trials on physical interventions for lateral epicondylalgia : [англ.] / L. Bisset, A. Paungmali, B. Vicenzino … [] // British Journal of Sports Medicine. — 2005. — Vol. 39, no. 07 (June). — P. 411−422. — [Пер. назв.: Систематический обзор и мета-анализ клинических испытаний физических воздействий при латеральной эпикондилалгии («теннисном локте»)]. — ISSN 1473-0480. — doi:10.1136/bjsm.2004.016170. — PMID 15976161. — PMC 1725258.
- ↑ Andres, Brett M. Treatment of Tendinopathy : What Works, What Does Not, and What is on the Horizon : [англ.] : [арх. 5 апреля 2019] / Brett M. Andres, George A. C. Murrell // Clinical orthopaedics and related research : J. — 2008. — Vol. 466, no. 07 (April). — [Пер. назв.: Лечение тендопатии (боли в сухожилиях): что работает, что не работает и что на горизонте]. — ISSN 1528-1132. — doi:10.1007/s11999-008-0260-1. — PMID 18446422.
См. также[править | править код]
- Потенциал седиментации
- Электрофорез ДНК
- Электрофорез белков
- Электрофорез в полиакриламидном геле
- Фонофорез
- Ионофорез
- Электроосмос
- Электронная бумага
- Изотахофорез
- Капиллярный электрофорез
- Иммуноэлектрофорез
- Изоэлектрическое фокусирование
