На каких свойствах белков основан метод аффинной хроматографии
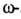
Изучение физико-химических свойств, химического состава и структуры возможно только при исследовании очищенного белкового препарата. Для выделения и фракционирования индивидуальных белков используются: высаливание, осаждение органическими растворителями, гельфильтрация, электрофорез, ионообменная хроматография, аффинная хроматография.
Высаливание белковосновано на зависимости растворимости белка от свойств среды. В дистиллированной воде протеины растворяются хуже, чем в слабых растворах солей, так как низкие концентрации ионов поддерживают их гидратные оболочки. Но при высоких концентрациях соли молекулы белка теряют гидратные оболочки, агрегируют и образуется осадок. После удаления соли белки вновь переходят в раствор, сохраняя нативные свойства и конформацию.
Изменение растворимости при различных концентрациях соли и рН среды используется для выделения индивидуальных белков. Чаще всего для высаливания белков используют растворы сульфата аммония разной концентрации.
Осаждение белков из раствора без их денатурации осуществляют с помощью дегидрирующих агентов — органических растворителей (этанол, ацетон).
Гель-фильтрацияоснована на разделении белков по величине и форме молекулы. Разделение проводят в хроматографических колонках, заполненных гранулами пористого геля (сефадекса, агарозы), в буферном растворе с определенным значением рН. Гранулы геля проницаемы для белков благодаря внутренним каналам (порам) с определенным средним диаметром, размер которого зависит от типа геля (сефадекс G-25, G-200 и т.д.). Смесь белков вносят в колонку и затем вымывают (элюируют) буферным раствором с определенным значением рН. Крупные молекулы белка не проникают в поры геля и перемещаются с высокой скоростью вместе с растворителем. Мелкие молекулы низкомолекулярной примеси (соли) или другого белка удерживаются гранулами геля и вымываются из колонки медленнее (рис. 1.29). На выходе колонки раствор (элюат) собирают в виде отдельных фракций.
Рис. 1.29. Разделение белков методом гель-фильтрации
Электрофорезоснован на свойстве заряженных молекул белка перемещаться в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие при данном значении рН суммарный отрицательный заряд, двигаются к аноду, а положительный — к катоду. Электрофорез проводят на разных носителях: бумаге, крахмальном геле, полиакриламидном геле и др. Скорость перемещения зависит от заряда, массы и формы молекул белка. После завершения электрофореза зоны белков на носителе окрашивают специальными красителями (рис. 1.30, А).
Разрешающая способность электрофореза в геле выше, чем на бумаге, так при электрофорезе белков сыворотки крови на бумаге выделяют 5 фракций (альбумины, α1-, α2-, β-, γ-глобулины), а в полиакриламидном геле — до 18 фракций (рис. 1.30, Б).
Рис. 1.30. Электрофореграмма белков сыворотки крови здорового человека
А— электрофореграмма белков сыворотки крови на бумаге;
Б— количество белков плазмы разных фракций.
I — γ-глобулины; II — β-глобулины; III — а2-глобулины;
IV — а1-глобулины; V — альбумины
Ионообменная хроматографияоснована на разделении белков, отличающихся суммарным зарядом. Раствор белка с определенным значением рН пропускают через хроматографическую колонку, заполненную твердым пористым сорбентом, при этом часть белков задерживается в результате электростатического взаимодействия. В качестве сорбента используют ионообменные вещества: анионообменники (содержащие катионные группы) для выделения кислых белков; катионообменники (содержащие анионные группы) для выделения основных белков.
При пропускании белка через колонку прочность его связывания с ионообменником зависит от величины заряда, противоположного заряду сорбента. Адсорбированные на ионообменном сорбенте белки элюируют буферными растворами с различной концентрацией соли и рН, получая разные фракции белков.
Аффинная хроматографияоснована на специфичности связывания белка с лигандом, присоединенным к твердому носителю. В качестве лиганда используются субстраты ферментов, простетические группы холопротеинов, антигены и т.д. При пропускании через колонку смеси белков к лиганду присоединяется только комплементарный протеин (рис. 1.31, А), все остальные выходят вместе с раствором. Адсорбированный белок элюируется раствором с другим значением рН (рис. 1.31, Б). Этот метод высокоспецифичен и позволяет получать белковые препараты высокой степени очистки.
Выделение и очистка белка обычно проходят в несколько стадий с использованием различных методов. Последовательность стадий подбирается эмпирическим путем и может различаться для разных протеинов. Высокая степень очистки белков очень важна как при использовании их в качестве лекарственных препаратов (гормон инсулин и т.д.), так и при диагностике различных заболеваний по изменению белкового состава тканей, крови, слюны и др.
Набор белков в клетках различных органов взрослого человека индивидуален и поддерживается относительно постоянным на протяжении жизни. Специализированные ткани могут содержать специфические белки, например гемоглобин в эритроцитах, актин и миозин в мышцах, родопсин в сетчатке глаза, разные типы коллагена в костной и соединительной тканях. Некоторые белки содержатся во многих тканях, но в разных количествах. Отдельные изменения состава
Рис. 1.31. Разделение белков методом аффинной хроматографии
А— связывание выделяемого белка со специфическим лигандом, присоединенным к нейтральному носителю; Б— получение раствора индивидуального белка
белков тканей и крови возможны и связаны прежде всего с режимом питания, составом пищи, физической активностью человека.
При заболеваниях белковый состав крови и клеток тканей может существенно изменяться, часто развивается недостаточность какого-либо белка либо снижение его активности — протеинопатия.Поэтому определение выраженных изменений белкового состава крови и тканей используется для диагностики различных заболеваний в клинических исследованиях.
АФФИННАЯ ХРОМАТОГРАФИЯ (от лат. affinis — родственный) (биоспецифич.
хроматография, хроматография по сродству), метод очистки и разделения белков,
основанный на их избират. взаимод. с лигандом, ковалентно связанным с инертным
носителем. В кач-ве лигандов используют соед., взаимод. к-рых с разделяемыми
в-вами основано на биол. ф-ции последних. Так, при разделении ферментов
(для чего преим. и применяется аффинная хроматография) лигандами служат их субстраты, ингибиторы
или коферменты. Главная особенность, к-рая обусловливает высокую эффективность
аффинной хроматографии, состоит в том, что разделение основано на различии не физ.-хим. признаков
молекулы (заряда, формы и размера), а специфич. функциональных св-в, отличающих
данный фермент от множества др. биополимеров.
Неподвижная фаза в аффинной хроматографии представляет собой специально получаемый сорбент,
построенный обычно по схеме: носитель — соединяющее звено («ножка») — специфич.
лиганд. Носителем служит чаще всего сефарозапроизводное агарозы, имеющее
поперечные сшивки. Присоединение к ней лиганда или «ножки», содержащих,
как правило, аминогруппу, осуществляется после активации сефарозы бромцианом:
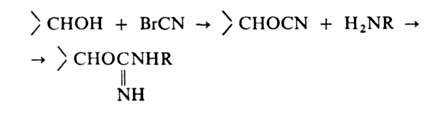
Содержание лиганда колеблется от 0,1 до 10 мкмоль на 1 г влажного сорбента.
Сефароза, однако, малоустойчива к действию ряда хим. в-в и микроорганизмов.
Более стабильны макропористые неорг. носители (кремнезем, стекло) и
орг. полимеры. Если лиганд присоединяется непосредственно к носителю, эффективность
специфич. взаимод. с ферментом заметно снижается вследствие пространств.
затруднений. «Ножка», как правило, устраняет стерич. препятствия, отдаляя
лиганд от носителя. Как и носитель, она должна быть инертной и не влиять
на процессы в ходе аффинной хроматографии, чего, однако, не всегда удается достигнуть. Напр.,
присоединение «ножки» по приведенной выше р-ции приводит к образованию
катионной группировки изомочевины, и сорбент приобретает св-ва анионита.
В кач-ве «ножки» используют обычно ди- и полиамины, аминокислоты,
аминокислоты,
пептиды, олигосахариды.
Лигандами могут служить субстраты (напр., крахмал или гликоген при разделении
амилаз), однако их превращ. в ходе аффинной хроматографии, катализируемое разделяемым ферментом,
постоянно изменяет св-ва сорбента. Поэтому, как правило, применяют аналоги
субстратов, устойчивые к дальнейшему превращ., т.е. ингибиторы ферментов.
Так, для выделения протеиназ используют не расщепляемые ими пептиды D-аминокислот.
Эффективны прир. ингибиторы ферментов, напр. пепстатин — ингибитор аспартильных
протеиназ. Иногда применяют лиганды, связывающие большие группы родственных
ферментов (в частности, киназы и дегидрогеназы). Примеры таких «группоспецифич.»
лигандов-антрахиноновые красители, аналоги никотинамидадениндину-клеотида.
Известны лиганды (напр., производные фенилборной к-ты), имитирующие
при взаимод. с ферментом структуру переходного комплекса с субстратом.
Такие лиганды эффективны при выделении сериновых гидролаз.
Разделение в аффинной хроматографии обычно проводят на хроматографич. колонках; иногда
разделяемую смесь помещают в сосуд с сорбентом и выдерживают до полного
связывания исследуемого компонента. Затем сорбент (в колонке или сосуде)
промывают буферным р-ром для удаления несвязавшихся в-в, после чего десорбируют
исследуемый компонент. Десорбция (элюция) последнего обычно достигается
повышением ионной силы, изменением рН буферного р-ра или добавлением в
него орг. р-рителя, что ослабляет взаимод. лиганд — фермент. Более избирательна
десорбция р-ром лиганда.
Помимо ферментов, методом аффинной хроматографии можно выделять также токсины, рецепторы,
ингибиторы, транспортные белки и др. биологически активные в-ва. Высокой
избирательностью отличается т. наз. иммуносорбция, при к-рой в кач-ве лиганда
используют антитела, обладающие специфичностью к выделяемым белкам; особенно
эффективны моноклональные антитела.
Для разделения белков применяется также ряд др. аналогичных методов.
Т. наз. ковалентная хроматография основана на избират. образовании и последующем
расщеплении ковалентных связей между выделяемым в-вом и носителем, напр.
между белком с SH-группами и ртуть-орг. производными агарозы. Применяется
также лигандообменная хроматография, при к-рой ферменты связываются через
функциональный ион металла с комплексоном, иммобилизованным на носителе.
Получила распространение гидрофобная хроматография, при к-рой сорбент (напр.,
фенилсефароза), содержащий гидрофобные группировки, вкрапленные в гидрофильную
матрицу, взаимодействует с гидрофобными участками, содержащимися на пов-сти
белков. Нередко при этом наблюдаются также ионообменные взаимод., как,
напр., при использовании в качестве сорбента алкиламиносефароз.
Избират. выделение гликопротеинов обеспечивают иммобилизованные на носителях
лектины — белки, специфически взаимодействующие с концевыми моносахаридными
звеньями углеводных цепей. Иммобилизованные субъединицы ряда белков с четвертичной
структурой м. б. использованы для извлечения этих белков из сложных смесей
вследствие специфич. межсубъединичных контактов. Аффинная хроматография сформировалась как
метод в кон. 60-х гг. 20 в.
===
Исп. литература для статьи «АФФИННАЯ ХРОМАТОГРАФИЯ»: Туркова Я.. Аффинная хроматография, пер. с англ.. М., 1980.
В. М. Степанов.
Страница «АФФИННАЯ ХРОМАТОГРАФИЯ» подготовлена по материалам химической энциклопедии.

После экстрагирования белков, т.е. перевода в растворенное состояние, приступают к разделению, фракционированию смеси белков на индивидуальные белки. Для этого применяют методы:
• высаливания;
• осаждения органическими растворителями;
• тепловой денатурации;
• хроматографии;
• гель фильтрации;
• ультрацентрифугирования;
• кристаллизации;
• электрофореза;
• распределения в двухфазных системах.
Как известно, растворение белков в воде связано с гидратацией отдельных молекул, что приводит к образованию вокруг белковой молекулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. Эта вода (гидратной оболочки) отличается от чистого растворителя. Растворы белков отличаются крайней неустойчивостью и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому добавление к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также воздействие физических факторов (нагревание, облучение) приводит к дегидратации молекул и их выпадению в осадок.
Высаливание. При высаливании белка солями щелочных и щелочноземельных металлов белок обычно не теряет способности растворяться вновь в воде после удаления солей (диализом, гельфильтрацией). Например: глобулины выпадают в осадок при 50% насыщения, а альбумины при 100% насыщении раствора сульфатом аммония. При выпадении белковой молекулы в осадок, большое значение имеет не только концентрация солей, но температура и ионная сила раствора.
Методы хроматографии. Метод хроматографии, разработанный в 1903 г. русским ученым М.В. Цветом, основан на способности пигментов (или др. веществ) специфически связываться с адсорбентом, заключенном в колонке; используются также процессы сорбции и десорбции. Применяют различные методы хроматографии – адсорбционную, распределительную, ионнобменную.
Адсорбционная хроматография – адсорбентом является активированный уголь, окись алюминия или кремния. Широко применяются для разделения белков и другие вещества.
Распределительная хроматография. При этом твердая фаза является только носителем для жидкой фазы. Виды: хроматография на бумаге, на колонках, где в качестве стационарной фазы применяют крахмал или селикагель.
Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен.
Различают анионообменники (органические основания и амины), катионообменники, содержащие фенольные, сульфо-и карбоксильные группы. Широко применяются диэтиламиноэтилцеллюлоза (ДЭАЭ-целлюлоза), триэтиламиноэтил (ТЭАЭ) и аминоэтил (АЭ) — целлюлозы.
Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков со специфическими веществами, закрепленными на носителе. В качестве носителя применяют активированную бромцианом сефарозу (CNBr-сефароза), к которой присоединяют различные вещества – субстрат, кофермент, антиген, гормон и т.д. Метод позволяет одноэтапно получить высокоочищенный препарат белка.
Гель-фильтрация или метод молекулярных сит – широко применяется для очистки белков от примесей.
С помощью сефадекса (декстран, полисахарид микробного происхождения, обработанный для разделения белков) можно разделить белки с разной молекулярной массой, так как зерна сефадекса разных номеров имеют различного размера поры, в которые способны проникать белки с определенной молекулярной массой.
Метод электрофореза основан на различии в скорости движения белков в электрическом поле, которая определяется величиной заряда белка при определенных рН и ионной силе раствора. Первоначально метод разработан А. Тизелиусом, в последнее время широко применяется метод зонального электрофореза белков на различных носителях – на бумаге (целлюлозе), крахмале, в полиакриламидном геле. Метод диск-электрофореза в полиакриламидном геле позволяет получить до 50 фракций белков, т.е. имеет очень высокую разрешающую способность.
Изоэлектрическое фокусирование белков – на амфолинах позволяет выделить индивидуальные белки в препаративных количествах.
Ультрацентрифугирование в градиенте плотности сахарозы или хлорида цезия получило широкое применение для очистки, а также определения молекулярной массы белков по константе седиментации (единица Сведберга — S).
Очистка белка от низкомолекулярных примесей достигается методом диализа, гельфильтрации, кристаллизации, ультрафильтрации. При диализе применяют полупроницаемые мембраны (целлофан, коллоидиновая пленка), диаметр пор которой варьирует в широких пределах. Белки, как правило, через такую мембрану не диффундируют, а низкомолекулярные вещества легко проходят через нее в окружающую среду. Наилучшие результаты дают методы гельфильтрации и ультрафильтрации, т.к. дают возможность, как освободиться от низкомолекулярных компонентов, так и сконцентрировать белки.
Методы определения гомогенности белков. Наилучшие результаты дают ультрацентрифугирование в градиенте плотности, диск-электрофорез в полиакриламидном геле, иммунохимические методы.
Аффинная хроматография — это разновидность адсорбционной хроматографии. Основной особенностью аффинной хроматографии является наличие комплементарности между иммобилизованным на матрице лигандом и вторым партнером пары взаимодействующих компонентов, который извлекается из смеси с другими, не комплементарными лиганду веществами. Использование высокоизбирательного взаимодействия позволяет за одну стадию достичь очень высокой степени очистки искомого вещества. Аффинное взаимодействие является нековалентным и может быть ослаблено путем изменения рН, ионной силы раствора, введения в раствор веществ, препятствующих образованию комплементарных связей. Важными преимуществами аффинной хроматографии являются: высокая избирательность, эффект концентрирования искомого вещества на аффинной матрице и освобождение от гидролитических ферментов. Аффинная очистка часто позволяет сохранить нативную структуру вещества.Чаще всего лиганд иммобилизуют на матрице ковалентно. Для закрепления лиганда матрица должна быть предварительно активирована, то есть на поверхности частиц носителя должны быть созданы реакционноспособные группы. Наиболее распространенный способ активации — создание на поверхности матрицы электрофильных групп, способных к взаимодействию с нуклеофильными группами лиганда. При этом процесс иммобилизации лиганда сводится к его инкубации с активированной матрицей. Следует отметить, что скорость протекания реакции сильно зависит от pH среды. В иммунохимии применяют как иммобилизацию антигена на матрице, так и присоединение к матрице антител. Разновидность аффинной хроматографии, в которой в качестве иммобилизованного лиганда используются антитела, носит название иммуноаффинной хроматографии.
Одним из наиболее распространенных носителей, используемых в биохимии уже на протяжении нескольких десятилетий, является сефароза — специальным образом обработанные сферические гранулы агарозы. Известно несколько способов активации сефарозы, однако чаще других применяют метод активации сефарозы с использованием бромциана (BrCN). Преимуществом данного метода является простота, высокая устойчивость образующихся связей, стабильность сефарозы в довольно широком диапазоне рН (от 2,0 до 12,0). Относительная жесткость и крупные размеры частиц сефарозы позволяют использовать такие носители в колоночной хроматографии при достаточно высоких скоростях подачи растворов на колонку.
Активацию сефарозы осуществляют в процессе инкубации раствора бромциана с водной суспензией сефарозы. Бромциан взаимодействует с гидроксильными группами сефарозы, в результате чего образуется имидокарбонат, содержащий электрофильный атом углерода. Помимо этого в ходе реакции образуется неактивный карбамат, не способный к реакции с нуклеофильными боковыми группами аминокислот. При взаимодействии имидокарбоната с нуклеофильными группами, прежде всего с e-аминогруппами лизина, происходит образование прочной ковалентной связи белка с активированной матрицей через остаток изомочевины или N-замещенного карбамата (рис. 1). Реакция активации матрицы бромцианом проходит только в щелочной среде с выделением бромистоводородной кислоты, для нейтрализации которой требуется постоянное добавление щелочи к реакционной смеси. Реакция бромциана с гидроксилами матрицы экзотермична, поэтому ее проводят на ледяной бане.

Рис. 1. Схема иммобилизации белка на BrCN-активированной сефарозе
Нужно заметить, что активными нуклеофилами, кроме e-аминогрупп лизина, являются также SH-группа цистеина, концевые аминогруппы белков и ОН-группа тирозина (по активности данные группы располагаются в следующем порядке: SH- ˃ концевая NH2- ˃ OH-группа тирозина). С другой стороны, тиоэфиры менее прочны, чем кислородные эфиры, а последние уступают по прочности амидным связям.
В иммунохимических исследованиях с использованием BrCN-активированной сефарозы готовят два типа носителей — носители с иммобилизованными антигенами и носители с иммобилизованными антителами. Первые имеют ограниченное применение и используются, как правило, для выделения из сыворотки иммунного животного (содержащей антитела различной специфичности) пула антител, специфичных только к белку, иммобилизованному на носителе. Гораздо чаще на практике используют носители с иммобилизованными антителами. Основная область применения таких носителей — экстракция из грубой смеси макромолекул (как правило — белков). Высокая специфичность антител к антигену позволяет за короткий промежуток времени и в одну стадию получить высокоочищенный (с чистотой до 95-99%) препарат белка.

Рис. 2. Установка для колоночной иммуноаффинной хроматографии
Экстракцию исследуемого белка из смеси осуществляют двумя способами. Первый, используемый, как правило, для получения препаративных количеств белка, основан на применении метода колоночной иммуноаффинной хроматографии (Рис.2). В зависимости от поставленной задачи аффинным носителем заполняют колонки различного диаметра (от нескольких миллиметров до метра) и через эти колонки пропускают белковый раствор, содержащий исследуемый антиген. Большинство макромолекул проходит через частицы носителя не задерживаясь, в то время как между антителами, иммобилизованными на носителе, и антигеном, содержащимся в растворе, образуется иммунный комплекс (рис. 3). После отмывки носителя от не связавшихся белков иммунный комплекс разрушают, пропуская через носитель растворы с низкими (pH 2,0 — pH 4,0) или высокими (pH 11,0 — pH 12,0) значениями рН, либо растворы с высокой ионной силой (2М NaCl), либо растворы, содержащие хаотропные соединения (KSCN). При этом исследуемый белок элюируют с носителя, его собирают и переводят в оптимальный для хранения данного белка буфер.

Рис. 3. Схема хроматографии белков на аффинном носителе.
Второй способ экстракции исследуемого белка из сложной смеси — иммунопреципитация, или экстракция в объеме. Иммунопреципитацию используют при работе с незначительными (нано- и микрограммы) количествами вещества. При этом объем аффинного носителя обычно не превышает сотен микролитров, а объем исследуемого образца — нескольких миллилитров. То есть, иммунопреципитацию используют в тех ситуациях, когда из-за малого количества исследуемого вещества оказывается технически сложным создать адекватную по размерам аффинную колонку.

Рис. 4. Схема аффинного выделения белков методом иммунопреципитации.
При проведении иммунопреципитации образец, содержащий исследуемый белок, некоторое время инкубируют (при постоянном перемешивании) с частицами носителя. В процессе инкубации образуется иммунный комплекс, и исследуемый белок переходит из раствора на частицы носителя. После этого носитель осаждают, как правило, центрифугированием, супернатант отбрасывают, а иммунный комплекс, иммобилизованный на частицах носителя, разрушают добавлением тех же растворов, что и в случае с колоночной хроматографией (рис. 4). Также иммунный комплекс может быть разрушен ДСН-содержащим буфером, который используют для приготовления образца белка при проведении ДСН электрофореза. Такой буфер используют в том случае, если в дальнейшем планируют изучать экстрагированный белок с использованием метода электрофореза в денатурирующих условиях, или методом вестерн-блоттинг. Однако при использовании данного метода элюции белка следует учитывать, что повторное использование носителя становится невозможным из-за денатурации иммобилизованных антител. Кроме того, исследуемый образец помимо целевого белка будет содержать легкие и тяжелые цепи иммуноглобулинов.
Версия для печати
