На каких химических свойствах хлора основано его использование на практике
В периодической системе химических элементов Д.И. Менделеева хлор находится в 3 периоде, VII группе, главной (А) подгруппе. Из уроков химии мы знаем, что в эту группу входят элементы с самой высокой окислительной активностью. В электронном облаке хлора находится 17 электронов и до завершения внешнего электронного уровня ему нахватает лишь одного электрона. Любыми способами он пытается отнять его у других элементов, чем и объясняется его высокая химическая активность. Вот что знают о хлоре большинство учеников среднестатистических школ. Однако, данный элемент куда интереснее.
Начнем с истории открытия хлора, но прежде чем перейти к ней позвольте напомнить, что одно из важнейших соединений хлора – хлороводород, было получено Джозефом Пристли в 1772 г. Спустя всего пару лет после этого события (в 1774 г) шведский химик Карл Вильгельм Шееле получил хлор при взаимодействие пиролюзита с вышеупомянутой хлороводородной кислотой:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
При этом, Шееле отметил схожесть запаха хлора с запахом царской водки (смесью концентрированных азотной и соляной кислот, взятых в соотношение 1:3) и способность вещества взаимодействовать с золотом (Au) и киноварью (HgS). Так же он обратил внимание на его отбеливающие свойства. Однако, он не догадался отнести хлор к простым веществам.
Спустя время, элементарную природу хлора доказал Гемфри Дэви, путем электролиза поваренной соли:
2NaCl = 2Na + Cl2
В 1811 г. Дэви предложил назвать данный элемент «хлорином». Но спустя всего год Ж. Гей-Люссак «сократил» его название до хлора. Кстати, в том же 1811 г. физик Иоган Швейгер предлагал для хлора название «галоген» (рождающий соли), но в итоге это название закрепилось за всеми элементами VII А группы.
В 1826 г. атомная масса хлора была с высокой точностью определена шведским химиков Йенсом Якобом Берцелиусом. Она отличается от современных данных буквально на 0.1%. В настоящее время в школьных учебниках химии, под хлором указывается масса 35.453.
При нормальных условиях, хлор — токсичный удушливый газ, который при попадании в лёгкие вызывает ожог лёгочной ткани и удушье. Не удивительно, что он стал одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. Так, 22 апреля 1915 года немецкая армия распылила 168 тонн хлора около бельгийского города Ипр. Атака началась в 17:00, когда подул слабый восточный ветер. Газ стал двигаться в сторону французских позиций в виде облаков желтовато-зелёного цвета. Надо заметить, что немецкая пехота также пострадала от газов и, не имея достаточного подкрепления, не смогла использовать полученное преимущество до прихода британско-канадских сил. Антанта сразу заявила о том, что Германия нарушила принципы международного права, однако Берлин парировал это заявление тем, что Гаагская конвенция запрещала лишь применение химических снарядов, но не газов.
Отрывок, демонстрирующий разрушительный потенциал хлора во всех красках: «Вся зелень в крепости и в ближайшем районе по пути движения газов была уничтожена, листья на деревьях пожелтели, свернулись и опали, трава почернела и легла на землю, лепестки цветов облетели. Все медные предметы на плацдарме крепости — части орудий и снарядов, умывальники, баки и прочее — покрылись толстым зелёным слоем окиси хлора; предметы продовольствия, хранящиеся без герметической укупорки — мясо, масло, сало, овощи, оказались отравленными и непригодными для употребления.» С.А. Хмельков «Борьба за Осовец»
Интересно, что во Второй мировой войне, несмотря на то, что обе противоборствующие стороны обладали большими запасами отравляющих газов, в боевых действиях они не использовались.
Сейчас, во многих городах водоочистные системы применяют хлор для уничтожения бактерий, путем хлорирования воды. При этом в среднем на один миллион частей воды используют четыре-пять частей хлора. Это количество безвредно для человека, однако иногда после этого вода может иметь привкус хлора.
Для хлорирования воды на водопроводных очистных станциях используется жидкий хлор. При введении хлора в воду образуются хлорноватистая и соляная кислоты:
Cl2 + Н2О = НСlO + НСl
Далее происходит диссоциация образовавшейся хлорноватистой кислоты:
НСlO = Н(+) + СlO(-)
Получающиеся в результате диссоциации хлорноватистой кислоты гипохлоритные ионы СlO(-) обладают наряду с недиссоциированными молекулами хлорноватистой кислоты бактерицидным свойством.
Сумму Сl2, НСlO, СlO(-) называют свободным активным хлором.
Количество активного хлора, необходимого для обеззараживания воды, должно определяться не по количеству болезнетворных бактерий, а по всему количеству органических веществ и микроорганизмов (а также и неорганических веществ, способных к окислению), которые могут находиться в хлорируемой воде.
Еще несколько интересных фактов, о хлоре:
— На долю хлора приходится 0.025% от общего числа атомов земной коры.
— Минимальная потребность человека в хлоре составляет около 800 мг. В сутки.
— Очень много получаемого на производстве хлора уходит на изготовление отбеливающих средств. Особенно широко хлор применяется при отбеливание бумаги.
— Хлор входит в состав многих гербицидов (веществ, для уничтожения сорных растений) и дезинфицирующих средств, так как он хорошо уничтожает микробы.
— Жидкий хлор является одним из самых сильных изоляторов электричества. Он проводит ток почти в миллиард раз хуже, чем дистиллированная вода.
Превратить хлор в жидкость можно с помощью охлаждения и высокого давления.
Если вам понравилась данная статья ставьте лайки и не забывайте подписываться на мой канал. А если вы знаете дополнительные интересные факты о хлоре, обязательно напишите об этом в комментариях.
До новых встреч!
Êàòàëîã ñòàòåé /
Õëîð
· Èñòîðèÿ îòêðûòèÿ õëîðà
· Ðàñïðîñòðàíåíèå â ïðèðîäå
· Èçîòîïíûé ñîñòàâ
· Ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà
· Õèìè÷åñêèå ñâîéñòâà
· Ñïîñîáû ïîëó÷åíèÿ
· Õðàíåíèå õëîðà
· Ñòàíäàðòû êà÷åñòâà õëîðà
· Ïðèìåíåíèå
· Áèîëîãè÷åñêàÿ ðîëü
· Òîêñè÷íîñòü
· Ëèòåðàòóðà
· Áëèçêèå ñòàòüè
· Êîììåíòàðèè
· Ïðèìå÷àíèÿ
· Îôèöèàëüíûé ñàéò
·
Õëîð ïðèìåíÿþò âî ìíîãèõ îòðàñëÿõ ïðîìûøëåííîñòè, íàóêè è áûòîâûõ íóæä:

Îêîííûé ïðîôèëü, èçãîòîâëåííûé èç õëîðñîäåðæàùèõ ïîëèìåðîâ

Ãëàâíûì êîìïîíåíòîì îòáåëèâàòåëåé ÿâëÿåòñÿ Ëàáàððàêîâà âîäà (ãèïîõëîðèò íàòðèÿ)
-  ïðîèçâîäñòâå ïîëèâèíèëõëîðèäà, ïëàñòèêàòîâ, ñèíòåòè÷åñêîãî êàó÷óêà, èç êîòîðûõ èçãîòàâëèâàþò: èçîëÿöèþ äëÿ ïðîâîäîâ, îêîííûé ïðîôèëü, óïàêîâî÷íûå ìàòåðèàëû, îäåæäó è îáóâü, ëèíîëåóì è ãðàìïëàñòèíêè, ëàêè, àïïàðàòóðó è ïåíîïëàñòû, èãðóøêè, äåòàëè ïðèáîðîâ, ñòðîèòåëüíûå ìàòåðèàëû. Ïîëèâèíèëõëîðèä ïðîèçâîäÿò ïîëèìåðèçàöèåé âèíèëõëîðèäà, êîòîðûé ñåãîäíÿ çà÷àñòóþ ïîëó÷àþò èç ýòèëåíà ñáàëàíñèðîâàííûì ïî õëîðó ìåòîäîì ÷åðåç ïðîìåæóòî÷íûé 1,2-äèõëîðýòàí.
- Îòáåëèâàþùèå ñâîéñòâà õëîðà èçâåñòíû ñ äàâíèõ âðåìåí, íå ñìîòðÿ íà òî, ÷òî íå ñàì õëîð «îòáåëèâàåò», à àòîìàðíûé êèñëîðîä, êîòîðûé îáðàçóåòñÿ ïðè ðàñïàäå õëîðíîâàòèñòîé êèñëîòû: Cl2 + H2O → HCl + HClO → 2HCl + O. Ýòîò ñïîñîá îòáåëèâàíèÿ òêàíåé, áóìàãè, êàðòîíà èñïîëüçóåòñÿ óæå íåñêîëüêî âåêîâ.
- Ïðîèçâîäñòâî õëîðîðãàíè÷åñêèõ èíñåêòèöèäîâ âåùåñòâ, óáèâàþùèõ âðåäíûõ äëÿ ïîñåâîâ íàñåêîìûõ, íî áåçîïàñíûå äëÿ ðàñòåíèé. Íà ïîëó÷åíèå ñðåäñòâ çàùèòû ðàñòåíèé ðàñõîäóåòñÿ çíà÷èòåëüíàÿ ÷àñòü ïðîèçâîäèìîãî õëîðà. Îäèí èç ñàìûõ âàæíûõ èíñåêòèöèäîâ ãåêñàõëîðöèêëîãåêñàí (çà÷àñòóþ íàçûâàåìûé ãåêñàõëîðàíîì). Ýòî âåùåñòâî âïåðâûå ñèíòåçèðîâàíî åù¸ â 1825 ã. Ôàðàäååì, íî ïðàêòè÷åñêîå ïðèìåíåíèå íàøëî òîëüêî ÷åðåç 100 ñ ëèøíèì ëåò â 30-õ ãîäàõ ÕÕ ñòîëåòèÿ.
- Èñïîëüçîâàëñÿ êàê áîåâîå îòðàâëÿþùåå âåùåñòâî, è êðîìå ýòîãî äëÿ ïðîèçâîäñòâà äðóãèõ áîåâûõ îòðàâëÿþùèõ âåùåñòâ: èïðèò, ôîñãåí.
- Äëÿ îáåççàðàæèâàíèÿ âîäû «õëîðèðîâàíèÿ». Íàèáîëåå ðàñïðîñòðàí¸ííûé ñïîñîá îáåççàðàæèâàíèÿ ïèòüåâîé âîäû; îñíîâàí íà ñïîñîáíîñòè ñâîáîäíîãî õëîðà è åãî ñîåäèíåíèé óãíåòàòü ôåðìåíòíûå ñèñòåìû ìèêðîîðãàíèçìîâ êàòàëèçèðóþùèå îêèñëèòåëüíî-âîññòàíîâèòåëüíûå ïðîöåññû. Äëÿ îáåççàðàæèâàíèÿ ïèòüåâîé âîäû ïðèìåíÿþò: õëîð, äâóîêèñü õëîðà, õëîðàìèí è õëîðíóþ èçâåñòü. ÑàíÏèÍ 2.1.4.1074-01 [1] óñòàíàâëèâàåò ñëåäóþùèå ïðåäåëû (êîðèäîð) äîïóñòèìîãî ñîäåðæàíèÿ ñâîáîäíîãî îñòàòî÷íîãî õëîðà â ïèòüåâîé âîäå öåíòðàëèçîâàííîãî âîäîñíàáæåíèÿ 0.3 0.5 ìã/ë. Ðÿä ó÷¸íûõ è äàæå ïîëèòèêîâ â Ðîññèè êðèòèêóþò ñàìó êîíöåïöèþ õëîðèðîâàíèÿ âîäîïðîâîäíîé âîäû. Àëüòåðíàòèâîé ÿâëÿåòñÿ îçîíèðîâàíèå. Ìàòåðèàëû, èç êîòîðûõ èçãîòîâëåíû âîäîïðîâîäíûå òðóáû, ïî ðàçíîìó âçàèìîäåéñòâóþò ñ õëîðèðîâàííîé âîäîïðîâîäíîé âîäîé. Ñâîáîäíûé õëîð â âîäîïðîâîäíîé âîäå ñóùåñòâåííî ñîêðàùàåò ñðîê ñëóæáû òðóáîïðîâîäîâ íà îñíîâå ïîëèîëåôèíîâ: ïîëèýòèëåíîâûõ òðóá ðàçëè÷íîãî âèäà, â òîì ÷èñëå ñøèòîãî ïîëèýòèëåíà, áîëüøèå èçâåñòíîãî êàê ÏÅÊÑ (PEX, PE-X).  ÑØÀ äëÿ êîíòðîëÿ äîïóñêà òðóáîïðîâîäîâ èç ïîëèìåðíûõ ìàòåðèàëîâ ê èñïîëüçîâàíèþ â âîäîïðîâîäàõ ñ õëîðèðîâàííîé âîäîé âûíóæäåíû áûëè ïðèíÿòü 3 ñòàíäàðòà: ASTM F2023 ïðèìåíèòåëüíî ê òðóáàì èç ñøèòîãî ïîëèýòèëåíà (PEX) è ãîðÿ÷åé õëîðèðîâàííîé âîäå, ASTM F2263 ïðèìåíèòåëüíî ê ïîëèýòèëåíîâûì òðóáàì âñåì è õëîðèðîâàííîé âîäå è ASTM F2330 ïðèìåíèòåëüíî ê ìíîãîñëîéíûì (ìåòàëëîïîëèìåðíûì) òðóáàì è ãîðÿ÷åé õëîðèðîâàííîé âîäå.  ÷àñòè äîëãîâå÷íîñòè ïðè âçàèìîäåéñòâèè ñ õëîðèðîâàííîé âîäîé ïîëîæèòåëüíûå ðåçóëüòàòû äåìîíñòðèðóþò ìåäíûå âîäîïðîâîäíûå òðóáû.
-  ïèùåâîé ïðîìûøëåííîñòè çàðåãèñòðèðîâàí â êà÷åñòâå ïèùåâîé äîáàâêè E925.
-  õèìè÷åñêîì ïðîèçâîäñòâå ñîëÿíîé êèñëîòû, õëîðíîé èçâåñòè, áåðòîëåòîâîé ñîëè, õëîðèäîâ ìåòàëëîâ, ÿäîâ, ëåêàðñòâ, óäîáðåíèé.
-  ìåòàëëóðãèè äëÿ ïðîèçâîäñòâà ÷èñòûõ ìåòàëëîâ: òèòàíà, îëîâà, òàíòàëà, íèîáèÿ.
- Êàê èíäèêàòîð ñîëíå÷íûõ íåéòðèíî â õëîð-àðãîííûõ äåòåêòîðàõ.
Ìíîãèå ðàçâèòûå ñòðàíû ñòðåìÿòñÿ îãðàíè÷èòü èñïîëüçîâàíèå õëîðà â áûòó, â òîì ÷èñëå ïîòîìó, ÷òî ïðè ñæèãàíèè õëîðñîäåðæàùåãî ìóñîðà îáðàçóåòñÿ çíà÷èòåëüíîå êîëè÷åñòâî äèîêñèíîâ.
Хлор потребляется прежде всего химической промышленностью для производства различных органических хлорпроизводных, идущих для получения пластических масс, синтетических каучуков, химических волокон, растворителей, инсектицидов и т.п. В настоящее время более 60% мирового производства хлора используется для органического синтеза. Помимо этого хлор используют для производства соляной кислоты, хлорной извести, хлоратов и других продуктов. Значительные количества хлора идут в металлургию для хлорирования при переработке полиметаллических руд, извлечения золота из руд, а также его используют в нефтеперерабатывающей промышленности, в сельском хозяйстве, в медицине и санитарии, для обезвреживания питьевой и сточных вод, в пиротехнике и ряде других областей народного хозяйства. В результате развития сфер использования хлора, главным образом благодаря успехам органического синтеза, мировое производство хлора составляет более 20 млн. т/год.
Основные примеры применения и использования хлора во всевозможных отраслях науки, промышленности и бытовых нужд:
1. в производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан [8].
CH2=CH2+Cl2=>CH2Cl-CH2Cl
CH2Cl-CH2Cl=> CH2=CHCl+HCl

1) в качестве отбеливающего средства (хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты по реакции: Cl2 + H2O > HCl + HClO > 2HCl + O*).
2) в производстве хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений (альдрин, ДДТ, гексахлоран). Один из самых важных инсектицидов — гексахлорциклогексан (C6H6Cl6).
3) используется как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт (C4H8Cl2S), фосген (CCl2O).
4) для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы [8]. Для обеззараживания питьевой воды применяют: хлор (Cl2), двуокись хлора (ClO2), хлорамин (NH2Cl) и хлорную известь (Ca(Cl)OCl).
5) в пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
6) в химическом производстве каустической соды (NaOH) (применяется в производстве искусственного шелка, в мыловаренной промышленности), соляной кислоты (HCl), хлорной извести, бертолетовой соли (KClO3), хлоридов металлов, ядов, лекарств, удобрений.
7) в металлургии для производства чистых металлов: титана, олова, тантала, ниобия [8].
TiO2 + 2C + 2Cl2 => TiCl4 + 2CO;
TiCl4 + 2Mg => 2MgCl2 + Ti (при Т=850°С)
8) в качестве индикатора солнечных нейтрино в хлор-аргонных детекторах (Идея «хлорного детектора» для регистрации солнечных нейтрино была предложена известным советским физиком академиком Б. Понтекорво и осуществлена американским физиком Р. Девисом и его сотрудникми. Уловив нейтрино ядро изотопа хлора с атомным весом 37, превращается в ядро изотопа аргона-37, при этом образуется один электрон, который можно зарегистрировать.).
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов (глобальные экотоксиканты, обладающие мощным мутагенным, иммунодепрессантным, канцерогенным, тератогенным и эмбриотоксическим действием. Они слабо расщепляются и накапливаются как в организме человека, так и в биосфере планеты, включая воздух, воду, пищу).
История хлора
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Общая характеристика хлора
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).

Нахождение в природе
Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Физические и химические свойства
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
Суточная потребность в хлоре
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Продукты питания богатые хлором
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.

Взаимодействие с другими
Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Признаки нехватки хлора
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаки избытка хлора
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Полезные свойства хлора и его влияние на организм
Хлор в организме человека:
- регулирует водный и кислотно-щелочной баланс,
- выводит жидкость и соли из организма в процессе осморегуляции,
- стимулирует нормальное пищеварение,
- нормализует состояние эритроцитов,
- очищает печень от жира.

Применение хлора в жизни
Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.

- Обозначение — Cl (Chlorum);
- Период — III;
- Группа — 17 (VIIa);
- Атомная масса — 35,4527;
- Атомный номер — 17;
- Радиус атома = 99 пм;
- Ковалентный радиус = 102±4 пм;
- Распределение электронов — 1s22s22p63s23p5;
- t плавления = 100,95°C;
- t кипения = -34,55°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 3,16/-;
- Степень окисления: +7, +6, +5, +4, +3, +1, 0, -1;
- Плотность (н. у.) = 3,21 г/см3;
- Молярный объем = 18,7 см3/моль.
- Уравнения окислительно-восстановительных реакций хлора (метод электронного баланса).
- Уравнения окислительно-восстановительных реакций хлора (метод полуреакций).
- Соляная кислота
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название «хлорин», которое вскоре было сокращено до «хлор» с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название «галоген», но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре — на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору «по барабану» с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений — хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35Cl — 75,5%
- 37Cl — 24,5%
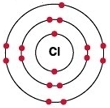
Хлор в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «17», относится к галогенам (См. Атомы элементов 17(VIIa) группы (галогены)).

Рис. Строение атома хлора.
Электронная конфигурация атома хлора — 1s22s22p63s23p5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора — этот раствор называется хлорная вода.
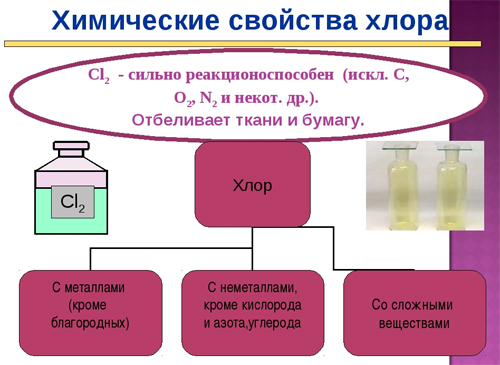
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
Cl2+H2 = 2HCl
- с металлами с образованием хлоридов:
Cl20+2Na0 = 2Na+1Cl-1
3Cl20+2Fe0 = 2Fe+3Cl3-1 - с неметаллами, менее электроотрицательными, чем хлор:
Cl20+S0 = S+2Cl2-1
3Cl20+2P0 = 2P+3Cl3-1 - с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой — кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
Cl20+H2O ↔ HCl-1+HCl+1O
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
HClO = HCl+[O] — реакция идет на свету
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
Cl20+2NaOH = NaCl-1+NaCl+1O+H2O
- при нагревании:
3Cl20+6KOH = 5KCl-1+KCl+5O3+3H2O
- с бромидами металлов:
Cl3+2KBr = 2KCl+Br2↓
- с йодидами металлов:
Cl2+2KI = 2KCl+I2↓
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор «охотно» вступает в реакции с органическими веществами:
Cl2+CH4 → CH3Cl+HCl
Cl2+C6H6 → C6H5Cl+HCl
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
- Уравнения окислительно-восстановительных реакций хлора (метод электронного баланса).
- Уравнения окислительно-восстановительных реакций хлора (метод полуреакций).
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде — водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде — натрий):
2NaCl+2H2O → Cl2↑+H2↑+2NaOH
2NaCl → Cl2↑+2Na
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
4HCl-1+Mn+4O2 = Mn+2Cl2+Cl20↑+2H2O
2KMn+7O4+16HCl-1 = 2KCl+2Mn+2Cl2+5Cl20↑+8H2O
KCl+5O3+6HCl-1 = KCl+3Cl20↑+3H2O
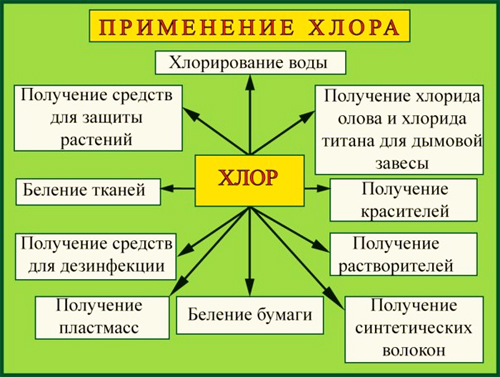
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
См. далее: Соляная кислота
