Какой тип реакции характерен для свойств алканов обусловленных связью

Àëêàíû – íàñûùåííûå (ïðåäåëüíûå) óãëåâîäîðîäû. Ïðåäñòàâèòåëåì ýòîãî êëàññà ÿâëÿåòñÿ ìåòàí (ÑÍ4). Âñå ïîñëåäóþùèå ïðåäåëüíûå óãëåâîäîðîäû îòëè÷àþòñÿ íà ÑÍ2– ãðóïïó, êîòîðàÿ íàçûâàåòñÿ ãîìîëîãè÷åñêîé ãðóïïîé, à ñîåäèíåíèÿ – ãîìîëîãàìè.
Îáùàÿ ôîðìóëà – ÑnH2n+2.

Ñòðîåíèå àëêàíîâ.
Êàæäûé àòîì óãëåðîäà íàõîäèòñÿ â sp3 – ãèáðèäèçàöèè, îáðàçóåò 4 σ— ñâÿçè (1 Ñ-Ñ è 3 Ñ-Í). Ôîðìà ìîëåêóëû â âèäå òåòðàýäðà ñ óãëîì 109,5°.
Ñâÿçü îáðàçóåòñÿ ïîñðåäñòâîì ïåðåêðûâàíèÿ ãèáðèäíûõ îðáèòàëåé, ïðè÷åì ìàêñèìàëüíàÿ îáëàñòü ïåðåêðûâàíèÿ ëåæèò â ïðîñòðàíñòâå íà ïðÿìîé, ñîåäèíÿþùåé ÿäðà àòîìîâ. Ýòî íàèáîëåå ýôôåêòèâíîå ïåðåêðûâàíèå, ïîýòîìó σ-ñâÿçü ñ÷èòàåòñÿ íàèáîëåå ïðî÷íîé.
Èçîìåðèÿ àëêàíîâ.
Äëÿ àëêàíîâ ñâîéñòâåííà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà. Ïðåäåëüíûå ñîåäèíåíèÿ ìîãóò ïðèíèìàòü ðàçëè÷íûå ãåîìåòðè÷åñêèå ôîðìû, ñîõðàíÿÿ ïðè ýòîì óãîë ìåæäó ñâÿçÿìè. Íàïðèìåð,

Ðàçëè÷íûå ïîëîæåíèÿ óãëåðîäíîé öåïè íàçûâàþòñÿ êîíôîðìàöèÿìè.  íîðìàëüíûõ óñëîâèÿõ êîíôîðìàöèè àëêàíîâ ñâîáîäíî ïåðåõîäÿò äðóã â äðóãà ñ ïîìîùüþ âðàùåíèÿ Ñ-Ñ ñâÿçåé, ïîýòîìó èõ ÷àñòî íàçûâàþò ïîâîðîòíûìè èçîìåðàìè. Ñóùåñòâóåò 2 îñíîâíûå êîíôîðìàöèè – «çàòîðìîæåííîå» è «çàñëîíåííîå»:

Èçîìåðèÿ óãëåðîäíîãî ñêåëåòà àëêàíîâ.
Êîëè÷åñòâî èçîìåðîâ âîçðàñòàåò ñ óâåëè÷åíèåì ðîñòà óãëåðîäíîé öåïè. Íàïðèìåð ó áóòàíà èçâåñòíî 2 èçîìåðà:

Äëÿ ïåíòàíà – 3, äëÿ ãåïòàíà – 9 è ò.ä.
Åñëè ó ìîëåêóëû àëêàíà îòíÿòü îäèí ïðîòîí (àòîì âîäîðîäà), òî ïîëó÷èòñÿ ðàäèêàë:

Ôèçè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ – Ñ1-Ñ4 – ãàçû, Ñ5-Ñ17 – æèäêîñòè, à óãëåâîäîðîäû ñ êîëè÷åñòâîì àòîìîâ óãëåðîäà áîëüøå 18 – òâåðäûå âåùåñòâà.
Ñ ðîñòîì öåïè ïîâûøàåòñÿ òåìïåðàòóðà êèïåíèÿ è ïëàâëåíèÿ. Ðàçâåòâëåííûå àëêàíû èìåþò áîëåå íèçêèå òåìïåðàòóðû êèïåíèÿ, ÷åì íîðìàëüíûå.
Àëêàíû íåðàñòâîðèìû â âîäå, íî õîðîøî ðàñòâîðÿþòñÿ â íåïîëÿðíûõ îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ. Ëåãêî ñìåøèâàþòñÿ äðóã ñ äðóãîì.
Ïîëó÷åíèå àëêàíîâ.
Ñèíòåòè÷åñêèå ìåòîäû ïîëó÷åíèÿ àëêàíîâ:
1. Èç íåíàñûùåííûõ óãëåâîäîðîäîâ — ðåàêöèÿ «ãèäðèðîâàíèÿ» ïðîòåêàåò ïîä âîçäåéñòâèåì êàòàëèçàòîðà (íèêåëü, ïëàòèíà) è ïðè òåìïåðàòóðå:

2. Èç ãàëîãåíïðîèçâîäíûõ – ðåàêöèÿ Âþðöà: âçàèìîäåéñòâèå ìîíîãàëîãåíàêëêàíîâ ñ ìåòàëëè÷åñêèì íàòðèåì, â ðåçóëüòàòå ÷åãî ïîëó÷àþòñÿ àëêàíû ñ óäâîåííûì ÷èñëîì óãëåðîäíûõ àòîìîâ â öåïè:

3. Èç ñîëåé êàðáîíîâûõ êèñëîò. Ïðè âçàèìîäåéñòâèè ñîëè ñ ùåëî÷è, ïîëó÷àþòñÿ àëêàíû, êîòîðûå ñîäåðæàò íà 1 àòîì óãëåðîä ìåíüøå ïî ñðàâíåíèþ ñ èñõîäíîé êàðáîíîâîé êèñëîòîé:

4. Ïîëó÷åíèå ìåòàíà.  ýëåêòðè÷åñêîé äóãå â àòìîñôåðå âîäîðîäà:
Ñ + 2Í2 = ÑÍ4.
 ëàáîðàòîðèè ìåòàí ïîëó÷àþò òàê:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
Õèìè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ àëêàíû – õèìè÷åñêè èíåðòíûå ñîåäèíåíèÿ, îíè íå ðåàãèðóþò ñ êîíöåíòðèðîâàííîé ñåðíîé è àçîòíîé êèñëîòîé, ñ êîíöåíòðèðîâàííîé ùåëî÷üþ, ñ ïåðìàíãàíàòîì êàëèÿ.
Óñòîé÷èâîñòü îáúÿñíÿåòñÿ ïðî÷íîñòüþ ñâÿçåé è èõ íåïîëÿðíîñòüþ.
Ñîåäèíåíèÿ íå ñêëîííû ê ðåàêöèÿõ ðàçðûâà ñâÿçè (ðåàêöèÿ ïðèñîåäèíåíèÿ), äëÿ íèõ ñâîéñòâåííî çàìåùåíèå.
1. Ãàëîãåíèðîâàíèå àëêàíîâ. Ïîä âîçäåéñòâèåì êâàíòà ñâåòà íà÷èíàåòñÿ ðàäèêàëüíîå çàìåùåíèå (õëîðèðîâàíèå) àëêàíà. Îáùàÿ ñõåìà:

Ðåàêöèÿ èäåò ïî öåïíîìó ìåõàíèçìó, â êîòîðîé ðàçëè÷àþò:
À) Èíèöèèðîâàíèå öåïè:

Á) Ðîñò öåïè:

Â) Îáðûâ öåïè:

Ñóììàðíî ìîæíî ïðåäñòàâèòü â âèäå:

2. Íèòðîâàíèå (ðåàêöèÿ Êîíîâàëîâà) àëêàíîâ. Ðåàêöèÿ ïðîòåêàåò ïðè 140 °Ñ:

Ëåã÷å âñåãî ðåàêöèÿ ïðîòåêàåò ñ òðåòèòè÷íûì àòîìîì óãëåðîäà, ÷åì ñ ïåðâè÷íûì è âòîðè÷íûì.
3. Èçîìðèçàöèÿ àëêàíîâ. Ïðè êîíêðåòíûõ óñëîâèÿõ àëêàíû íîðìàëüíîãî ñòðîåíèÿ ìîãóò ïðåâðàùàòüñÿ â ðàçâåòâëåííûå:

4. Êðåêèíã àëêàíîâ. Ïðè äåéñâèè âûñîêèõ òåìïåðàòóð è êàòàëèçàòîðîâ âûñøèå àëêàíû ìîãóò ðâàòü ñâîè ñâÿçè, îáðàçóÿ àëêåíû è àëêàíû áîëåå íèçøèå:

5. Îêèñëåíèå àëêàíîâ.  ðàçëè÷íûõ óñëîâèÿõ è ïðè ðàçíûõ êàòàëèçàòîðàõ îêèñëåíèå àëêàíà ìîæåò ïðèâåñòè ê îáðàçîâàíèþ ñïèðòà, àëüäåãèäà (êåòîíà) è óêñóñíîé êèñëîòû.  óñëîâèÿõ ïîëíîãî îêèñëåíèÿ ðåàêöèÿ ïðîòåêàåò äî êîíöà – äî îáðàçîâàíèÿ âîäû è óãëåêèñëîãî ãàçà:


Ïðèìåíåíèå àëêàíîâ.
Àëêàíû íàøëè øèðîêîå ïðèìåíåíèå â ïðîìûøëåííîñòè, â ñèíòåçå íåôòè, òîïëèâà è ò.ä.
Химические свойства насыщенных углеводородов обусловлены наличием в их молекулах атомов углерода, водорода и связей $C-H$ и $C-C$.
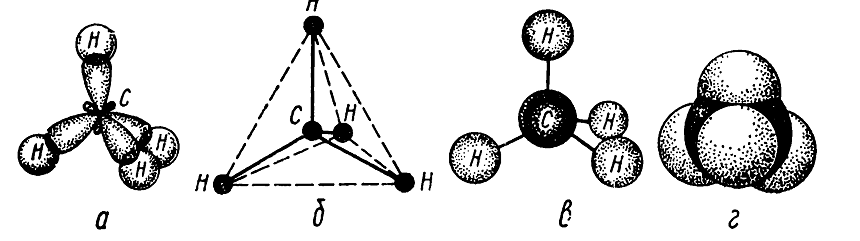
В молекуле простейшего алкана метана химические связи образуют 8 валентных электронов (4 электрона атома углерода и 4 — атомов водорода), которые размещены на четырех связующих молекулярных орбиталях.
Итак, в молекуле метана из четырех $sp3$-гибридизированных орбиталей атома углерода и s-орбиталей четырех атомов водорода образуются четыре $sp3-s (C-H)$ ковалентные связи (рис 1.).
Молекула этана образуется из двух углеродных тетраэдров — одной $sp3-sp3 (C-C)$ ковалентной связи и шести $sp3-s (C-H)$ ковалентных связей (рис. 2).
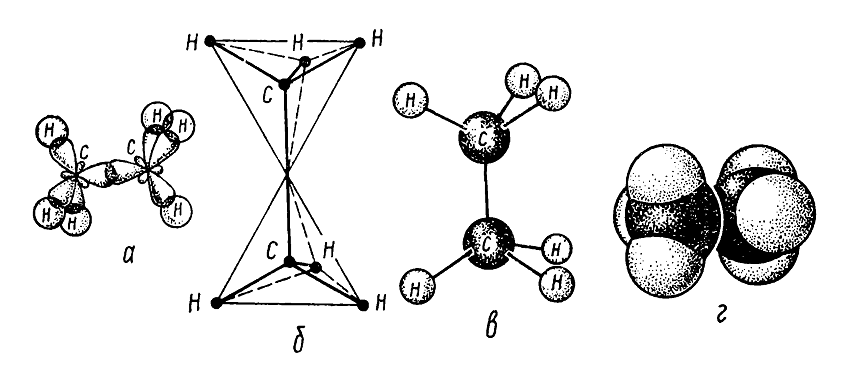
Рисунок 2. Строение молекулы этана: а — размещение $sigma $-связей в молекуле; б — тетраэдрическое модель молекулы; в — шаростержневая модель молекулы; г- масштабная модель молекулы по Стюарту — Бриглебу
Особенности химических связей в алканах
В рассмотренных типах ковалентных связей области наибольшей электронной плотности находятся на линии, соединяющей ядра атомов. Эти ковалентные связи образованы локализованными $sigma $-${rm M}$${rm O}$ и называются $sigma $-связями. Важной особенностью этих связей является то, что электронная плотность в них распределена симметрично относительно оси, проходящей через ядра атомов (цилиндрическая симметрия электронной плотности). Благодаря этому атомы или группы атомов, которые соединены этой связью, могут свободно вращаться не вызывая деформации связи. Угол между направлениями валентностей атомов углерода в молекулах алканов составляет $109^circ 28’$. Поэтому в молекулах этих веществ даже с прямой углеродной цепью атомы углерода в действительности размещаются не по прямой. Эта цепь имеет зигзагообразную форму, которая связана с сохранением межвалентных углов атомов углерода (рис. 3).
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
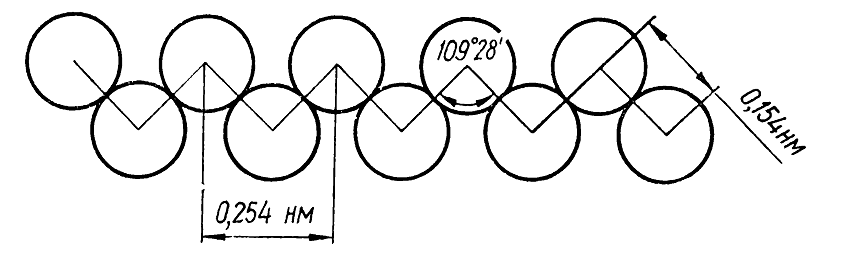
Рисунок 3. Схема строения углеродной цепи нормального алкана
В молекулах алканов с достаточно длинной углеродной цепью этот угол увеличен на $2^circ$ вследствие отталкивания валентно не соединенных между собой атомов углерода.
Замечание 1
Каждая химическая связь характеризуется определенной энергией. Экспериментально установлено, что энергия связи $C-H$ в молекуле метана составляет 422,9 кДж/моль, этана — 401,9 кДж/моль, других алканов — около 419 кДж/моль. Энергия связи $C-C$ равен 350 кДж / моль.
Взаимосвязь строения алканов с их реакционной способностью
Высокая энергия связей $C-C$ и $C-H$ обуславливает низкую реакционную способность насыщенных углеводородов при комнатной температуре. Так, алканы не обесцвечивают бромную воду, раствор перманганата калия, не взаимодействуют с ионными реагентами (кислотами, щелочами), не реагируют с окислителями, с активными металлами. Поэтому, например, металлический натрий можно хранить в керосине, который представляет собой смесь насыщенных углеводородов. Даже концентрированная серная кислота, которая обугливает много органических веществ, при комнатной температуре не действует на алканы. Учитывая сравнительно малую реакционную способность насыщенных углеводородов, их в свое время назвали парафинами. Алканы не имеют способности присоединять водород, галогены и другие реагенты. Поэтому этот класс органических веществ назвали насыщенными углеводородами.
Химические реакции насыщенных углеводородов могут происходить за счет разрыва связей $C-C$ или $C-H$. Разрыв $C-H$-связей сопровождается отщеплением атомов водорода с образованием ненасыщеных соединений или последующим замещением отщеплений атомов водорода другими атомами или группами атомов.
В зависимости от строения алкана и условий реакции в молекулах насыщенных углеводородов связь $C-H$ может разрываться гомолитично:
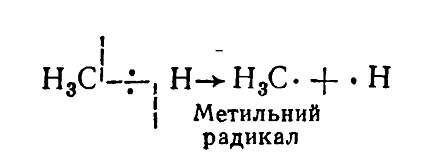
Рисунок 4. Химические свойства алканов
И гетеролитично с образованием анионов и катионов:
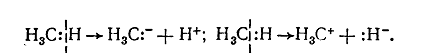
Рисунок 5. Химические свойства алканов
При этом могут образовываться свободные радикалы, имеющие неспаренный электрон, но не имеют электрического заряда, или карбкатионы или карбанионы, которые имеют соответствующие электрические заряды. Свободные радикалы образуются в качестве промежуточных частиц в реакциях радикального механизма, а карбкатионы и карбанионы — в реакциях ионного механизма.
Вследствие того, что связи $C-C$ неполярные, а $C-H$-связи — малополярные и эти $sigma $-связи имеют низкую поляризуемость, гетеролитический разрыв $sigma $-связей в молекулах алканов с образованием ионов требует большой затраты энергии. Гемолитическое расщепление этих связей требует меньше енергии. Поэтому для насыщенных углеводородов более характерны реакции, протекающие по радикальному механизму. Расщепление $sigma $-связи $C-C$ требует меньшей затраты энергии, чем расщепление связи $C-H$, поскольку энергия $C-C$-связи меньше энергии $C-H$-связи. Однако химические реакции чаще происходят с расщеплением $C-H$-связей, поскольку они более доступны для реагентов.
Влияние разветвленности и размеров алканов на их реакционную способность
Реакционная способность $C-H$-связи меняется при переходе от алканов линейной структуры к алканам-разветвленной структуры. Например, энергия диссоциации связи $C-H$ (кДж / моль) при образовании свободных радикалов меняется следующим образом:
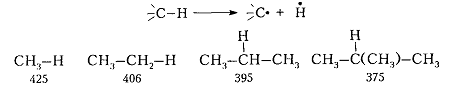
Рисунок 6. Химические свойства алканов
Кроме того, значение энергии ионизации (ЭИ) для алканов показывает, что рост общего количества $sigma $-связей повышает их донорные свойства и отколоть электрон становится легче для соединений с большей молекулярной массой, например:
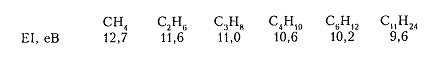
Рисунок 7. Химические свойства алканов
Итак, в свободнорадикальных процессах реакции происходят преимущественно у третичного атома углерода, затем у вторичного и в последнюю очередь у первичного, что совпадает с рядом устойчивости свободных радикалов. Однако с повышением температуры наблюдаемая тенденция уменьшается или совсем нивелируется.
Таким образом, для алканов характерны два типа химических реакций:
- замещения водорода, в основном по радикальному механизму и
- расщепление молекулы за связями $C-C$ или $C-H$.
Àëêåíû – íåïðåäåëüíûå óãëåâîäîðîäû, â ñîñòàâå êîòîðûõ åñòü îäíà äâîéíàÿ ñâÿçü. Ïðèìåðû àëêåíîâ:


Âñå àòîìû óãëåðîäà íàõîäÿòñÿ â sp2 – ãèáðèäèçàöèè; àòîìû íàõîäÿòñÿ â ïëîñêîñòè, îáðàçóÿ óãîë 120 °Ñ. Íåãèáðèäèçîâàííûå ð-îðáèòàëè íàõîäÿòñÿ íàä è ïîä ïëîñêîñòüþ ìîëåêóëû, îáðàçóÿ π – ñâÿçü. Ýòà ñâÿçü ìåíåå ïðî÷íàÿ, ïîýòîìó áîêîâîå ïåðåêðûâàíèå íå î÷åíü ýôôåêòèâíî, ÷åì îñåâîå.
Èçîìåðèÿ àëêåíîâ.
Äëÿ àëêåíîâ õàðàêòåðíà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà, èçîìåðèÿ ïîëîæåíèÿ êðàòíîé ñâÿçè è ïðîñòðàíñòâåííàÿ èçîìåðèÿ:

Ôèçè÷åñêèå ñâîéñòâà àëêåíîâ.
Òåìïåðàòóðû ïëàâëåíèÿ è êèïåíèÿ íåñêîëüêî âûøå, ÷åì ó àëêàíîâ. Àëêåíû íåðàñòâîðèìû â âîäå, õîðîøî ðàñòâîðèìû â îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ.
Ìåòîäû ïîëó÷åíèÿ àëêåíîâ.
1. Êðåêèíã àëêàíîâ ïðè 400-700°Ñ. Ðåàêöèÿ èäåò ïî ñâîáîäíîðàäèêàëüíîìó ìåõàíèçìó:

2. Äåãèäðèðîâàíèå àëêàíîâ:

3. Ðåàêöèÿ ýëèìèíèðîâàíèÿ (îòùåïëåíèå): îò ñîñåäíèõ àòîìîâ óãëåðîäà îòùåïëÿþòñÿ 2 àòîìà èëè 2 ãðóïïû àòîìîâ, è îáðàçóåòñÿ äâîéíàÿ ñâÿçü. Ê òàêèì ðåàêöèÿì îòíîñÿò:
À) Äåãèäðàòàöèþ ñïèðòîâ (íàãðåâ ñâûøå 150°Ñ, ïðè ó÷àñòèè ñåðíîé êèñëîòû, êàê âîäîîòíèìàþùåãî ðåàãåíòà):

Á) Îòùåïëåíèå ãàëîãåíâîäîðîäîâ ïðè âîçäåéñòâèè ñïèðòîâîãî ðàñòâîðà ùåëî÷è:

Àòîì âîäîðîäà îòùåïëÿåòñÿ ïðåèìóùåñòâåííî îò òîãî àòîìà óãëåðîäà, êîòîðûé ñâÿçàí ñ ìåíüøèì ÷èñëîì àòîìîâ âîäîðîäà (íàèìåíåå ãèäðîãåíèçèðîâàííîãî àòîìà) – ïðàâèëî Çàéöåâà.
Â) Äåãàëîãåíèðîâàíèå:

Õèìè÷åñêèå ñâîéñòâà àëêåíîâ.
Ñâîéñòâà àëêåíîâ îáóñëàâëèâàþòñÿ íàëè÷èåì êðàòíîé ñâÿçè, ïîýòîìó àëêåíû âñòóïàþò â ðåàêöèè ýëåêòðîôèëüíîãî ïðèñîåäèíåíèÿ, êîòîðîå ïðîòåêàåò â íåñêîëüêî ñòàäèé (Í-Õ – ðåàãåíò):
1-ÿ ñòàäèÿ:

2-ÿ ñòàäèÿ:
 .
.
Èîí âîäîðîäà â òàêîãî òèïà ðåàêöèÿõ ïðèíàäëåæèò òîìó àòîìó óãëåðîäà, êîòîðûé èìååò áîëåå îòðèöàòåëüíûé çàðÿä. Ðàñïðåäåëåíèå ïëîòíîñòè òàêîå:

Åñëè â êà÷åñòâå çàìåñòèòåëÿ ñòîèò äîíîð, êîòîðûé ïðîÿâëÿåòñÿ +I- ýôôåêò, òî ýëåêòðîííàÿ ïëîòíîñòü ñìåùàåòñÿ â ñòîðîíó íàèáîëåå ãèäðîãåíèçèðîâàííîãî àòîìà óãëåðîäà, ñîçäàâàÿ íà íåì ÷àñòè÷íî îòðèöàòåëüíûé çàðÿä. Ðåàêöèè èäóò ïî ïðàâèëó Ìàðêîâíèêîâà: ïðè ïðèñîåäèíåíèè ïîëÿðíûõ ìîëåêóë òèïà ÍÕ (HCl, HCN, HOH è ò.ä.) ê íåñèììåòðè÷íûì àëêåíàì âîäîðîä ïðèñîåäèíÿåòñÿ ïðåèìóùåñòâåííî ê áîëåå ãèäðîãåíèçèðîâàíîìó àòîìó óãëåðîäà ïðè äâîéíîé ñâÿçè.
À) Ðåàêöèè ïðèñîåäèíåíèÿ:
1) Ãèäðîãàëîãåíèðîâàíèå:

Ðåàêöèÿ èäåò ïî ïðàâèëó Ìàðêîâíèêîâà. Íî åñëè â ðåàêöèè ïðèñóòñòâóåò ïåðîêñèä, òî ïðàâèëî íå ó÷èòûâàåòñÿ:

2) Ãèäðàòàöèÿ. Ðåàêöèÿ èäåò ïî ïðàâèëó Ìàðêîâíèêîâà â ïðèñóòñòâèå ôîñôîðíîé èëè ñåðíîé êèñëîòû:

3) Ãàëîãåíèðîâàíèå.  ðåçóëüòàòå ïðîèñõîäèò îáåñöâå÷èâàíèå áðîìíîé âîäû – ýòî êà÷åñòâåííàÿ ðåàêöèÿ íà êðàòíóþ ñâÿçü:

4) Ãèäðèðîâàíèå. Ðåàêöèÿ ïðîòåêàåò â ïðèñóòñòâèå êàòàëèçàòîðîâ:

5) Ïîëèìåðèçàöèÿ:

n – ñòåïåíü ïîëèìåðèçàöèè.
Á) Ðåàêöèÿ îêèñëåíèÿ.
Ìÿãêîå îêèñëåíèå — ðåàêöèÿ Âàãíåðà:

 ðåçóëüòàòå âûïàäàåò êîðè÷íåâûé îñàäîê, ôèîëåòîâûé ðàñòâîð îáåñöâå÷èâàåòñÿ, ÷òî ñëóæèò òàêæå êà÷åñòâåííîé ðåàêöèåé íà êðàòíóþ ñâÿçü.
Ïðè îãðàíè÷åííîì äîñòóïå êèñëîðîäà ðåàêöèÿ èäåò òàê:

Ïðè ïîëíîì îêèñëåíèè:

Åñëè àëêåí ñ êèñëîðîäîì ïðîïóñòèòü ÷åðåç ñåðåáðÿíûé êàòàëèçàòîð ïðè 200°Ñ, îáðàçóåòñÿ îêñèä àëêåíà (ýïîêñèàëêàí):

Ïðèìåíåíèå àëêåíîâ.
Àëêåíû – îñíîâíûå ñîåäèíåíèÿ äëÿ ïðîìûøëåííîãî ñèíòåçà ñòèðîëà, àöåòîíà, ôåíîëà, ïîëèïðîïèëåíà, ãëèöåðèíà è ò.ä.
