Какой продукт образуется в реакции присоединения иодоводорода

Gosha346 ·
22.08.2019 02:30
Ответов: 1
Показать ответы
10 Обсудить
Ответы
агрега́тное состоя́ние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных свойств.
твёрдое тело
состояние, характеризующееся способностью сохранять объём и форму. атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. присутствует как дальний, так и ближний порядок.
жидкость
состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако не способно сохранять форму. жидкость легко принимает форму сосуда, в который она помещена. атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. присутствует только ближний порядок.
газ
состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. газ стремится занять весь объём, ему предоставленный. атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
плазма
плазменная декоративная лампа.
часто причисляемая к агрегатным состояниям вещества плазма отличается от газа большой степенью ионизации атомов. большая часть барионного вещества (по массе ок. 99,9 %) во вселенной находится в состоянии плазмы.
гибридизация — это образование новых гибридных орбиталей атомов, имеющих одинаковые энергию и форму, в результате смешения электронных облаков разной энергии и формы. в зависимости от типа гибридизации отмечаются различные гибридные состояния атома углерода. если атомы углерода находятся в sp^3-гибридизации, то между атомами углерода в молекулах соединений образуется простая связь, в случае sp^2-гибридизации — двойная связь, а в случае sp-гибридизации — тройная связь. от этого зависит форма молекул в пространстве: тетраэдрическая, тригональная либо линейная.
al(oh)3 ; rboh ; pb(oh)2 ; cr(oh)3.
1). h2c=ch-ch3 + hi -> h3c-ch(i)-ch3 2). n(h2c=ch-ch3)=3.92 / 22.4 = 0.175 n(h3c-ch(i)-ch3 теор)= 0.175 n(h3c-ch(i)-ch3 прак)= 0.6 * 0.175 = 0.105 m(h3c-ch(i)-ch3) = 0.105 * 170 = 17.85
Другие вопросы по Химии
Написать уравнения реакции присоединения: водорода, хлора, воды к пропилену…
Составьте уравнение реакции присоединения бромоводорода к пропилену….
Решите, ! кислород, который образуется при разложении 659,7 г перманганата калия, содержащего 4,2% бескислородной примеси, использовали для каталитического окисления аммиака. расс…
Кислород, который образуется при разложении 659,7 г перманганата калия, содержащего 4,2% бескислородной примеси, использовали для каталитического окисления аммиака. рассчитайте, ка…
Решите по с самим 1. 2cu+o2=2cuo какой объем кислорода (н. у.) потребуется для реакции с 44,8 г меди? 2. 2h2s+o2=so2+h20 какая масса воды образуется в результате реакции, есл…
1) какая масса соли образуется при пропускании 15 л хлороводорода через раствор, содержащий 8 г гидроксида натрия? 2) какая масса продукта реакции 20 л азота с 30 г водорода? 3…
Решить с пропорции : * 1) какой объем водорода образуется при взаимодействии 500г 20% соляной кислоты с магнием? 2) какой объем кислорода потребуется для окисления 700г алюминия?…
Какая масса дибромпропана образуется, если в реакции присоединения с бромом прореагировал пропен объемом 4,48л?…
По уравнению реакции 2na+2h2o=2naoh+h2 рассчитайте, какая масса натрия потребуется для реакции 3,6 г воды. какой объем водорода при этом образуется?…
По уравнению реакции 2na+2h2o=2naoh+h2 рассчитайте, какая масса натрия потребуется для реакции 3,6 г воды. какой объем водорода при этом образуется? ребзя,,…
По уравнению реакции 2na+2h2o=2naoh+h2 рассчитайте, какая масса натрия потребуется для реакции 3,6 г воды. какой объем водорода при этом образуется?…
Рассчитайте, какая масса кислорода (в граммах) потребуется для реакции с: 640 г серы. в реакции образуется сернистый газ (so2). 16,2 г алюминия. в реакции образуется оксид алюми…


Похожие вопросы:

Химия, 20.03.2019 21:25
Написать уравнения реакции присоединения: водорода, хлора, воды к пропилену
Ответов: 2

Химия, 28.03.2019 03:00
Составьте уравнение реакции присоединения бромоводорода к пропилену.
Ответов: 3

Химия, 29.05.2019 16:50
Решите, ! кислород, который образуется при разложении 659,7 г перманганата калия, содержащего 4,2% бескислородной примеси, использовали для каталитического окисления аммиака. рассчитайте, какая масса аммиака может вступить в реакцию и какой объем будет иметь азотосодержащий продукт этой реакции
Ответов: 1

Химия, 29.05.2019 17:30
Кислород, который образуется при разложении 659,7 г перманганата калия, содержащего 4,2% бескислородной примеси, использовали для каталитического окисления аммиака. рассчитайте, какая масса аммиака может вступить в реакцию и какой объём (при н. у.) будет иметь азотосодержащий продукт этой реакции.
Ответов: 3

Химия, 05.06.2019 14:40
Решите по с самим 1. 2cu+o2=2cuo какой объем кислорода (н. у.) потребуется для реакции с 44,8 г меди? 2. 2h2s+o2=so2+h20 какая масса воды образуется в результате реакции, если при этом выделяется 17,92 л so2 (н. у)? 3. какой объем при нормальных условиях займет 5 моль газообразного hcl? 4. сколько моль содержится в 94,08 л (н. у.) веселящего газа n2o? 5. какая масса cl2o может вступить в реакцию с 36 г naoh? 6. уравняйте реакцию: bcl3+h2o=h3bo3+hcl рассчитайте, какая масса h3bo3 образуется, если в реакцию вступило 59,4 г воды. 7. определите, какая масса (nh4)2cr2o7 вступила в реакцию (nh4)2cr2o7= cr2o3+n2+4h2o если образовалось 28,8 г воды. 8.какая масса гидроксида лития потребуется для полной нейтрализации 14 г hf? 9. n2+3h2=2nh3 рассчитайте, какая масса nh3 может получиться из 12 г водорода? 10. определите, какая масса na3po4 вступила в реакцию fecl3+na3po4=fepo4(стрелка вниз)+ 3nacl если образовалось 52,65 г хлорида натрия.
Ответов: 2

Химия, 06.06.2019 21:10
1) какая масса соли образуется при пропускании 15 л хлороводорода через раствор, содержащий 8 г гидроксида натрия? 2) какая масса продукта реакции 20 л азота с 30 г водорода? 3) рассчитайте количество осадка после реакции 100 г хлорида бария и 100 г серной кислоты.
Ответов: 2

Химия, 25.08.2019 05:00
Решить с пропорции : * 1) какой объем водорода образуется при взаимодействии 500г 20% соляной кислоты с магнием? 2) какой объем кислорода потребуется для окисления 700г алюминия? какая масса оксида образуется в этой реакции? 3) какая масса оксида кальция получится при разложении 750г карбоната кальция, содержащего 20% примесей. какое количество вещества co2 при этом образуется?
Ответов: 3

Химия, 27.08.2019 23:50
Какая масса дибромпропана образуется, если в реакции присоединения с бромом прореагировал пропен объемом 4,48л?
Ответов: 1

Химия, 20.09.2019 01:10
По уравнению реакции 2na+2h2o=2naoh+h2 рассчитайте, какая масса натрия потребуется для реакции 3,6 г воды. какой объем водорода при этом образуется?
Ответов: 2

Химия, 20.09.2019 01:10
По уравнению реакции 2na+2h2o=2naoh+h2 рассчитайте, какая масса натрия потребуется для реакции 3,6 г воды. какой объем водорода при этом образуется? ребзя,,
Ответов: 2

Химия, 20.09.2019 02:00
По уравнению реакции 2na+2h2o=2naoh+h2 рассчитайте, какая масса натрия потребуется для реакции 3,6 г воды. какой объем водорода при этом образуется?
Ответов: 3

Химия, 07.10.2019 20:10
Рассчитайте, какая масса кислорода (в граммах) потребуется для реакции с: 640 г серы. в реакции образуется сернистый газ (so2). 16,2 г алюминия. в реакции образуется оксид алюминия (al2o3).
Ответов: 3
У тебя есть свой ответ?
Какой продукт образуется в реакции присоединения йодоводорода к пропилену? рассчитайте, какая масса…
Отправлено
Вопросы по другим предметам:

Математика, 04.08.2019 14:00

Информатика, 04.08.2019 14:00

Алгебра, 04.08.2019 14:00

Қазақ тiлi, 04.08.2019 14:00

Русский язык, 04.08.2019 14:00

Литература, 04.08.2019 14:00

Русский язык, 04.08.2019 14:00

Русский язык, 04.08.2019 14:00

Алгебра, 04.08.2019 14:00

Математика, 04.08.2019 14:00
У тебя есть свой ответ?
Какой продукт образуется в реакции присоединения йодоводорода к пропилену? рассчитайте, какая масса…
Отправлено
| Йодоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | Йодоводород | ||
| Хим. формула | HI | ||
| Рац. формула | HI | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 127.904 г/моль | ||
| Плотность | 2.85 г/мл (-47 °C) | ||
| Температура | |||
| • плавления | –50.80 °C | ||
| • кипения | –35.36 °C | ||
| • разложения | 300 °C | ||
| Критическая точка | 150,7 °C | ||
| Энтальпия | |||
| • образования | 26,6 кДж/моль | ||
| Константа диссоциации кислоты pKa | — 11 | ||
| Растворимость | |||
| • в воде | 72,47 (20°C) | ||
| Рег. номер CAS | [10034-85-2] | ||
| PubChem | 24841 | ||
| Рег. номер EINECS | 233-109-9 | ||
| SMILES | I | ||
| InChI | 1S/HI/h1H XMBWDFGMSWQBCA-UHFFFAOYSA-N | ||
| RTECS | MW3760000 | ||
| ChEBI | 43451 | ||
| ChemSpider | 23224 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Йодоводород HI — бесцветный удушливый газ (при нормальных условиях), сильно дымит на воздухе. Хорошо растворим в воде, образует азеотропную смесь с Ткип 127 °C и концентрацией HI 57 %. Неустойчив, разлагается при 300 °C.
Получение
В промышленности HI получают по реакции йода с гидразином:
2 I2 + N2H4 → 4 HI + N2
В лаборатории HI можно получать с помощью окислительно-восстановительных реакций:
H2S + I2 → S + 2 HI
и реакций обмена:
PI3 + 3 H2O → H3PO3 + 3 HI
Йодоводород также получается при взаимодействии простых веществ. Эта реакция идет только при нагревании и протекает не до конца, так как в системе устанавливается равновесие:
H2 + I2 ⇄ 2 HI
Свойства
Водный раствор HI называется йодоводородной кислотой (бесцветная жидкость с резким запахом). Йодоводородная кислота является сильной кислотой (pKа = −11). Соли йодоводородной кислоты называются йодидами. В 100 г воды при нормальном давлении и 20 °C растворяется 132 г HI, а при 100 °C — 177 г. 45%-ная йодоводородная кислота имеет плотность 1,4765 г/см3.
Йодоводород является сильным восстановителем. На воздухе водный раствор HI окрашивается в бурый цвет вследствие постепенного окисления его кислородом воздуха и выделения молекулярного йода:
4 HI + O2 → 2 H2O + 2 I2
HI способен восстанавливать концентрированную серную кислоту до сероводорода:
8 HI + H2SO4 → 4 I2 + H2S + 4 H2O
Подобно другим галогенводородам, HI присоединяется к кратным связям (реакция электрофильного присоединения):
HI + CH2 = CH2 → CH3 − CH2I
Йодиды присоединяют элементарный йод с образованием полийодидов:
RI + I2 → R(I3)x
Под действием света щелочные соли разлагаются, выделяя I2, придающий им жёлтую окраску. Йодиды получают взаимодействием йода со щелочами в присутствии восстановителей, не образующих твердых побочных продуктов: муравьиная кислота, формальдегид, гидразин:
2 K2CO3 + 2 I2 + HCHO → 4 KI + 3 CO2 ↑ + H2O
Можно использовать также сульфиты, но они загрязняют продукт сульфатами. Без добавок восстановителей при получении щелочных солей наряду с йодидом образуется иодат MIO3 (1 часть на 5 частей йодида).
Ионы Cu2+ при взаимодействии c йодидами легко дают малорастворимые соли одновалентной меди CuI:
2 NaI + 2 CuSO4 + Na2SO3 + H2O → 2 CuI ↓ + 2 Na2SO4 + H2SO4
Замещает элементы в кислородных кислотах по реакциям
12 HNO3 + 2 I2 → 4 HIO3 + N2 ↑ + 10 NO2 ↑ + 4 H2O H2SO4 + I2 → HIO4 + HI + S ↓ 2 H3PO4 + 8 I2 → 2 HIO4 + 4 HI + 2 PI5
Образующийся пентайодид фосфора гидролизуется водой.
Применение
Йодоводород используют в лабораториях как восстановитель во многих органических синтезах, а также для приготовления различных йодсодержащих соединений.
Спирты, галогениды и кислоты восстанавливаются HI, давая алканы.
C4H9Cl + 2 HI → C4H10 + HCl + I2
При действии HI на пентозы он все их превращает во вторичный йодистый амил: CH3CH22CH2CHICH3, а гексозы — во вторичный йодистый н-гексил.
Легче всего восстанавливаются йодпроизводные, некоторые хлорпроизводные не восстанавливаются вовсе. Третичные спирты восстанавливаются легче всего. Многоатомные спирты также реагируют в мягких условиях, часто давая вторичные йодалкилы.
HI при нагреве диссоциирует на водород и I2, что позволяет получать водород с низкими энергетическими затратами.
Физиологическое воздействие и токсикология
- Йодоводород — едкое, токсичное вещество. Обладает удушающим действием.
- При попадании на кожу йодоводородная кислота может вызвать ожоги.
- Предельно допустимая концентрация йодоводорода в воздухе рабочей зоны составляет 2 мг/м³.
- Согласно ГОСТ 12.1.007-76 йодистоводородная кислота относится к III классу опасности (умеренно-опасное химическое вещество).
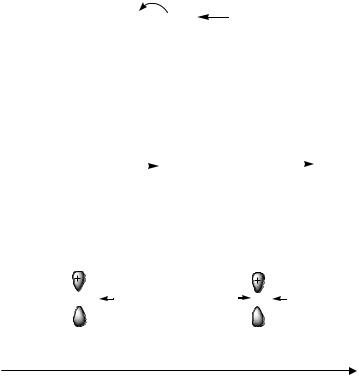
Для пропена, как представителя алкенов, типичны реакции электрофильного присоединения АЕ. Электронодонорная алкильная (метильная) группа, увеличивая электронную плотность π-связи, активирует ее в реакциях электрофильного присоединения по сравнению с этиленом и производными алкенов, содержащими электроноакцепторные заместители. Под действием +I-эффекта метильной группы происходит смещение электронной плотности π-связи, что приводит к возникновению частичных зарядов на атомах углерода при двойной связи.
δ- δ+
CH2 = CH CH3
В реакции с хлороводородом в роли электрофильной частицы выступает протон Н+. Электрофильное присоединение протекает через образование карбокатиона. На этой стадии разрывается π-связь и оба электрона предоставляются для образования связи с протоном. Затем карбокатион подвергается нуклеофильной атаке хлорид-ионом Cl–, что приводит к получению конечного продукта присоединения –2-хлоропропан.
δ- | медленно | ||||||||||
δ+ | δ+ | δ- | Cl | CH3 | — | CH — CH3 | |||||
H — CH2 — CH — CH3 | |||||||||||
CH = CH — CH | + H — Cl | ||||||||||
2 | 3 | карбокатион | |||||||||
Cl | |||||||||||
Образующийся на стадии σ-комплекса вторичный карбокатион более стабилен, чем первичный (динамический фактор). Это обусловлено частичным погашением положительного заряда во вторичном карбокатионе за счет +I-эффекта двух алкильных групп.
CH2 CH2- CH3 | CH3 CH CH3 |
Первичный | Вторичный |
карбокатион | карбокатион |
Стабильность карбокатиона увеличивается
Таким образом, и статический (распределение электронной плотности в молекуле до реакции), и динамический (образование более устойчивого карбокатиона в ходе реакции) факторы способствуют протеканию реакции гидрохлорирования пропена с образованием 2-хлоро- пропана. Это согласуется с правилом Марковникова, по которому
51
в реакциях гидрогалогенирования несимметричных алкенов с электронодонорными заместителями при кратной связи протон присоединяется к более гидрогенизированному атому углерода.
Наличие кратной углерод-углеродной связи в пропене можно доказать с помощью другой реакции электрофильного присоединения – реакции бромирования. При пропускании газообразного пропена через раствор брома в воде (бромную воду) происходит обесцвечивание раствора вследствие присоединения брома по кратной связи. Эта реакция служит качественной пробой для обнаружения двойной или тройной связи. В результате этой реакции бурый раствор бромной воды обесцвечивается.
CCl , 200C | ||||
CH3 — CH = CH2 + Br2 | 4 | CH3 | — CHBr — CH2Br | |
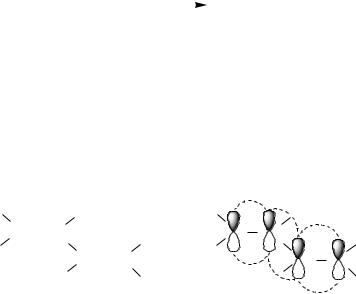
Задача 2. Какие продукты образуются при взаимодействии бута- диена-1,3 с хлороводородом при эквимолярном соотношении субстрата и реагента [1]?
Решение. В результате сопряжения двух двойных связей π-элек- тронная плотность в молекуле бутадиена-1,3 делокализована, т. е. распределена по всей молекуле.
Н2С = СН – СН = СН2
бутадиен-1,3 | ||||
H | H | H | H | |
C1 = C2 | H | = | C1 C2 | H |
H | H | |||
C3 | = C4 | C3 | C4 | |
H | H | H | H | |
Для сопряженных диенов, как и алкенов, характерны реакции электрофильного присоединения. Особенностью реакции присоединения к сопряженным диенам является образование при эквимолярном соотношении субстрата и реагента наряду с обычным для алкенов продуктом 1,2-присоединения продукта 1,4-присоединения. При взаимодействии бутадиена-1,3 с хлороводородом такими продуктами соответственно являются 3-хлоробутен-1 и 1-хлоробутен-2.
52
1,1,22 –-присоединение
H-CH2 — CH — CH = CH2
Cl
CH2 = CH — CH = CH2 + HCl
H-CH2 — CH = CH — CH2Cl
1, 1,44– присоединениерисоединение
Причиной появления двух продуктов присоединения является образование карбокатиона, имеющего мезомерное строение. Так, в результате присоединения к бутадиену-1,3 протона Н+ образуется карбокатион, в котором атом С1 переходит в sp3-гибридизованное состояние и выходит из системы сопряжения. В оставшемся сопряженном фрагменте, включающем атомы С2, С3 и С4, на трех р-АО делокализованы два электрона.
CH3 — CH — CH = CH2  CH2 — CH = CH — CH3
CH2 — CH = CH — CH3
CH3 — CHCl — CH = CH2 | CH2Cl — CH = CH — CH3 |
2-хлоробутен-1 | 1-хлоробутен-2 |
Атака хлорид-ионом мезомерного аллильного карбокатиона по С2 или С4 приводит к образованию двух продуктов присоединения, из которых более устойчив симметрично замещенный 1-хлоробутен-2. В связи с этим продукт 1,4-присоединения, т. е. 1-хлоробутен-2, преобладает в реакционной смеси.
Вопросы для самоконтроля
1.Дайте определение понятию «карбокатион».
2.Какие органические соединения способны к реакциям присоединения?
3.Сформулируйте правило присоединения Марковникова и перок-
сидный эффект Хараша.
53
Домашнее задание
Т а б л и ц а 4
Вариант | Задание |
Сравните реакционную способность этилена и пентена-1 в реак- | |
1 | циях электрофильного присоединения. Какой продукт образует- |
ся при взаимодействии более активного из этих алкенов с бро- | |
моводородом? Напишите механизм реакции | |
Какие продукты получаются при взаимодействии пропена | |
и 2-метилпропена с хлороводородом? Какой из этих алкенов | |
2 | более активен в реакциях электрофильного присоединения? |
Дайте обоснование правилу Марковникова с учетом статиче- | |
ского и динамического факторов | |
Какие продукты образуются при взаимодействии 2,3-диметил- | |
3 | бутадиена-1,3 с 1 моль хлороводорода? Чем обусловлено обра- |
зование продукта 1,4-присоединения? | |
4 | Какие продукты образуются при последовательном присоедине- |
нии 2 моль хлороводорода к изопрену? Напишите схемы реакций | |
Какой продукт образуется в результате реакции гидратации | |
5 | пропена? Почему гидратация пропена происходит в присутствии |
каталитических количеств серной кислоты? | |
Взаимодействие гептадиена-2,4 с бромом в эквимолярном соот- | |
6 | ношении приводит к образованию двух продуктов. Какие соеди- |
нения образуются в данной реакции? | |
Из какого исходного алкена путем гидратации получают трет- | |
7 | бутиловый спирт (2-метилпропанол-2)? Напишите механизм ре- |
акции | |
Сравните относительную стабильность карбокатионов, которые | |
могли бы образоваться при присоединении протона к кратной | |
8 | связи С=С в молекуле акриловой (пропеновой) кислоты. Почему |
продуктом реакции гидратации пропеновой кислоты является | |
β-гидрокси-, а не α-гидроксипропановая кислота? | |
Напишите схему реакции бромирования циклопропана. В чем | |
9 | заключается особенность реакционной способности малых цик- |
лов? | |
54
П р о д о л ж е н и е т а б л. 4 | |
Вариант | Задание |
Какой продукт образуется в результате реакции гидратации кро- | |
10 | тоновой (бутен-2-овой) кислоты? Обоснуйте сделанный вывод |
с учетом статического и динамического факторов | |
Напишите механизм реакции присоединения иодоводорода к ак- | |
11 | риловой (пропеновой) кислоте. Какими факторами обусловлено |
протекание этой реакции против правила Марковникова? | |
Расположите в ряд по уменьшению реакционной способности | |
12 | в реакции гидратации следующие ненасыщенные соединения: |
пропен, пропеновая кислота, 2-метилпропен. Для наиболее ак- | |
тивного из них напишите механизм реакции гидратации | |
Какой продукт получается в результате бромирования цикло- | |
13 | пентена? Рассмотрите механизм и пространственную направ- |
ленность реакции | |
Гидрирование сопряженных диенов водородом в присутствии | |
платинового катализатора протекает как 1,2- и 1,4-присоеди- | |
14 | нение. Напишите схему реакции присоединения 1 моль водоро- |
да к хлоропрену (2-хлоробутадиену-1,3) с образованием всех | |
возможных продуктов | |
Как идет присоединение хлороводорода к этилену, хлорвинилу, | |
15 | изобутилену? Расположите их в порядке возрастания скорости |
реакции. Для наиболее активного из них напишите механизм | |
реакции гидрогалогенирования | |
Напишите реакцию присоединения бромоводорода к 2-метил- | |
16 | бутену-2 в присутствии пероксида водорода. Объясните ано- |
мальное (против правила Марковникова) присоединение бромо- | |
водорода | |
Какие продукты получаются при взаимодействии пентена-1 | |
и 2-метилпентен-1 с бромоводородом? Какой из этих алкенов | |
17 | более активен в реакциях электрофильного присоединения? |
Дайте обоснование правилу Марковникова с учетом статическо- | |
го и динамического факторов | |
Какой продукт образуется в результате реакции гидратации пен- | |
18 | тена-2? Почему гидратация пентена-2 происходит в присутствии |
каталитических количеств серной кислоты? | |
55

О к о н ч а н и е т а б л. 4
Напишите механизм реакции присоединения бромоводорода к
193,3-дихлорпропену-1. Какими факторами обусловлено протекание этой реакции против правила Марковникова?
Какие продукты образуются при последовательном присоедине-
20нии 2 моль хлороводорода к пенадиену-1,3? Напишите схемы реакций
3.2.6.Электрофильное замещение
вароматических соединениях
Для ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической системы, т. е. реакции замещения [2].
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Первичной стадией является генерирование электрофильной частицы. Она обычно образуется путем взаимодействия реагента EY с катализатором и может представлять собой либо электронодефицитную часть поляризованной молекулы реагента, либо частицу Е+ с полным положительным зарядом (после гетеролитического разрыва связи).
Поляризация | Разрыв |
молекулы | связи |
E Y E Y E Y
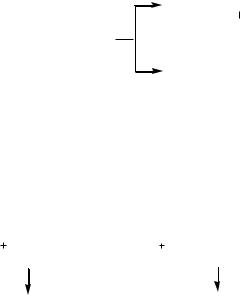
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа, называемого π-комплексом. Ароматическая система не нарушается:
+ E 




 E
E
56
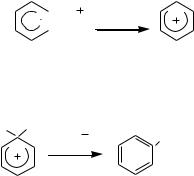
Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp2- в sp3-гибридизованное состояние и нарушением ароматической системы кольца, молекула превращается в карбокатион.
H
 E
E
 E
E
Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона. При этом за счет двух электронов разрывающейся ковалентной связи С–Н восстанавливается замкнутая π-система кольца, т.е. происходит возврат молекулы в ароматическое состояние:
Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π-электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца [2].
• Электронодонорные заместители (Д), повышающие электронную плотность кольца и увеличивающие скорость электрофильного замещения, называются активирующими.
• Электроноакцепторные заместители (А), понижающие электронную плотность кольца и уменьшающие скорость реакции, называются
дезактивирующими.
Имеющийся в кольце заместитель не только влияет на реакционную способность, но и проявляет ориентирующее действие по отношению к вводимому в кольцо электрофилу.
Ориентирующее влияние заместителей обусловлено их электронными эффектами и отражает распределение электронной плотности в молекуле субстрата. Например, в толуоле электронодонорная группа
57

повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара- положениях.
CH3
δ  δ
δ
δ
По влиянию на реакции электрофильного замещения заместители делятся на две группы.
• Заместители I рода – электронодонорные, активирующие группы, орто- и пара-ориентанты. К ним относятся алкильные группы, проявляющие +I-эффект по отношению к соседнему sp2-гибриди- зованному атому углерода, и проявляющие +М-эффект группы:
–NH2, –NHR, –NR2, –OH | +M >> –I | сильно активируют |
–OCH3, –OR, –NHCOR | +M > –I | умеренно активируют |
–CH3 | +I | слабо активируют |
–C6H5, –CH = CH2 | +M > –I | слабо активируют |
–F, –Cl, –Br, –I | –I > +M | слабо дезактивируют |
Если по силе действия +М-эффект от группы превосходит
–I-эффект, то орто- и пара-ориентант обогащает бензольное ядро электронной плотностью. В деформированной π-системе эта плотность у атомов углерода повышается неравномерно, и в орто- и пара- положениях возникает частичный отрицательный заряд, облегчая атаку электрофила в этих положениях.
 OCH3
OCH3
δ
Вместе с тем среди заместителей 1-го рода есть такие, в которых – I-эффект>+M-эффекта. Тогда электронная плотность в ядре понижается и оно становится менее доступным для атаки электрофилов. Однако
58
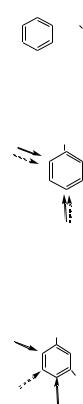
в орто- и пара-положениях она понижается незначительно. Поэтому электрофильное замещение галогенбензола протекает труднее, чем самого бензола.
• Заместители II рода – проявляют электроноакцепторный характер за счет отрицательных индуктивного или мезомерного эффектов. Это дезактивирующие группы, мета-ориентанты:
–С ≡ N, –CHO, –COR, –COOH, | –I, –M | умеренно дезактивируют |
–COOR, –SO3H | ||
–CF3, –CCl3 | –I | сильно дезактивируют |
–NO2 | –I, –M | сильно дезактивируют |
δ
=  C
C
O
OH
δ δ
Правила ориентации в дизамещенных аренах. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца.
CH3
 NO2
NO2
При несогласованной ориентации заместители конкурируют между собой и можно предсказать основное направление реакции, руководствуясь следующими обобщениями.
1. Если в кольце есть активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой
OH
COOH
59
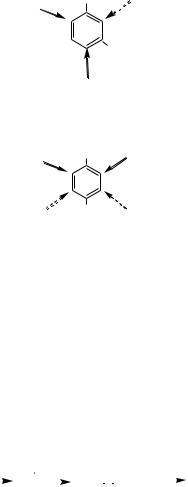
2. Атакующий электрофил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета-положении относительно друг друга (стерические препятствия)
OH
Br
3. Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной активирующей группой
OH
CH3
3.2.7. Обучающие задачи
Задача 1. Кумол (изопропилбензол) является основным продуктом для промышленного синтеза фенола и ацетона. Предложите пути алкилирования бензола с целью получения кумола.
Решение. Для замещения в ароматическом кольце атома водорода на алкильную группу используют реакцию алкилирования. Электрофильный алкильный реагент могут получить из галогеноалканов с участием катализатора – кислоты Льюиса (алкилирование по Фриделю– Крафтсу), а также алкенов или спиртов в сильнокислой среде. Для введения в бензольное кольцо изопропильного радикала в качестве реагентов можно использовать 2-хлоропропан (изопропилхлорид), пропен или пропанол-2 (изопропиловый спирт).
CH | CH | CH3 | ||||||||||||||||
3 | δ | 3 | δ | |||||||||||||||
CH — Cl | + AlCl | CH | Cl | AlCl | CH + AlCl4 | |||||||||||||
3 | 3 | |||||||||||||||||
CH3 | CH3 | CH3 | ||||||||||||||||
Комплекс с кислотой Льюиса | Изопропильный | |||||||||||||||||
о | екс с | исл той ьюиса | ||||||||||||||||
карбокатион
карбокатион
60


