Какой продукт образуется при окислении этанола перманганатом калия

Тема: Спирты
Урок: Химические свойства спиртов – 3. Окисление спиртов
1. Горение
Все органические вещества горят. Спирты – не исключение. Рис. 1.
С2Н5ОН + 3О2 = 2СО2 + 3Н2О. При горении образуются углекислый газ и вода.
Рис. 1. Спиртовка (Источник)
2. Ферментативное окисление
Этанол окисляется в печени под действием фермента, превращаясь в этаналь – вещество, относящееся к классу альдегидов[1]: Рис. 4.
CH3CH2OH | ||
этаналь |
Обычно организм быстро окисляет этаналь дальше, переводя его с помощью другого фермента в уксусную кислоту:
Если человек злоупотребил алкоголем, то организм не справляется с переработкой этаналя, и наступает отравление, называемое похмельем (Рис. 2).
Рис. 2. Похмелье (Источник)
3. Окисление спирта до альдегида в пробирке
CH3CH2–OH + CuO → CH3CH=O + Cu + H2O
черный розово-
красный
Рис. 3. Окисление оксидом меди(II) (Источник)
Рис. 4. Шаростержневая модель этаналя
Вторичный спирт окислится в этих условиях до кетона:
(CH3)2CH–OH + CuO → (CH3)2C=O + Cu + H2O
изопропиловый спирт ацетон
(пропанол-2) (пропанон)
4. Окисление спирта до кислоты в пробирке
Для этого требуется более сильный окислитель – дихромат или перманганат.
3С2Н5ОН + 2K2Cr2O7 + 16HCl = 3CH3COOH + 4CrCl3 + 11H2O + 4KCl
оранжевый зеленый
Рис. 5. Окисление до кислоты (фото Н. Морозовой)
5С2Н5ОН + 4KMnO4 + 12HCl = 5CH3COOH + 4MnCl2 + 11H2O + 4KCl
фиолетовый бесцветный
Рис. 6. Окисление перманганатом калия (фото Н. Морозовой)
Вторичные спирты невозможно окислить до кислот. Даже сильные окислители переводят их только в кетоны – соединения с группой С=О:
5СН3-СНОН-СН3 + 2KMnO4 + 6HCl →5CH3-CO-CH3 + 2MnCl2 + 8H2O + 2KCl
Третичные спирты в обычных условиях вообще не окисляются.
Подведение итога урока
На этом уроке вы изучили тему «Химические свойства спиртов – 3. Окисление спиртов». Все органические вещества горят, и спирты – не исключение. Вы узнали, как происходит окисление спиртов. Вам наверняка было интересно узнать, как это химическое свойство спиртов связано с функционированием человеческого организма.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Органическая химия (Источник).
2. Химик (Источник).
Домашнее задание
1. №№ 16 б), в) (с. 85) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Какое вещество получится при окислении спирта в организме человека?
3. Будет ли происходить реакция окисления третичного спирта перманганатом калия?
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
![]()
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
![]()
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:

Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.

Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
![]()
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
![]()
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида

Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона

Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь

Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
![]()
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота

Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь

Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)

Окисление спиртов и фенолов
Для окисления гидроксисоединений используются соединения марганца(IV), марганца(VII), хрома(VI), оксиды металлов (Cu, Zn, Ag) и др.
Легкость окисления одноатомных спиртов уменьшается в ряду:
CH3OHМетанол CH3OH – сильный яд. Его высокая токсичность обусловлена лёгкой окисляемостью с образованием ядовитых продуктов (попадание в организм 5-10 г метанола приводит к слепоте, а 25-30 г – к смерти). > первичные ≥ вторичные >> третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот. В реакции участвует ближайшая к гидроксильной группе связь С–Н, по которой происходит внедрение атома кислорода. От образовавшегося при этом неустойчивого алкандиола-1,1Алкандиолы-1,1 – двухатомные спирты с ОН-группами при одном и том же атоме углерода R–CH(OH)2 и R2C(OH)2. Неустой-чивые соединения. Подобно угольной кислоте (O=C(OH)2 → CO2 + H2O) они легко отщепляют воду и превращаются в альдегиды R–CH=O или кетоны R2C=O. отщепляется вода с разрывом связей О–Н и С–ОH.
Окисления альдегида в карбоновую кислоту можно избежать, удаляя его из реакционной смеси путем отгонки
(альдегид кипит при более низкой температуре, так как его молекулы не ассоциированы за счет водородных связей).
При окислении вторичных спиртов получают кетоны.
Промышленное значение имеет реакция окисления вторичного алициклического спирта циклогексанола до кетона циклогексанона:

Это одна из стадий в многостадийном синтезе ε-капролактама, из которого получают поликапролактам (капрон).
Окисление первичных и вторичных спиртов происходит также в результате реакции дегидрирования (отщепления водорода) при пропускании паров спирта над нагретым катализатором (Cu, соединения Ag, Cr, или Zn). В этих условиях процесс идёт как внутримолекулярная окислительно-восстановительная реакция.

Данный метод позволяет превращать первичные спирты в альдегиды без их дальнейшего окисления до кислот.
Третичные спирты более устойчивы к действию окислителей. Если первичные и вторичные спирты окисляются в кислой, нейтральной и щелочной средах, то третичные спирты реагируют лишь в жестких условиях – кислая среда, повышенная температура. Это приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов – карбоновых кислот и кетонов с меньшим числом углеродных атомов.
- Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
- Устойчивость третичных спиртов при окислении позволяет отличить их от первичных и вторичных спиртов по реакции с разбавленным щелочным раствором перманганата калия.
Многоатомные спирты при окислении образуют различные вещества, поскольку в реакцию могут вступать одна или несколько гидроксильных групп. Состав продуктов окисления зависит от взаимного положения ОН-групп в молекулах полигидроксильного соединения и природы окислителя.
Соединения с ОН-группами у соседних атомов углерода (1,2-диолы, 1,2,3-триолы и т.п.) окисляются наиболее легко. В зависимости от условий их окисление происходит с сохранением
C–C-связей
углеродного скелета (пример 1) или с их разрывом (пример 2) вплоть до полного разрушения С-скелета (пример 3).
Пример 1. Окисление этиленгликоля при действии CrO3 или HNO3

Пример 2. Окисление раствором перманганата калия в кислой среде при нагревании
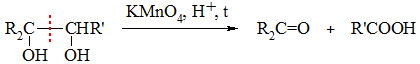
Кетон R2C=O образуется из фрагмента, содержащего третичную спиртовую группу, а карбоновая кислота R’COOH – из фрагмента с вторичной группой ОН.
При наличии фрагмента с первично-спиртовой группой –CH2OH образуется CO2:

Пример 3. Взаимодействие глицерина с кристаллическим перманганатом калия (видео)
Реакция глицерина HOCH2–CH(OH)–CH2OH с тонко измельчённым кристаллическим KMnO4 начинается самопроизвольно и идёт с высокой скоростью при выделении большого количества тепла. При этом глицерин окисляется полностью до углекислого газа и воды:
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О + Q
Характерной реакцией многоатомных спиртов с соседними ОН-группами является окисление водным раствором иодной кислоты HIO4, которая не окисляет одноатомные спирты и многоатомные спирты других типов. Подробнее…
Реакция протекает через стадию образования циклического сложного эфира иодной кислоты (иодата), который расщепляется далее по связи С–С с выделением иодноватой кислоты:

В отличие от деструктивного окисления перманганатом калия, продуктами реакции с иодной кислотой являются альдегиды и (или) кетоны.
В случае трёх соседних C–ОН-групп средняя группа окисляется до муравьиной кислоты НСООН:

Данная реакция, называемая гликольным расщеплением, используется для установления числа и положения ОН-групп в полигидроксильных соединениях (главным образом, в углеводах) путём определения количества израсходованного окислителя и анализа продуктов окисления.
Кроме иодной кислоты для гликольного расщепления применяют также тетраацетат свинца (CH3COO)4Pb в органическом растворителе.
Фенолы окисляются легче спиртов. Эти реакции протекают многоступенчато с образованием довольно сложной смеси продуктов. Многие из фенолов, являясь бесцветными веществами, при стоянии на воздухе приобретают окраску за счёт примеси продуктов окисления.
Действие на фенол сильных окислителей (CrО3, хромовая смесь) приводит к образованию пара-бензохинона (наряду с другими продуктами окисления). Реакция идёт с отщеплением наиболее подвижного атома водорода в пара-положении бензольного кольца.

Значительно легче окисляются многоатомные фенолы.
Поэтому они являются более сильными восстановителями, чем одноат?


