Какой продукт образуется при гидрировании циклобутана

Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только
простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их
гомологического ряда — CnH2n.
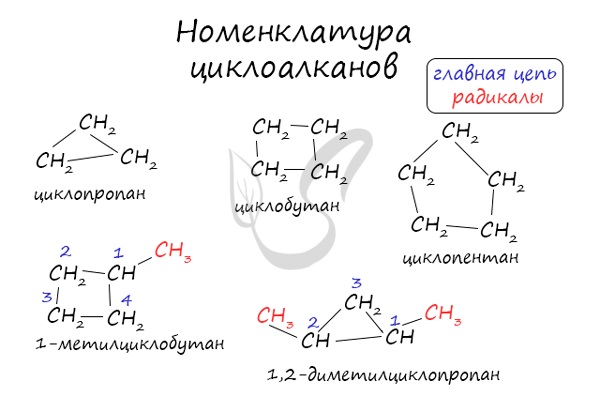
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом:
циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
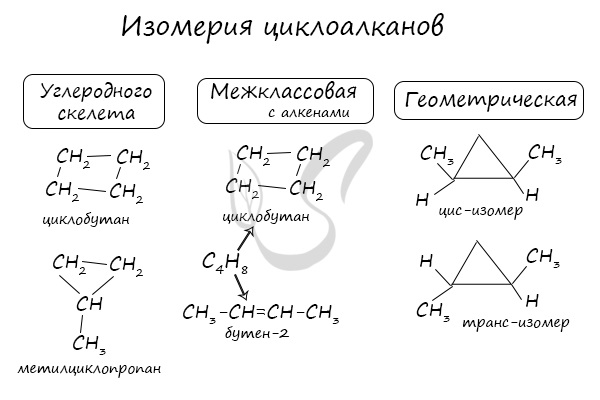
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде
существования цис- и транс-изомеров.
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.

При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана
реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Дегидрирование
- Изомеризация
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования.

Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция
идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.

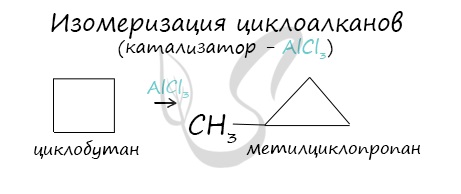
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Для определения химических свойств и химической активности алканов рассмотрим виды связей, образующих молекулы. С-С-связи в молекулах алканов — ковалентные неполярные, связи С-Н — ковалентные малополярные (разница в электроотрицательности составляет 0,4). Такие связи достаточно прочные, поэтому при комнатной температуре ни кислоты, ни щелочи, ни окислители на алканы не действуют.
Для алканов, как насыщенных УВ, не характерны реакции присоединения, но характерны реакции замещения, разложения (разрыва С-С связей), элиминирования (отщепления), изомеризации (в том числе циклизации) и окисления в жестких условиях.
1. Реакции радикального замещения $S_R$
В реакциях замещения алканов легче всего идет замещение при третичном атоме углерода, затем при вторичном, труднее всего — при первичном.
а) галогенирование.
Условием протекания реакции является УФ-освещение и нагревание. Скорость реакции зависит от активности галогена. Так, фтор не только замещает атомы водорода, но и разрушает углерод-углеродные связи, а иодирование протекает настолько медленно, что обычно не используется на практике. Чаще всего проводится хлорирование или бромирование алканов, которое протекает по гомолитическому (радикальному) механизму (см. тему»Типы и механизмы реакций в органической химии»). Галогенирование протекает в несколько стадий, в результате чего можно заместить все атомы водорода на атомы хлора. Для примера рассмотрим стадии хлорирования этана:

Стадия 1 называется стадией инициирования, стадии 2а и 2b — роста цепи. На стадиях 3a, 3b и 3с происходит обрыв цепи.
б) нитрование по Коновалову.
Условием протекания реакции является использование 13-15% азотной кислоты $HNO_3$ при температуре $130-140^0C$. Реакция протекает по свободно-радикальному механизму.

Также, как и при галогенировании алканов, образуется смесь продуктов с преимущественным образованием продуктов нитрования третичного атома углерода:

В более жестких условиях нитрование газообразных алканов может осуществляться оксидами азота или парами азотной кислоты при температуре $420^0-480^0C$ (нитрование по Гессу), при этом происходит разрыв С-С связей и образуется смесь нитроалканов:
В случае нитрования метана образуется нитрометан. Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе.
в) сульфирование
Сульфирование алканов проводится в жестких условиях и протекает с образование сульфокислот. Серная кислота при обыкновенной температуре не действует на парафины; при высокой температуре действует как окислитель. Парафиновые углеводороды с числом углеродных атомов более шести при нагревании до температуры кипения сульфируются олеумом (15% $SO_3$). При слабом нагревании дымящая серная кислота также может действовать на парафиновые углеводороды, особенно на углеводороды изостроения, образуя сульфокислоту и воду:
$C_6H_14 + H_2SO_4 +SO_3 longrightarrow C_6H_{13}-SO_3H + H_2O$
Прямое сульфинирование алканов протекает с трудом и сопровождается, как правило, окислением. Подобные реакции редко используют в лабораторном синтезе, но находят практическое применение для сульфинирования полимеров, например — полиэтилена, с целью их модификации. Значительно легче сульфируются углеводороды при совместном действии $SO_3$ и $O_2$ (сульфо-окисление), а также $SO_2$ и $Cl_2$ (сульфохлорирование). Обе реакции имеют радикальный характер и инициируются пероксидами, УФ или гамма — облучением:
2. Реакции окисления
Реакции окисления алканов включают два вида — полное окисление (сгорание) и неполное окисление в присутствии катализаторов или неорганических окислителей.
а) горение (полное окисление) (см. подробно тему «ОВР в органической химии»)
$2C_2H_6 +7O_2 longrightarrow 4CO_2 + 6H_2O +Q$
При недостатке кислорода образуется угарный газ или углерод:
$2C_2H_6 + 5O_2 longrightarrow 4CO + 6H_2O +Q$
$2C_2H_6 + 3O_2 longrightarrow 4C + 6H_2O +Q$
б) Неполное окисление
Способность низших парафинов к окислению зависит от длины цепи: с удлинением цепи температура окисления понижается. Окисление может протекать как с разрывом, так и без разрыва С-С связей. Условиями протекания реакции неполного каталитического окисления является температурный режим, повышенное давление и наличие катализатора. Чаще всего в качестве катализатора окисления алканов используют хлорид олова, соли кобальта. Продуктами, в зависимости от условий, могут быть спирты, альдегиды, кетоны или карбоновые кислоты

Окисление алканов также проводится в присутствии солей переходных металлов (Mn, Cr и др.), но протекает в жестких условиях с образованием преимущественно вторичных продуктов окисления — карбоновых кислот:
$2C_4H_{10} +5O_2 longrightarrow 4CH_3COOH +2 H_2O$
Подробно см. тему «ОВР в органической химии»
Запомнить! В обычных условиях алканы перманганатом калия не окисляются (не обесцвечивают раствор $KMnO_4$).
3. Термическая обработка
Термическая обработка алканов имеет промышленное значение, так как включает такие важные технологические процессы, как крекинг и пиролиз (подробно см. тему «Переработка нефти»). В результате каталитического крекинга получают ценные органические вещества: этилен, бутадиен, ароматические УВ, кокс. Кроме того, в результате изомеризации над окисью алюминия $Al_2O_3$ образуются изомерные алканы, которые повышают октановое число бензинов.
4. Реакции отщепления (элиминирования)
а) внутримолекулярное дегидрирование
Определение
Внутримолекулярное дегидрирование предельных УВ — это процесс отщепления молекул водорода у соседних атомов в углеводородной цепи, приводящий к образованию кратных связей или замыканию цикла (начиная с $С_5$).
В зависимости от условий, дегидрирование алканов может приводит к образованию одной или нескольких двойных связей:

Процессы циклизации гексана с последующим отщеплением трех молекул водорода лежат в основе получения бензола. Аналогично получаются и его производные:


б) межмолекулярное дегидрирование
Определение
Межмолекулярное дегидрирование — отщепления атомов водорода от двух молекул, приводящее к образованию непредельных УВ с более длинной цепью
В промышленности находит широкое практическое применение пиролиз метана, лежащий в основе получения ацетилена, протекающий по механизму межмолекулярного дегидрирования:
Дегидрирование проводится при повышенных температурах в присутствии катализаторов
Запомнить!
Ni, $Al_2O_3, Cr_2O_3, ZnO$ — катализаторы дегидрирования с образованием ациклических УВ.
Pt — катализатор процессов циклизации и ароматизации
Химические свойства циклоалканов
Циклоалканы имеют в своей структуре только одинарные связи, поэтому по своим свойствам сходны с алканами: малоактивны, горючи, атомы водорода в них могут замещаться галогенами. Химические свойства циклоалканов и их химическая устойчивость определяются размерами цикла, Поэтому циклоалканы с циклами, образованными пятью (циклопентан и его производные) и более атомами углерода, по химическим свойствам напоминают алканы, то есть являются насыщенными. Это значит, что для них будут также характерны реакции замещения, элиминирования, расщепления С-С связей. Наиболее устойчивыми являются шестичленные циклы (циклогексан и его производные), в которых отсутствуют угловое и другие виды напряжения
Малые циклы — трех- (циклопропан) и четырехчленный (циклобутан), являясь насыщенными, тем не менее, резко отличаются от предельных углеводородов. Напряженность таких циклов обусловлена малыми величинами валентных углов ($60^0$ и $90^0$ соответственно, по сравнению с углом $109^0$, характерным для предельных углеводородов ($sp^3$-гибридизация).
Атомы заместителей в циклоалканах с малыми циклами могут находится в цис- или транс-положениях относительно плоскости цикла, поэтому для таких циклоалканов, также как и для соединений с кратной связью, характерна геометрическая изомерия:

Как уже было сказано, по химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и циклобутан склонны к реакциям присоединения, протекающим с разрывом цикла, проявляя тем самым характер ненасыщенных соединений. то есть сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, поэтому вступают в реакции замещения.
Рассмотрим отдельно химические свойства для циклоалканов с малыми и с большими циклами.
Химические свойства циклоалканов с малыми циклами (С3-С4)
1. Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование).
Реакции гидрирования протекают достаточно легко и сопровождаются разрывом цикла:
Также, достаточно легко циклопропан и циклобутан присоединяют галогены и галогеноводороды:
Химические свойства циклоалканов с большими циклами (С5-С6)
1. Наиболее важное промышленное значение имеет реакция дегидрирования циклогексана, лежащая в основе процесса ароматизации при каталитическом крекинге (платформинге) нефти.

2. Галогенирование — (хлорирование, бромирование) протекают по радикальному механизму замещения атомов водорода:

3. Реакции окисления: циклы, как малые, так и большие, разрывается и концевые атомы углерода окисляются до карбоксильной группы -COOH:
$C_5H_{10} + [O] rightarrow HOOC-(CH_2)_3-COOH$
4. Горение: все как обычно — все органические веществ сгорают с образованием $CO_2$ и $H_2O$. В общем виде можно записать:
$С_nH_{2n} + 3n/2 O_2 = nCO_2 + nH_2O$
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Строение, номенклатура и изомерия циклоалканов
Химические свойства циклоалканов
Получение циклоалканов
Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109о35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов.
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.
σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана.
По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.

Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:

Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.
Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».

Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:

«кресло» «ванна»
Структурная изомерия
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
- Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
Изомеры с разным числом углеродных атомов в цикле – это этилциклопропан и метилциклобутан с общей формулой С5Н10
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Структурные изомеры с различным числом углеродных атомов в заместителях – 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан
- Изомеры с разным положением одинаковых заместителей в углеродном цикле.
- Межклассовая изомерия: циклоалканы изомерны алкенам.
Формуле С3Н6 соответствуют циклопропан и пропен.
Геометрическая (цис-транс-) изомерия
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны.
В молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
В названиях циклоалканов используется префикс -ЦИКЛО.
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 1,1-диметил-3-этилциклопентан.
5. Называют углеродный цикл.
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан.
1.1. Гидрирование циклоалканов
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:


Циклопентан присоединяет водород в жестких условиях:

Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
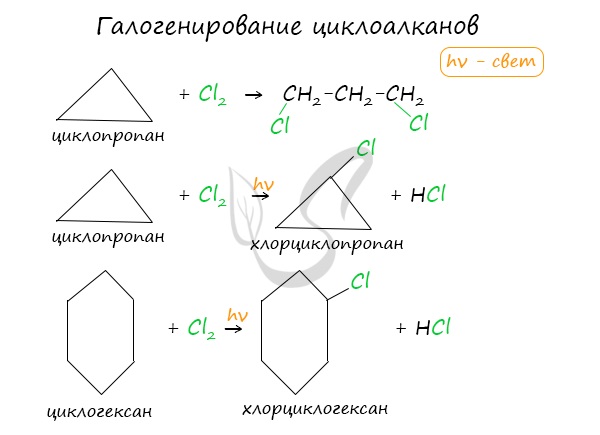
1.2. Галогенирование циклоалканов
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана:

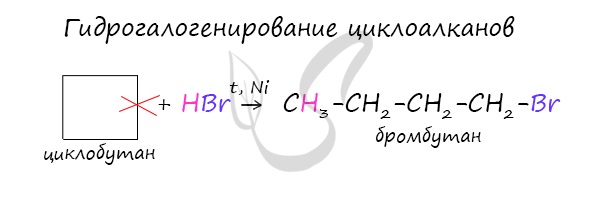
1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Например, циклопропан присоединяет йодоводород.

Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова.
Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан

2. Реакции замещения
Поэтому большие циклы гораздо более устойчивы, чем малые, и реакции присоединения с разрывом связей С-С для них не характерны. В химических реакциях они ведут себя подобно алканам, вступая в реакции замещения без разрыва кольца.
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан

При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:

2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Например, нитрование циклопентана.

2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Например, бензол образуется при дегидрировании циклогексана.

Например, при отщеплении водорода от метилциклогексана образуется толуол.

3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, горение циклопентана.
2C5H10 + 15O2 → 10CO2 + 10H2O + Q
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:

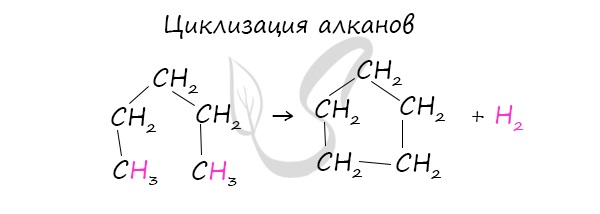
1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:

При гидрировании толуола образуется метилциклогексан:

Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана

Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
