Какое значение для организмов имеют капиллярные свойства воды

Вода (H2O) — важнейшее неорганическое вещество клетки. В клетке в количественном отношении вода занимает первое место среди других химических соединений. Вода выполняет различные функции: сохранение объёма, упругости клетки, участие во всех химических реакциях. Все биохимические реакции происходят в водных растворах. Чем выше интенсивность обмена веществ в той или иной клетке, тем больше в ней содержится воды.
Обрати внимание!
Вода в клетке находится в двух формах: свободной и связанной.
Свободная вода находится в межклеточных пространствах, сосудах, вакуолях, полостях органов. Она служит для переноса веществ из окружающей среды в клетку и наоборот.
Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками.
Вода обладает рядом свойств, имеющих исключительное значение для живых организмов.
Структура молекулы воды
Уникальные свойства воды определяются структурой её молекулы.
Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
Характерное расположение электронов в молекуле воды придаёт ей электрическую асимметрию. Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате молекула воды является диполем (обладает полярностью). Каждый из двух атомов водорода обладает частично положительным зарядом, а атом кислорода несёт частично отрицательный заряд.
Частично отрицательный заряд атома кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул. Таким образом, каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами воды.
Свойства воды
Так как молекулы воды полярны, то вода обладает свойством растворять полярные молекулы других веществ.
Вещества, растворимые в воде, называются гидрофильными (соли, сахара, простые спирты, аминокислоты, неорганические кислоты). Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает.
Вещества, нерастворимые в воде, называются гидрофобными (жиры, нуклеиновые кислоты, некоторые белки). Такие вещества могут образовывать с водой поверхности раздела, на которых протекают многие химические реакции. Следовательно, тот факт, что вода не растворяет некоторые вещества, для живых организмов также очень важен.
Вода обладает высокой удельной теплоёмкостью, т. е. способностью поглощать тепловую энергию при минимальном повышении собственной температуры. Чтобы разорвать многочисленные водородные связи, имеющиеся между молекулами воды, требуется поглотить большое количество энергии. Это свойство воды обеспечивает поддержание теплового баланса в организме. Большая теплоёмкость воды защищает ткани организма от быстрого и сильного повышения температуры.
Для испарения воды необходима довольно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении способствует его охлаждению. Это свойство воды предохраняет организм от перегрева.
Пример:
примерами этого могут являться транспирация у растений и потоотделение у животных.
Вода обладает также высокой теплопроводностью, обеспечивая равномерное распределение тепла по всему организму.
Обрати внимание!
Высокая удельная теплоёмкость и высокая теплопроводность делает воду идеальной жидкостью для поддержания теплового равновесия клетки и организма.
Вода практически не сжимается, создавая тургорное давление, определяя объём и упругость клеток и тканей.
Пример:
гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов.
Благодаря силам сцепления молекул на поверхности воды создаётся плёнка, обладающая такой характеристикой, как поверхностное натяжение.
Пример:
благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях.
К числу важных в физиологическом отношении свойств воды относится её способность растворять газы (O2, CO2 и др.).
Вода является также источником кислорода и водорода, выделяемых при фотолизе в световую фазу фотосинтеза.
Биологические функции воды
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма. В природе вода переносит продукты жизнедеятельности в почву и к водоёмам.
- Вода — активный участник реакций обмена веществ.
- Вода участвует в образовании смазывающих жидкостей и слизей, секретов и соков в организме (эти жидкости находятся в суставах позвоночных животных, в плевральной полости, в околосердечной сумке).
- Вода входит в состав слизей, которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей. Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т. д.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
https://infourok.ru/prezentaciya_po_biologii_na_temu_mineralnye_veschestva_i_voda-409343.htm
https://otvet.mail.ru/question/182353364
https://www.studfiles.ru/html/2706/741/html_fBK8q_mH0r.UWHS/htmlconvd-PYhDG9_html_1c3325a2.png
Среди процессов, которые можно объяснить с помощью поверхностного натяжения и смачивания жидкостей, стоит особо выделить капиллярные явления. Физика – это загадочная и необыкновенная наука, без которой жизнь на Земле была бы невозможна. Давайте рассмотрим наиболее яркий пример этой важной дисциплины.
В жизненной практике такие интересные с точки зрения физики процессы, как капиллярные явления, встречаются весьма часто. Все дело в том, что в повседневной жизни нас окружает много тел, которые легко впитывают в себя жидкость. Причина этому – их пористая структура и элементарные законы физики, а результат – капиллярные явления.
Узкие трубки
Капилляр – это очень узкая трубка, в которой жидкость ведет себя особым образом. Примеров таких сосудов много в природе – капилляры кровеносной системы, пористых тел, почвы, растений и т. д.

Капиллярным явлением называется подъем или опускание жидкостей по узким трубкам. Такие процессы наблюдаются в естественных каналах человека, растений и других тел, а также в специальных узких сосудах из стекла. На картинке видно, что в сообщающихся трубках разной толщины установился разный уровень воды. Отмечено, что чем тоньше сосуд, тем выше уровень воды.
Эти явления лежат в основе впитывающих свойств полотенца, питания растений, движения чернил по стержню и многих других процессов.
Капиллярные явления в природе
Описанный выше процесс чрезвычайно важен для поддержания жизнедеятельности растений. Почва довольно рыхлая, между ее частицами существуют промежутки, которые представляют собой капиллярную сеть. По этим каналам поднимается вода, питая корневую систему растений влагой и всеми необходимыми веществами.
По этим же капиллярам жидкость активно испаряется, поэтому необходимо производить вспахивание земли, которое разрушит каналы и удержит питательные вещества. И наоборот, прижатая земля быстрее испарит влагу. Этим обусловлена важность перепашки земли для удержания подпочвенной жидкости.
В растениях капиллярная система обеспечивает подъем влаги от мелких корешков до самых верхних частей, а через листья она испаряется во внешнюю среду.
Поверхностное натяжение и смачивание
В основе вопроса о поведении жидкости в сосудах лежат такие физические процессы, как поверхностное натяжение и смачивание. Капиллярные явления, обусловленные ими, изучаются в комплексе.

Под действием силы поверхностного натяжения смачивающая жидкость в капиллярах находится выше уровня, на котором она должна находиться согласно закону сообщающихся сосудов. И наоборот, несмачивающая субстанция располагается ниже этого уровня.
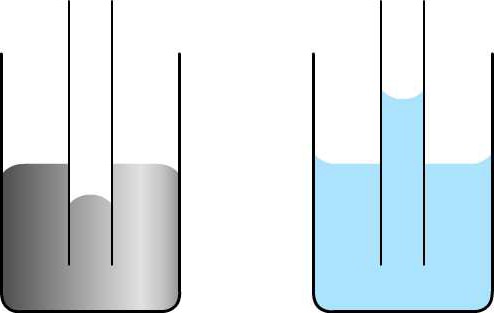
Так, вода в стеклянной трубке (смачивающая жидкость) поднимается на тем большую высоту, чем тоньше сосуд. Напротив, ртуть в стеклянной пробирке (несмачивающая жидкость) опускается тем ниже, чем тоньше эта емкость. Кроме того, как указано на картинке, смачивающая жидкость образует вогнутую форму мениска, а несмачивающая – выпуклую.
Смачивание
Это явление, которое происходит на границе, где жидкость соприкасается с твердым телом (другой жидкостью, газами). Оно возникает по причине особого взаимодействия молекул на границе их контакта.
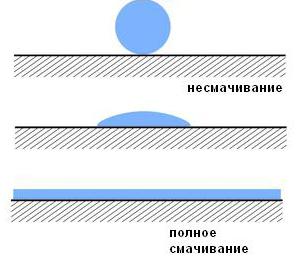
Полное смачивание означает, что капля растекается по поверхности твердого тела, а несмачивание преобразует ее в сферу. На практике чаще всего встречается та или иная степень смачивания, нежели крайние варианты.
Сила поверхностного натяжения
Поверхность капли имеет шарообразную форму и причина этому закон, действующий на жидкости, – поверхностное натяжение.

Капиллярные явления связаны с тем, что вогнутая сторона жидкости в трубке стремится выпрямиться до плоского состояния благодаря силам поверхностного натяжения. Это сопровождается тем, что наружные частицы увлекают за собой вверх тела, находящиеся под ними, и субстанция поднимается вверх по трубке. Однако жидкость в капилляре не может принимать плоскую форму поверхности, и этот процесс подъема продолжается до определенного момента равновесия. Чтобы рассчитать высоту, на которую поднимется (опустится) столб воды, нужно воспользоваться формулами, которые будут представлены ниже.
Расчет высоты подъема столба воды
Момент остановки подъема воды в узкой трубке наступает, когда сила тяжести Ртяж субстанции уравновесит силу поверхностного натяжения F. Этот момент определяет высоту подъема жидкости. Капиллярные явления обусловлены двумя разнонаправленными силами:
- сила тяжести Ртяж заставляет жидкость опускаться вниз;
- сила поверхностного натяжения F двигает воду вверх.
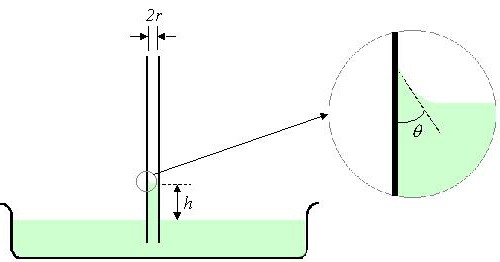
Сила поверхностного натяжения, действующая по окружности, где жидкость соприкасается со стенками трубки, равна:
F = σ2πr,
где r – радиус трубки.
Сила тяжести, действующая на жидкость в трубке равна:
Ртяж = ρπr2hg,
где ρ – плотность жидкости; h – высота столба жидкости в трубке;
Итак, субстанция прекратит подниматься при условии, что Ртяж = F, а это значит, что
ρπr2hg = σ2πr,
отсюда высота жидкости в трубке равна:
h=2σ/pqr.
Точно так же для несмачивающей жидкости:
h – это высота опускания субстанции в трубке. Как видно из формул, высота, на которую поднимется вода в узком сосуде (опустится) обратно пропорционально радиусу емкости и плотности жидкости. Это касается смачивающей жидкости и несмачивающей. При других условиях нужно делать поправку по форме мениска, что будет представлено в следующей главе.
Лапласовское давление
Как уже отмечалось, жидкость в узких трубках ведет себя так, что создается впечатление нарушения закона сообщающихся сосудов. Этот факт всегда сопровождает капиллярные явления. Физика объясняет это с помощью лапласовского давления, которое при смачивающей жидкости направлено вверх. Опуская очень узкую трубку в воду, наблюдаем, как жидкость втягивается на определенный уровень h. По закону сообщающихся сосудов, она должна была уравновеситься с внешним уровнем воды.
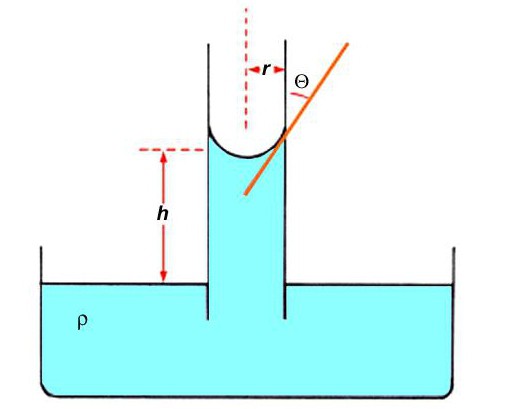
Это несоответствие объясняется направлением лапласовского давления pл:
pл=2σ/R,
В данном случае оно направлено вверх. Вода втягивается в трубку до уровня, где приходит уравновешивание с гидростатическим давлением pг столба воды:
pг=pqh,
а если pл=pг, то можно приравнять и две части уравнения:
2σ/R= pqh.
Теперь высоту h легко вывести в виде формулы:
h=2σ/pqR.
Когда смачивание полное, тогда мениск, который образует вогнутая поверхность воды, имеет форму полусферы, где Ɵ=0. В таком случае радиус сферы R будет равен внутреннему радиусу капилляра r. Отсюда получаем:
h=2σ/pqr.
А в случае неполного смачивания, когда Ɵ≠0, радиус сферы можно вычислить по формуле:
R=r/cosƟ.
Тогда искомая высота, имеющая поправку на угол, будет равна:
h=(2σ/pqr)cosƟ.
Из представленных уравнений видно, что высота h обратно пропорциональна внутреннему радиусу трубки r. Наибольшей высоты вода достигает в сосудах, имеющих диаметр человеческого волоса, которые и называются капиллярами. Как известно, смачивающая жидкость втягивается вверх, а несмачивающая – выталкивается вниз.
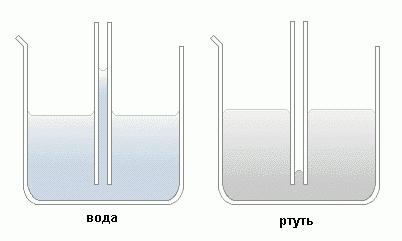
Можно провести эксперимент, взяв сообщающиеся сосуды, где один из них широкий, а другой – очень узкий. Налив туда воду, можно отметить разный уровень жидкости, причем в варианте со смачивающей субстанцией уровень в узкой трубке выше, а с несмачивающей – ниже.
Важность капиллярных явлений
Без капиллярных явлений существование живых организмов просто невозможно. Именно по мельчайшим сосудам человеческое тело получает кислород и питательные вещества. Корни растений – это сеть капилляров, которая вытягивает влагу из земли, донося ее до самых верхних листьев.
Простая бытовая уборка невозможна без капиллярных явлений, ведь по этому принципу ткань впитывает воду. Полотенце, чернила, фитиль в масляной лампе и множество устройств работает на этой основе. Капиллярные явления в технике играют важную роль при сушке пористых тел и других процессах.
Порой эти же явления дают нежелательные последствия, например, поры кирпича впитывают влагу. Чтобы избежать отсыревания зданий под воздействием грунтовых вод, нужно защитить фундамент с помощью гидроизолирующих материалов – битума, рубероида или толя.
Промокание одежды во время дождя, к примеру, брюк до самых колен от ходьбы по лужам также обязано капиллярным явлениям. Вокруг нас множество примеров этого природного феномена.
Эксперимент с цветами
Примеры капиллярных явлений можно найти в природе, особенно если говорить о растениях. Их стволы имеют внутри множество мелких сосудов. Можно провести эксперимент с окрашиванием цветка в какой-либо яркий цвет в результате капиллярных явлений.

Нужно взять ярко окрашенную воду и белый цветок (или лист пекинской капусты, стебель сельдерея) и поставить в стакан с этой жидкостью. Через какое-то время на листьях пекинской капусты можно наблюдать, как краска продвигается вверх. Цвет растения постепенно изменится соответственно краске, в которую он помещен. Это обусловлено движением субстанции вверх по стеблям согласно тем законам, которые были рассмотрены нами в этой статье.
Введение
Организм человека почти на 70% состоит из воды. Вода — прежде всего растворитель, в среде которого протекают все элементарные акты жизнедеятельности. К тому же вода — продукт и субстрат энергетического метаболизма в живой клетке. Образно говоря, вода — это арена, на которой разыгрывается действие жизни и участник основных биохимических превращений.
Известно что вода присутствует во всех частях нашего организма, хотя например в коре мозга её 85%, в коже 72%, в зубной эмали всего лишь3%. Это свидетельствует о том, что в наиболее интенсивно работающих органах содержится большее число воды.
Некоторая часть воды в организме может более или менее прочно связываться с растворёнными в ней веществами и с поверхностью биополимерных макромолекул с помощью как водородных связей, так и сил ион-дипольного взаимодействия. Это может приводить к заметному изменению конфигурации, эффективных размеров и весов тех или иных частиц, участвующих в реакции, и в некоторых случаях к существенной модификации их свойств. Например, оказывается, что натриевые каналы нервных клеток, имеющие диаметр около 0,5 нм, практически недоступны для прохождения по ним ионов калия, хотя диаметр самого иона K+ равен 0,26 нм. В действительности ион K+ гидратирован и, следовательно, для расчёта его эффективных размеров к диаметру K+ следует прибавить диаметр молекулы воды 0,28 нм. В итоге комплексный ион [K· H2O]+ диаметром почти 0,6 нм сквозь натриевый канал пройти не может, тогда как гидратированный ион [Na· H2O]+ диаметром около 0,47 нм свободно диффундирует через этот канал.
Другим примером изменения размеров биологического субстрата может быть молекула ДНК. В частности известно, что на каждый нуклеотид макромолекулы приходится около 50 молекул воды, связанных с ДНК. В общей сложности водная плёнка ДНК увеличивает эффективный диаметр цилиндрической макромолекулы ДНК с 2 нм в безводном состоянии до 2,9 нм в водном растворе, что чрезвычайно важно, например, при считывании с неё информации.
Строение воды
Вода — уникальное вещество и все её аномальные свойства: высокая температура кипения, значительная растворяющая и диссоциирующая способность, малая теплопроводность, высокая теплота испарения и другие обусловлены строением её молекулы и пространственной структурой.
У отдельно взятой молекулы воды есть качество, которое проявляется только в присутствии других молекул: способность образовывать водородные мостики между атомами кислорода двух оказавшихся рядом молекул, так, что атом водорода располагается на отрезке, соединяющем атомы кислорода. Свойство образовывать такие мостики обусловлено наличием особого межмолекулярного взаимодействия, в котором существенную роль играет атом водорода. Это взаимодействие называется водородной связью.
Каждая из присоединённых к данной молекул воды сама способна к присоединению дальнейших молекул. Этот процесс можно называть «полимеризацией». Если только одна из двух возможных связей участвует в присоединении следующей молекулы, а другая остаётся вакантной, то «полимеризация» приведёт к образованию либо зигзагообразной цепи, либо замкнутого кольца. Наименьшее кольцо, по-видимому, может состоять из четырёх молекул, но величина угла 90° делает водородные связи крайне напряжёнными. Практически ненапряжёнными должны быть пятизвенные кольца (угол 108° ), а шестизвенные (угол 120° ), также как и семизвенные — напряжённые.
Рассмотрение реальных структур гидратов показывает, что, действительно, наиболее устойчиво шестизвенное кольцо, находимое в структурах льдов. Плоские кольца являются привилегией клатратных гидратов, причём во всех известных структурах чаще всего встречаются плоские пятизвенные кольца из молекул воды. Они, как правило, чередуются во всех структурах клатратных гидратов с шестизвенными кольцами, очень редко с четырёхзвенными, а в одном случае — с плоским семизвенным.
В целом структура воды представляется как смесь всевозможных гидратных структур, которые могут в ней образоваться.
В прикладном аспекте это, например, имеет важное значение для понимания действия лекарственных веществ. Как было показано Л. Полингом структурированная клатратная форма воды в межсинаптических образованиях мозга обеспечивает, с одной стороны, передачу импульсов с нейрона на нейрон, а, с другой стороны при попадании в эти участки наркозного вещества такая передача нарушается, то есть наблюдается явление наркоза. Гидратация некоторых структур мозга является одной из основ реализации действия наркотических анальгетиков (морфина).
Биологическое значение воды
Вода как растворитель. Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Результаты многочисленных исследований строения растворов электролитов свидетельствуют, что при гидратации ионов в водных растворах основную роль играет ближняя гидратация — взаимодействие ионов с ближайшими к ним молекулами воды. Большой интерес представляет выяснение индивидуальных характеристик ближней гидратации различных ионов, как степени связывания молекул воды в гидратных оболочках, так и степени искажения в этих оболочках тетраэдрической льдоподобной структуры чистой воды — связи в молекуле изменяются на неполный угол. Величина угла зависит от иона.
Когда вещество растворяется, его молекулы или ионы получают возможность двигаться более свободно и, соответственно, его реакционная способность возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять водные растворы на отдельные компартаменты, подобно тому, как их разделяют мембраны. Неполярные части молекул отталкиваются водой и в её присутствии притягиваются друг к другу, как это бывает, например, когда капельки масла сливаются в более крупные капли; иначе говоря, неполярные молекулы гидрофобны. Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеиновых кислот и других субклеточных структур.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторных системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Большая теплоёмкость. Удельной теплоёмкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1° C. Вода обладает большой теплоёмкостью (4,184 Дж/г). Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение её температуры. Объясняется такое явление тем, что значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды.
Большая теплоёмкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, для которой характерно довольно значительное постоянство условий.
Большая теплота испарения. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для её перехода в пар, то есть для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии (2494 Дж/г). Это объясняется существованием водородных связей между молекулами воды. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из их окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, при тепловой одышке у млекопитающих или у некоторых рептилий (например, у крокодилов), которые на солнцепёке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев.
Большая теплота плавления. Скрытая теплота плавления есть мера тепловой энергии, необходимой для расплавления твёрдого вещества (льда). Воде для плавления (таяния) необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и поведение воды вблизи точки замерзания. Плотность воды (максимальна при +4° С) от +4 до 0° С понижается, поэтому лёд легче воды и в воде не тонет. Вода — единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твёрдом, так как структура льда более рыхлая, чем структура жидкой воды.
Поскольку лёд плавает в воде, он образуется при замерзании сначала на её поверхности и лишь под конец в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоёмах вообще не могла бы существовать. То обстоятельство, что слои воды, температура которых упала ниже 4° С, поднимаются вверх, обусловливает перемешивание воды в больших водоёмах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоёмы заселяются живыми организмами на большую глубину.
После проведения ряда экспериментов было установлено, что связанная вода при температуре ниже точки замерзания не переходит в кристаллическую решётку льда. Это энергетически невыгодно, так как вода достаточно прочно связана с гидрофильными участками растворённых молекул. Это находит применение в криомедицине.
Большое поверхностное натяжение и когезия. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь её поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды (7,6 · 10-4 Н/м). Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях. Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по её поверхности.
Вода как реагент. Биологическое значение воды определяется и тем, что она представляет собой один из необходимых метаболитов, то есть участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода в процессе фотосинтеза, а также участвует в реакциях гидролиза.
Особенности талой воды
Уже небольшое нагревание (до 50-60° С) приводит к денатурации белков и прекращает функционирование живых систем. Между тем охлаждение до полного замерзания и даже до абсолютного нуля не приводит к денатурации и не нарушает конфигурацию системы биомолекул, так что жизненная функция после оттаивания сохраняется. Это положение очень важно для консервирования органов и тканей предназначенных для пересадки. Как указывалось выше, вода в твёрдом состоянии имеет другую упорядоченность молекул, чем в жидком и после замерзания и оттаивания приобретает несколько иные биологические свойства, что послужило причиной применения талой воды с лечебной целью. После оттаивания вода имеет более упорядоченную структуру, с зародышами клатратов льда что позволяет ей взаимодействовать с биологическими компонентами и растворёнными веществами, например с другой скоростью. При употреблении талой воды в оганизм попадают мелкие центры льдоподобной структуры, которые в дальнейшем могут разрастись и перевести воду во льдоподобное состояние и тем самым произвести оздоравливающее действие.
Информационная роль воды
При взаимодействии молекул воды со структурными компонентами клетки могут образовываться не только вышеописанные пяти-, шести- и т. д. компонентные структуры, но и трёхмерные образования могут образовываться додекаэдральные формы, которые могут обладать способностью к образованию цепочечных структур, связанных общими пятиугольными сторонами. Подобные цепочки могут существовать и в виде спиралей, что делает возможным реализацию механизма протонной проводимости по этому универсальному токопроводу. Следует также учесть данные С. В. Зенина (1997 г.), что молекулы воды в таких образованиях могут взаимодействовать между собой по принципу зарядовой комплементарности, то есть посредством дальнего кулоновского взаимодействия без образования водородных связей между гранями элементов, что позволяет рассматривать структурированное состояние воды в виде исходной информационной матрицы. Такая объёмная структура имеет возможность переориентироваться, в результате чего происходит явление «памяти воды», так как в новом состоянии отражено кодирующее действие введённых веществ или других возмущающих факторов. Известно, что такие структуры существуют непродолжительное время, но в случае нахождения внутри додекаэдра кислорода или радикалов происходит стабилизация таких структур.
В прикладном аспекте возможности «памяти воды» и передачи информации посредством структурированной воды объясняют действие гомеопатических средств и акупунктурных воздействий.
Как уже говорилось, все вещества при растворении в воде образуют гидратные оболочки и поэтому каждой частице растворённого вещества соответствует конкретная структура гидратной оболочки. Встряхивание такого раствора приводит к схлопыванию микропузырьков с диссоциацией молекул воды и образованию протонов, стабилизирующих такую воду, которая приобретает излучательные свойства и свойства памяти, присущие растворённому веществу. При дальнейшем разведении этого раствора и встряхивании образуются всё более длинные цепи — спирали и в 12-сотенном разведении уже нет самого вещества, но сохраняется память о нём. Введение этой воды в организм передаёт эту информацию в структурированные компоненты воды биологических жидкостей, которая передаётся структурным компонентам клеток. Таким образом, гомеопатический препарат действует прежде всего информационно. Добавление спирта в процессе приготовления гомеопатического средства удлиняет устойчивость во времени структурированной воды.
Не исключено, что спиралеобразные цепи структурированной воды являются возможными компонентами переноса информации из биологически активных точек (точек акупунктуры) на структурные компоненты клеток определённых органов.
Список литературы
- Садовничая Л. П. с соавт. Биофизическая химия, К.: Вища школа, 1986. — 271 с.
- Габуда С. П. Связанная вода. Факты и гипотезы, Новосибирск: Наука, 1982. — 159 с.
- Сб. Структура и роль воды в живом организме, Л.: Изд. ЛГУ, 1966. — 208 с.
- Бышевский А. Ш., Терсенов О. А. Биохимия для врача, Екатеринбург: изд. «Уральский рабочий», 1994. — 378 с.
- Грин Н., Стаут У., Тейлор Д. Биология, т. 1.: Пер. с англ. — М.: Мир, 1993. — 368 с.
- Чанг Р. Физическая химия с приложениями к биологическим системам М.: Мир, 1980. — 662 с.
- Зенин С. В. Водная среда как информационная матрица биологических процессов. В кн. Тезисы докладов 1 Международного симпозиума, Пущино, 1997, с. 12-13.
- Смит С. Электромагнитная биоинформация и вода. Вестник биофизической медицины, 1994 №1, с. 3-13.
- Антонченко В. Я., Ильин В. В. Проблемные вопросы физики воды и гомеопатии. Вестник биофизической медицины, 1992 №1, с.11-13.

