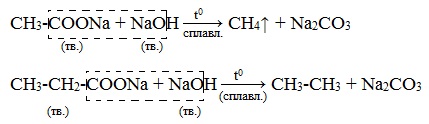Какое вещество проявляет свойства альдегидов и карбоновых кислот
Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
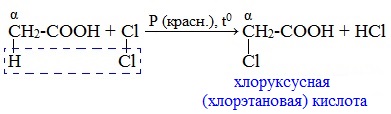
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
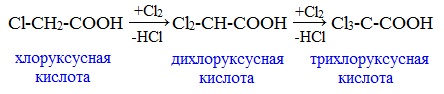
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
1. Р. Окисления.
Альдегиды легко окисляются до карбоновых кислот. Окислителями могут служить гидроксид меди (II), оксид серебра, кислород воздуха:
Ароматические альдегиды окисляются труднее алифатических. Кетоны, как было сказано выше, окисляются труднее альдегидов. Окисление кетонов проводится в жестких условиях, в присутствии сильных окислителей. Образуются в результате смеси карбоновых кислот. Как отличить альдегиды от кетонов? Различие в способности к окислению служит основой качественных реакций, позволяющих отличить альдегиды от кетонов. Многие мягкие окислители легко реагируют с альдегидами, но инертны по отношению к кетонам. а) Реактив Толленса (аммиачный раствор оксида серебра), содержащий комплексные ионы [Ag(NH3)2]+, дает с альдегидами реакцию «серебряного зеркала». При этом образуется металлическое серебро. Раствор оксида серебра готовят непосредственно перед опытом:
Реактив Толленса окисляет альдегиды до соответствующих карбоновых кислот, которые в присутствии аммиака образуют аммонийные соли. Сам окислитель при этой реакции восстанавливается до металлического серебра. За тонкий серебряный налет на стенках пробирки, который образуется при этой реакции, реакция альдегидов с аммиачным раствором оксида серебра получила название реакции «серебряного зеркала». СН3-СН=O)+2[Ag(NH3)2]OH->CH3COONH4+2Ag+3NH3+H2O. Альдегиды также восстанавливают свежеприготовленный аммиачный раствор гидроксида меди (II), обладающий светло-голубой окраской (реактив Фелинга), до желтого гидроксида меди (I), который при нагревании разлагается с выделением ярко-красного осадка оксида меди (I). СН3-СН=О + 2Cu(ОН)2 — СН3СООН+2CuОН+Н2О 2CuOH->Cu2O+H2O
2. Р. Присоединения
Гидрирование — присоединение водорода.
Карбонильные соединения восстанавливаются до спиртов водородом, алюмогидридом лития, боргидридом натрия. Водород присоединяется по связи C=O. Реакция идет труднее, чем гидрирование алкенов: требуется нагревание, высокое давление и металлический катализатор (Pt, Ni):
3. Взаимодействие с водой.
4. Взаимодействие, со спиртами.
При взаимодействии альдегидов со спиртами могут образовываться полуацетали и ацетали. Полуацетали представляют собой соединения, в которых при одном атоме углерода содержится гидроксильная и алкоксильная группа. К ацеталям относят вещества, в молекулах которых содержится атом углерода с двумя алкоксильными заместителями.
Ацетали, в отличие от альдегидов, более устойчивы к окислению. Благодаря обратимости взаимодействия со спиртами их часто используют в органическом синтезе для « защиты» альдегидной группы.
4.Присоединение гидросульфитов.
Гидросульфит NaHSO3 тоже присоединяется по связи C=O с образованием кристаллического производного, из которого карбонильное соединение может быть регенерировано. Бисульфитные производные используются для очистки альдегидов и кетонов.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Фрагмент фенолформальдегидной смолы показан ниже:
Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты и кислоты.
Применение карбонильных соединений
Формальдегид используется для получения пластмасс, например бакелита, дубления кож, дезинфекции, протравливания семян. Совсем недавно в нашей стране разработан метод получения полиформальдегида (—СН2—О—)n, который обладает высокой химической и термической устойчивостью.
Это ценнейший конструкционный пластик, способный во многих случаях заменить металлы. Ацетальдегид используют для получения уксусной кислоты и некоторых пластмасс. Ацетон применяется как исходное вещество для синтеза многих соединений (например, метилметакрилата, полимеризацией которого получают оргстекло); он используется также в качестве растворителя.
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Она определяется в основном наличием в их структуре карбоксильной группы.
Карбоксильная группа представляет собой сопряженную систему, в которой неподеленная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с π-электронами карбонильной группы (р,π-сопряжение). Вследствие +М-эффекта со стороны группы –ОН электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы ![]() неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения электронной плотности связь О-Н оказывается сильно поляризованной (по сравнению со спиртами и фенолами), что приводит к появлению в карбоксильной группе ОН-кислотного центра.
Но в то же время за счет +М-эффекта со стороны группы –ОН в молекулах карбоновых кислот в некоторой степени уменьшается частичный положительный заряд (δ+) на атоме углерода карбонильной группы по сравнению с альдегидами и кетонами.
Кроме того, вследствие –I-эффекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности с углеводородного остатка, что приводит к появлению СН-кислотного центра у α-углеродного атома.
Исходя из строения, в молекулах карбоновых кислот можно выделить реакционные центры, определяющие возможные реакции с их участием. 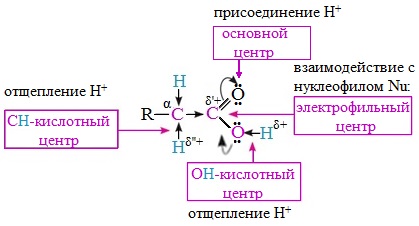
1. Кислотные свойства кабоновых кислот проявляются в реакциях с основаниями за счет ОН-кислотного центра.
2. С участием электрофильного центра (атома углерода карбоксильной группы) происходят реакции нуклеофильного замещения в карбоновых кислотах и их функциональных производных.
3. Основный центр – карбонильная группа (оксогруппа) со своей электронной парой – протонируется на стадии катализа в реакциях нуклеофильного замещения.
4. СН-кислотный центр определяет возможность замещения атома водорода в алкильном радикале и реакции конденсации.
Карбоновые кислоты вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
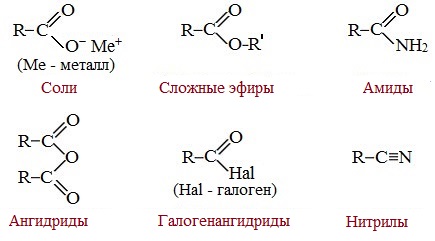
Химические свойства карбоновых кислот (таблица)
Химические свойства карбоновых кислот (таблица)
Химические свойства карбоновых кислот на примере уксусной кислоты
I. Реакции с разрывом связи О-Н
(кислотные свойства карбоновых кислот обусловлены подвижностью атома водорода карбоксильной группы и их способностью отщеплять его в виде протона)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
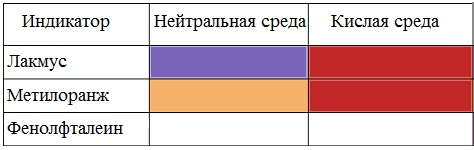
Карбоновые кислоты изменяют окраску индикаторов.
1. Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: они диссоциируют с образованием протона (Н+) и кислотного остатка (карбоксилат-иона):
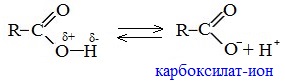
Уравнение реакции, учитывающее участие молекулы воды:
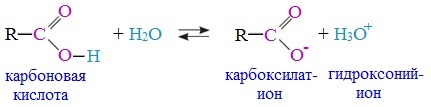
Растворы карбоновых кислот изменяют окраску индикаторов, имеют кислый вкус, проводят электрический ток.
В карбоксилат-ионе оба атома кислорода равноценны, а отрицательный заряд равномерно делокализован (рассредоточен) между ними.
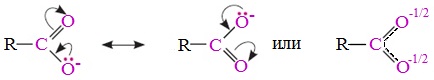
В результате делокализации отрицательного заряда карбоксилат-ион обладает высокой устойчивостью. Сила кислоты определяется устойчивостью образующегося аниона, поэтому карбоновые кислоты превосходят по кислотным свойствам спирты и фенолы, где возможность делокализации заряда в анионе меньшая.
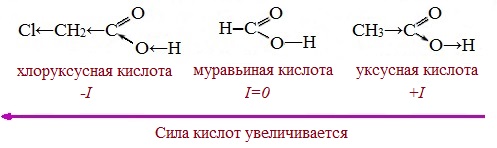
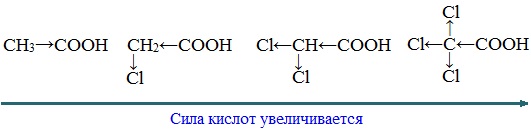
Тем не менее, монокарбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа –СООН связана с атомом водорода.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индукционного эффекта.
Алкильные радикалы, связанные с карбоксильной группой, обладают положительным индукционным эффектом (+І). Они отталкивают от себя электронную плотность, тем самым уменьшая частичный положительный заряд (δ+) на атоме углерода карбоксильной группы. Положительный индукционный эффект возрастает по мере увеличения длины углеводородного радикала, что в свою очередь ослабляет полярность связи О-Н. Алкильные группы понижают кислотность.
В гомологическом ряду предельных монокарбоновых кислот кислотные свойства уменьшаются от муравьиной кислоты к высшим карбоновым кислотам.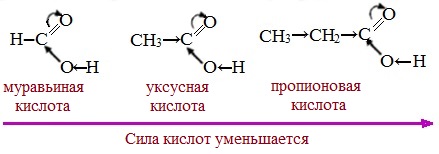
Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индукционный эффект (— I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты.
Карбоновые кислоты – слабые электролиты. Равновесие процесса диссоциации сильно смещено влево, об этом свидетельствует тот факт, что даже сильноразбавленные водные растворы кислот имеют резкий запах.
Видеоопыт «Растворимость в воде различных карбоновых кислот»
Видеоопыт «Карбоновые кислоты — слабые электролиты»
2. Образование солей
Карбоновые кислоты проявляют все свойства минеральных кислот. Карбоновые кислоты при взаимодействии с активными металлами, основными оксидами, основаниями и солями слабых кислот образую соли.
а) взаимодействие с активными металлами
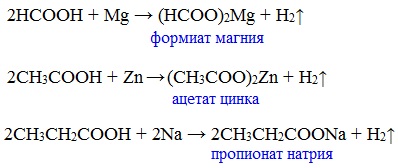

Цинк и уксусная кислота
Карбоновые кислоты реагируют с металлами, стоящими в ряду напряжений до водорода.
Видеоопыт «Взаимодействие уксусной кислоты с металлами»
б) взаимодействие c основаниями (реакция нейтрализации)
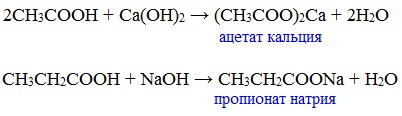
Видеоопыт «Взаимодействие уксусной кислоты с раствором щелочи»
в) взаимодействие с основными и амофтерными оксидами
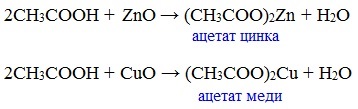

Оксид меди(II) и уксусная кислота
Видеоопыт «Взаимодействие уксусной кислоты с оксидом меди (II)»
г) взаимодействие с солями более слабых кислот
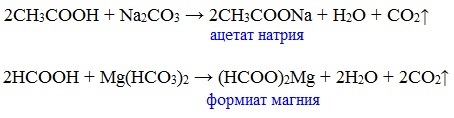

Сода (NaHCO3) и уксус
Видеоопыт «Взаимодействие уксусной кислоты с карбонатом натрия»
д) взаимодействие с аммиаком или гидроксидом аммония
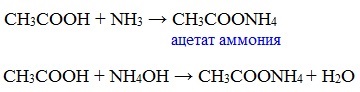
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
Видеоопыт «Свойства карбоновых кислот»
Свойства солей карбоновых кислот
1) Взаимодействие с сильными кислотами
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
![]()
Из неорганических кислот лишь угольная кислота слабее рассматриваемых кислот и может вытесняться ими из её солей — карбонатов и гидрокарбонатов.
Качественная реакция на ацетат-ион СН3СОО— ! Запах уксусной кислоты.
2) Гидролиз по аниону
Натриевыс и калиевые соли карбоновых кислот в водных растворах находятся частично в гидролизованном состояния.
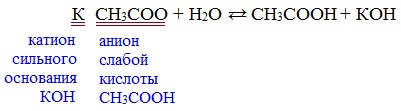
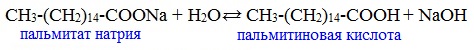
Этим объясняется щелочная реакция мыльного раствора.

Видеоопыт «Гидролиз ацетата натрия»
3) Электролиз солей активных металлов (реакция Кольбе)
Одним из применений солей карбоновых кислот является электролиз их водных растворов, в результате которого образуются насыщенные углеводороды:
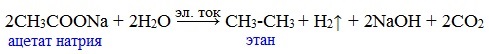
Электролизом раствора соли карбоновой кислоты можно получить алкан с удлиненной цепью.
4) Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны:
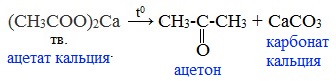
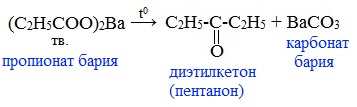
4) Декарбоксилирование солей щелочных металлов (реакция Дюма)
В процессе сплавления солей карбоновых кислот с твердой щелочью происходит расщепление углеродной связи и образуются алканы с числом атомов углерода на один меньше, чем у исходной кислоты:
II. Реакции с разрывом связи C-О
(замещение ОН-группы)
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН с образованием функциональных производных карбоновых кислот (сложных эфиров, амидов, ангидридов и галогенангидридов).
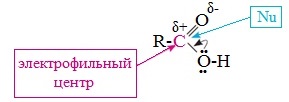
1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации)
Карбоновые кислоты при нагревании в присутствии кислотного катализатора реагируют со спиртами, образуя сложные эфиры:
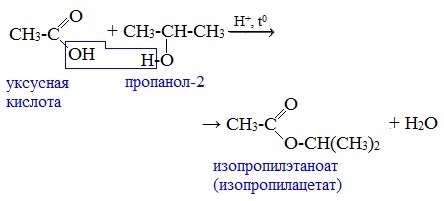
Механизм этой реакции был установлен методом меченых атомов. С этой целью использовали спирт, меченный изотопом кислорода 18О. После реакции изотоп кислорода был обнаружен в молекуле сложного эфира.
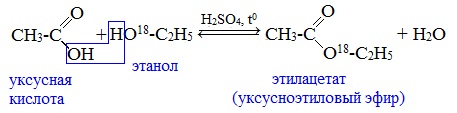
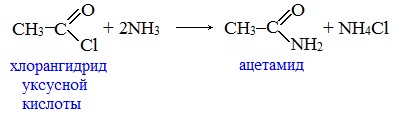
2. Взаимодействие с аммиаком с образованием амидов
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:

Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
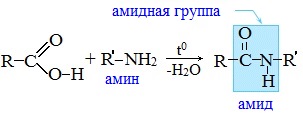
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп — пептидных связей.
3. Взаимодействие с галогенидами фосфора или тионилхлоридом с образованием галогенангидридов карбоновых кислот
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты –галогениды фосфора PCl3, PCl5, тионилхлорид SOCl2.
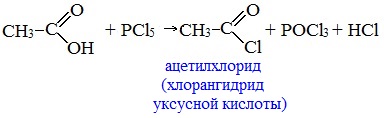
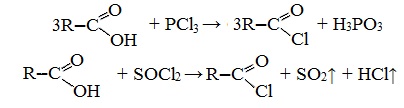
Для получения хлорангидридов чаще используют тионилхлорид, так как в этом случае образуются газообразные побочные продукты.
Галогенангидриды карбоновых кислот — весьма реакционноспособные вещества, широко применяемые в органическом синтезе.
4. Образование ангидридов кислот (межмолекулярная дегидратация)
Ангидриды кислот образуются в результате межмолекулярной дегидратации кислот при их нагревании в присутствии оксида фосфора (V) в качестве водоотнимающего средства.
Вещества, которые образуются при отщеплении воды от органических кислот, называются ангидридами.
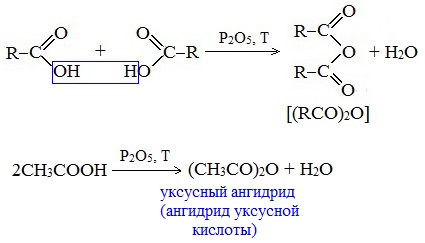
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты с безводной солью другой карбоновой кислоты: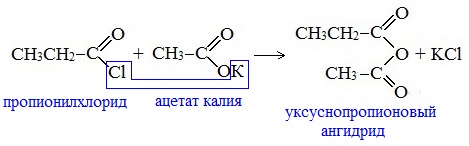
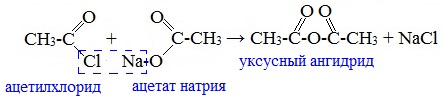
Муравьиная кислота не образует ангидрида. Дегидратация ее приводит к образованию оксида углерода (II).
Наиболее широкое применение находит уксусный ангидрид. Большое количество его расходуется для синтеза ацетилцеллюлозы, которая идет на изготовление искусственного шелка. Уксусный ангидрид используется также для получения аспирина.
III. Реакции с разрывом связи C-Н у ɑ-углеродного атома
(реакции с участием радикала)
1. Реакции замещения (с галогенами)
Атомы водорода у ɑ-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образование ɑ-галогенкарбоновых кислот.
Карбоновые кислоты взаимодействуют с галогенами в присутствии красного фосфора (реакция Геля-Фольгарда-Зелинского):

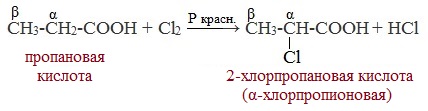
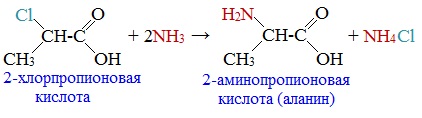
2-Хлорпропионовая кислота – промежуточный продукт для получения аминокислот. Действием на 2-хлорпропионовую кислоту аммиака получают 2-аминопропионовую кислоту (аланин):
 При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:
При пропускании хлора через кипящую уксусную кислоту в присутствии красного фосфора образуется кристаллическое вещество – хлоруксусная кислота:
Дальнейшее хлорирование приводит к образованию дихлоруксусной и трихлоруксусной кислот:
IV. Реакции окисления (горение)
В атмосфере кислорода карбоновые кислоты сгорают с образованием оксида углерода (IV) СО2 и Н2О:
![]()
Видеоопыт «Горение уксусной кислоты на воздухе»
В отличие от альдегидов, карбоновые кислоты достаточно устойчивы к действию даже такого сильного окислителя, как перманганат калия. Исключение составляет муравьиная кислота, которая проявляет восстановительные свойства благодаря наличию альдегидной группы.
V. Реакции каталитического восстановления
Карбоновые кислоты с трудом восстанавливаются каталитическим гид-рированием, однако при взаимодействии с алюмогидридом лития (LiAlH4) или дибораном (В2Н6) восстановление осуществляется достаточно энергично:
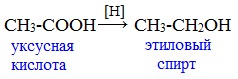
Сравнение химических свойств органических и неорганических кислот
Особенности строения и свойства муравьиной кислоты
 Муравьиная (метановая) кислот
Муравьиная (метановая) кислот