Какое вещество имеет хотя бы одно свойство с солью и водой
Что общего у воды и соли? Ninaarc 4 года назад Между водой и солью общего нет ничего, но в любой из природных жидкостей всегда растворены соли. Содержание соли в природных водоемах и источниках может различаться в тысячи раз, но даже в кристально чистом ручейке имеются микродозы солей. Больше всего соли находится в морской воде, что мы можем ощутить на вкус, а соленость объясняется содержанием в ней хлористого натрия, то есть поваренной соли. В воде морей и океанов содержится около 80 % соли от всего состава растворенных в ней веществ. В пресных водах рек преобладают карбонаты и их содержание намного меньше, чем в морях. Даже в дождевой воде содержатся миллиграммы солей, а их количество зависит от местности в которой образовалось облако, а также от того, через какую территорию оно продвигалось. Поэтому между водой и солью имеется прочная связь, хотя они и представляют собой совершенно разные вещества. автор вопроса выбрал этот ответ лучшим [пользователь заблокирован] 2 года назад Соль это вещество, без которого просто не реально посолить рыбу, мясо, грибы и капусту. А все, вышеперечисленные продукты питания, содержат в себе воду, без которой ничего посолить не получится. Да и сама соль, вернее её 80% от всех запасов земли, содержится в воде(моря, океаны и иногда озёра). Вывод: общее у соли и воды — это безальтернативное существование одна в другой, иначе кто знает на кого бы и мы были сейчас похожи, будь всё по другому. Вполне возможно, что по теории Дарвина, притормозить можно было ещё на той стадии, которая отображена на фото ниже. Вот тогда вряд ли бы сейчас кто-то спрашивал и отвечал про соль и воду. Отдыхали бы себе спокойно где то на природе, и не обращали внимания ни на соль, и ни на воду.. lady v 4 года назад Мне кажется в нашем мире можно найти что-то общее даже у самых разных веществ и понятий. Например соль и вода на первый взгляд не имеют ничего общего. Вода жидкая, соль твердая, кристаллическая, вода не имеет вкуса и цвета, соль имеет и цвет и вкус, конечно соленый. Но ведь и то и другое сложное химическое вещество. Соль растворяется в воде, но это общее свой свойство, ведь нельзя сказать, что вода растворяется в соли. А вот упомянутые мною выше кристаллы соли ничего вам не напоминают? Конечно, ведь и снежинки и льдинки имеют тоже кристаллическую структуру. То есть вода в твердом состоянии также состоит из кристаллов. Можно найти еще несколько сходных признаков, но эти самые очевидные. [пользователь заблокирован] 5 лет назад У воды и соли нет ничего общего, кроме того, что хлорид натрия, а именно поваренная соль растворена в воде. Напомню химическую формулу воды: Н2О, а химическая формула соли NaCl где общее? Таким образом можно спросить, например: Что общего у человека и железа? Да ничего, кроме того, что железо входит в состав гемоглобина человека. Так что выходит, что всё в этом Мире взаимосвязано, но искать общее вовсе не обязательно. Как говорят в народе: Суп отдельно, а мухи отдельно:-) Инна Бедак 2 года назад Поваренная соль, это хлорид натрия NaCl, а вода имеет формулу Н2О. Соль это кристаллическое вещество, вода это жидкость. И кроме того, сто соль способна растворяться в воде, между водой и солью нет ничего общего. Знаете ответ? |
Здравствуйте, Дорогие мои!!!
Урок 4 –это продолжение темы «Определение
возможности осуществления химических реакций».
На этом уроке мы с вами
рассмотрим взаимодействие Соли с Солью и
условия, при которых реакции могут проходить. Мы рассмотрели 4 правила на первом, втором и
третьем уроке, сегодня:
Правило
5
Реакция соли с солью происходит, если обе исходные соли растворимы
в воде или малорастворимы в воде, а один из продуктов реакции нерастворим или молорастворим в воде.
УСЛОВИЯ
Соль + соль
→ новая соль + новая
соль
Обе исходные соли Хотя бы один из продуктов
нерастворимая или малорастворимая соль
растворимы или
малорастворимы
Задание 12
Определите, можно ли провести реакцию между
веществами, формулы которых: Ba(NO3)2 и Na2SO4
Решение
1. Определите, к каким классам принадлежат реагирующие
вещества
Ba(NO3)2 + Na2SO4→
2.Вспомните условия, при котором возможна реакция соли с
солью
Соль + соль → новая соль + новая
соль
Обе исходные соли Хотя бы один из продуктов
нерастворимая или малорастворимая соль
растворимы или
малорастворимы
3.Определим растворимость по таблице растворимости
соль соль соль соль
Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
Растворима растворима
нерастворима растворима
Вывод
Реакция между веществами, формулы которых: Ba(NO3)2 и Na2SO4 , осуществима,
так как выполняются оба условия.
Задание 13
Определите, можно ли провести реакцию между
веществами, формулы которых: MgCl2 и CaCO3
1. Определите, к каким классам принадлежат реагирующие
вещества
Соль соль
MgCl2 +
CaCO3
→
2.Вспомните условия, при котором возможна реакция соли
с солью
Соль + соль →
новая соль + новая соль
3.Определим растворимость по таблице растворимости
Реакция соли с солью происходит, если обе исходные соли растворимы
в воде или малорастворимы в воде, а один из продуктов реакции нерастворим или молорастворим в воде.
Соль Соль
MgCl2 + CaCO3 →
Растворима нерастворима ( а
должна быть, малорастворимой)
Вывод:
Реакция между веществами, формулы которых: MgCl2 и CaCO3
невозможна, так как не выполняется одно из
условий, поэтому проверять растворимость
получающихся солей не имеет смысла.
Задание 14
Определите, можно ли провести реакцию между
веществами, формулы которых: NaNO3 + BaCl2
1. Определите, к каким классам принадлежат реагирующие
вещества
Соль
соль
NaNO3 + BaCl2→
2.Вспомните условия, при котором возможна реакция соли
с солью
Реакция соли с солью происходит, если обе исходные соли растворимы
в воде или малорастворимы в воде, а один из продуктов реакции нерастворим или молорастворим в воде.
Соль +
соль → новая соль + новая соль
3.Определим растворимость по таблице растворимости.
Соль соль Соль соль
2NaNO3 + BaCl2 →2NaCl + Ba(NO3)2
Растворима
растворима
растворима растворима
Вывод:
Реакция между веществами, формулы которых: NaNO3 + BaCl2
невозможна, так как не выполняется одно из
условий (хотя бы один из продуктов – нерастворимая соль)
Литература:
Понравилось???
Не забывайте поделиться, с друзьями.
Желаю здоровья Вам и Вашим близким!!!
Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.



Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
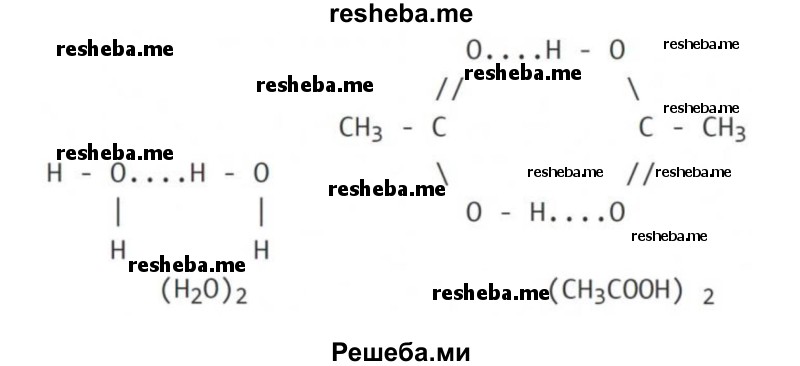
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (H2S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (H2S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Вариант 1
Задание №1.
Распределение электронов по электронным слоям 2е, 8е, 8е, 1е соответствует химическому элементу, который в периодической системе находится:
1. В 3-м периоде, IIБ группе
2. Во 2-м периоде, IVБ группе
3. В 4-м периоде, IА группе
4. В 4-м периоде, IIА группе
Объяснение: химический элемент имеет 4 электронных слоя, то есть находится в 4-м периоде. На внешнем слое элемент имеет только один электрон, значит стоит в первой группе 4-го периода. Правильный ответ — 3.
Задание №2.
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1. Натрий → магний → алюминий
2. Бериллий → магний → алюминий
3. Барий → стронций → кальций
4. Калий → натрий → литий
Объяснение: металлические свойства элементов усиливаются в группе сверху вниз и в периоде справа налево, то есть надо найти последовательность элементов, которые будут соответствовать этой закономерности. Это — вторая последовательность. Правильный ответ — 2.
Задание №3.
Ковалентной полярной связью образовано каждое из веществ, формулы которых:
1. Cl2, N2, O3
2. O2, P4, NH3
3. SO2, H2S, OF2
4. CO, CH4, H2
Объяснение: ковалентная полярная связь образуется между двумя разными неметаллами. Рассмотрим вариант 3: сера, кислород, водород и фтор являются неметаллами. Все эти вещества образованы двумя разными неметаллами, что нам подходит. Правильный ответ — 3.
Задание №4.
Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
1. HF → CH4 → H2O → NH3
2. SiH4 → AsH3 → H2S → HCl
3. HF → H2O → NH3 → CH4
4. SiH4 → H2S → AsH4 → HCl
Объяснение: определим степени окисления всех неметаллов во всех приведенных соединениях водорода.
1. HF(-1) → C(-4)H4 → H2O(-2) → N(-3)H3
2. Si(+4)H4 → As(+3)H3 → H2S(-2) → HCl(-1)
3. HF(-1) → H2O(-2) → N(-3)H3 → C(-4)H4
4. Si(+4)H4 → H2S(-2) → As(+3)H3 → HCl(-1)
Правильный ответ — 3.
Задание №5.
К солям относится каждое из двух веществ:
1. Fe2(SO4)3 и AlCl3
2. Ba(NO3)2 и H3PO4
3. Li2SO4 и Fe(OH)3
4. ZnS и CaO
Объяснение: соли состоят из катиона металла и аниона кислотного остатка. Соли получаются по реакции нейтрализации, например:
2NaOH + H2SO4 → Na2SO4 + H2O
Поэтому, нам подходит первый вариант ответа: сульфат железа (III) и хлорид алюминия. Правильный ответ — 1.
Задание №6.
К химическим явлениям не относится процесс:
1. Брожение сахара
2. Горение свечи
3. Перегонки воды
4. Горение спирта
Объяснение: химическое явление — такое явление, при котором происходит хотя бы одна химическая реакция. Так, химическая реакция идет при брожении сахара, горении свечи и спирта. Перегонка воды — это дистилляция (нагревание до 100С воды с последующей конденсацией паров). Правильный ответ — 3.
Задание №7.
Только катионы калия и фосфат-анионы образуются при диссоциации вещества формулы которого?
1. K2HPO4
2. Ca3(PO4)2
3. KH2PO4
4. K3PO4
Объяснение: образование только катионов калия фосфат-ионов возможно только если в состав молекулы входят эти ионы, то есть подходит только фосфат калия. Проверяем: К3РО4 → К+ + РО4³‾. Правильный ответ — 4.
Задание №8.
Уравнению реакции
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
соответствует сокращенное ионное уравнение:
1. Н+ + ОН‾ → Н2О
2. Zn(OH)2 + 2Н+ → Zn²+ + 2H2O
3. Zn²+ + SO4²‾ → ZnSO4
4. Zn²+ + H2SO4 → Zn²+ + SO4²‾ + Н+
Объяснение: гидроксид цинка нерастворим, поэтому и диссоциировать в воде он не будет, поэтому нам подходит только второй вариант. Правильный ответ — 2.
Задание №9.
Верны ли следующие суждения о щелочных металлах?
А. При взаимодействии с галогенами щелочные металлы образуют соли.
Б. С водой щелочные металлы вступают в реакции замещения.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: верны оба суждения.
Докажем это реакциями:
2Na + Cl2 → 2NaCl
2K + 2H2O → 2KOH + H2↑
Правильный ответ — 3.
Задание №10.
Оксид углерода (IV) взаимодействует с каждым из двух веществ:
1. Вода и сернистая кислота
2. Оксид кальция и гидроксид кальция
3. Вода и медь
4. Кислород и оксид магния
Объяснение: СО2 — кислотный оксид, при взаимодействии с водой образует угольную кислоту, с кислотами не взаимодействует (так как в реакцию не вступают два вещества с одинаковыми свойствами), оксислиться кислородом не может, так как углерод находится в высшей степени окисления (+4). То есть СО2 вступает в реакцию с веществами, имеющими основные свойства, то есть оксид кальция и гидроксид калия. Правильный ответ — 2.
Задание №11.
Раствор серной кислоты взаимодействует с каждым из двух веществ:
1. Хлорид бария и оксид углерода (IV)
2. Железо и нитрат бария
3. Карбонат натрия и сероводород
4. Ртуть и гидроксид меди (II)
Объяснение: разбавленная серная кислота вступает в реакцию с металлами, стоящими в ряду напряжений металлов до водорода — это железо, но не ртуть. Кислоты не взаимодействуют с кислотными оксидами (СО2) и другими кислотами (сероводород), вступают в реакцию обмена с солями. если при этом выпадает осадок или выделяется газ. Учитывая все перечисленное выше, запишем химические реакции раствора серной кислоты с веществами из варианта 2:
H2SO4 + Fe → FeSO4 + H2↑
H2SO4 + Ba(NO3)2 → 2HNO3 + BaSO4↓
Правильный ответ — 2.
Задание №12.
Среди веществ: KCl, K2S, K2SO4 — в реакцию с раствором Zn(NO3)2 вступают
1. Только K2S
2. KCl и K2S
3. KCl и K2SO4
4. K2S и K2SO4
Объяснение: соли вступают в реакцию обмена только при образовании осадка или выделении газа.
Напишем соответствующие реакции:
Zn(NO3)2 + 2KCl ≠ 2KNO3 + ZnCl2 (реакция не идет так как оба продукта растворимы)
Zn(NO3)2 + K2S → 2KNO3 + ZnS↓
Zn(NO3)2 + K2SO4 → ZnSO4 + 2KNO3 (реакция не идет так как оба продукта растворимы)
Правильный ответ — 1.
Задание №13.
Верны ли следующие сужения об обращении с газами в процессе лабораторных опытов?
А. Прежде, чем поджечь водород, его необходимо проверить на чистоту.
Б. Полученный из бертолетовой соли хлор нельзя определять по запаху.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: при реакции водорода с кислород получается вода, данная реакция идет со взрывом, перед поджиганием водород нужно проверить на чистоту, чтобы не допустить образование примесей. Ни хлор, ни любой другой газ нельзя определять по запаху. Правильный ответ — 3.
Задание №14.
Окислительные свойства водород проявляет в реакции, уравнение которой
1. CuO + H2 → Cu + H2O
2. H2 + Cl2 → 2HCl
3. Ca + H2 → CaH2
4. 2H2 + O2 → 2H2O
Объяснение: окислительные свойства водород проявляет только в гидридах, где имеет степень окисления -1. Среди продуктов представленных реакций есть один гидрид — гидрид кальция, в этой реакции водород и является окислителем. Правильный ответ — 3.
Задание №15.
Массовая доля натрия в сульфате натрия составляет:
1. 0,32
2. 0,64
3. 0,96
4. 0,48
Объяснение: для нахождения массовой доли натрия в сульфате натрия воспользуемся формулой:
ω = (n x Ar(Na))/Mr(Na2SO4)
n — количество атомов элемента в веществе
Здесь нужно не забыть, что в данной соли два натрия!
Находим:
ω(Na) = 2х23/142 = 0,324
Правильный ответ — 1.
Задание №16.
В ряду химических элементов Al → Si → P
1. Увеличивается заряд ядер атомов
2. Возрастают кислотные свойства образуемых ими гидроксидов
3. Увеличивается число электронных уровней
4. Уменьшается электроотрицательность
5. Возрастает атомный радиус
Объяснение: представленные элементы находятся в третьем периоде, стоят друг за другом и имеют порядковые номера — 13,14,15 соответственно. В периоде увеличивается электроотрицательность (а с ней и неметаллические свойства) и уменьшается радиус, но увеличивается заряд ядер атомов (равен порядковому номеру). Правильный ответ — 12.
Задание №17.
Для метана характерны следующие утверждения
1. В состав молекулы входят два атома углерода
2. Характерны реакции присоединения
3. Не растворяется в воде
4. Обесцвечивает бромную воду
5. Вступает с хлором в реакции замещения
Объяснение: формула метана — СН4, это алкан, то есть он не вступает в реакции присоединения (значит бромную воду не может обесцвечивать как этилен). Но вступает в реакцию замещения с хлором и не растворяется в воде. Правильный ответ — 35.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества Реактив
А) Fe и Ag 1. AgNO3(р-р)
Б) CaO и CaCO3 2. Фенолфталеин
В) NH3(р-р) и NH4Cl(р-р) 3. Na2SO4
4. HCl
Объяснение: железо и серебро будем различать соляной кислотой, так как с железом она будет реагировать, а с серебром — нет (растворы кислот реагируют с металлами до водорода), соляной кислотой отличим и оксид кальция от карбоната кальция: при реакции с карбонатом кальция выделится углекислый газ. Раствор аммиак имеет щелочную среду, а раствор хлорида аммиака — кислую, что нам покажет индикатор — фенолфталеин. Правильный ответ — 442.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества Реагенты
А) Фтор 1. ZnO, Mg
Б) Соляная кислота 2. Al, H2O
В) Хлорид натрия 3. SiO2, CuO
4. H2SO4(конц), AgNO3(р-р)
Объяснение: фтор реагирует с алюминием с образованием соли и с водой (с образованием фтороводорода и кислорода). Соляная кислота реагирует с оксидом цинка (реакция обмена) и магнием (реакция замещения водорода). Хлорид натрия реагирует с концентрированной серной кислотой и нитратом серебра (качественная реакция на хлорид-ионы). Правильный ответ — 214.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
CuSO4 + KI → K2SO4 + CuI + I2
Определите окислитель и восстановитель.
Объяснение: CuSO4 + KI → K2SO4 + CuI + I2
В данной реакции меняют степени окисления йод и медь. Запишем электронно-ионный баланс.
Cu(+2) +1e→ Cu(+1) | 2 (окислитель)
2I‾ -2e→ I2° | 1 (восстановитель)
Ставим двойку перед йодидом калия (так как она есть в балансе) и перед медью. Двойку перед йодидом калия поменяем на 4, так как в правой части получилось 4 йода. Уравниваем калий справа и сульфат-ионы, получаем такой результат:
2CuSO4 + 4KI → 2K2SO4 + 2CuI + I2
Задание №21.
К раствору нитрата бария добавили 200 г раствора серной кислоты и получили 9,32 г соли. Какова массовая доля кислоты (в %) в исходном растворе?
Объяснение: запишем уравнение реакции, найдем количество вещества сульфата бария, такое же количество вещества и серной кислоты, найдем массу кислоты (вещества), затем найдем массовую долю.
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
n(BaSO4) = 9,32/235 = 0,04 моль
n(H2SO4) = n(BaSO4) = 0,04 моль
m(H2SO4 вещества) = 0,04 x 98 = 3,92 г
ω(H2SO4) = 3,92/200 x 100% = 1,96%
Ответ: массовая доля кислоты в исходном растворе равна 1,96%.
Задание №22.
Даны вещества: CuCl2, H2SO4(), Fe, Na2O, KOH, Na2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: есть несколько способов получить нужное вещество. Приведем один из них.
Fe + CuCl2 → FeCl2 + Cu
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
