Какое свойство отличает аморфное тело от кристалла

Сравнение атомной решетки кристаллов и аморфных тел
Амо́рфные вещества́ (тела́) (от др.-греч. ἀ «не-» + μορφή «вид, форма») — конденсированное состояние веществ, атомная структура которых имеет ближний порядок и не имеет дальнего порядка, характерного для кристаллических структур. В отличие от кристаллов, стабильно-аморфные вещества не затвердевают с образованием кристаллических граней, и, (если не были под сильнейшим анизотропным воздействием — сжатием или электрическим полем, например) обладают изотропией свойств, то есть не обнаруживают различия свойств в разных направлениях. Аморфные вещества не имеют определённой точки плавления: при повышении температуры стабильно-аморфные вещества постепенно размягчаются и выше температуры стеклования (Tg) переходят в жидкое состояние. Вещества, обычно имеющие (поли-)кристаллическую структуру, но сильно переохлаждённые при затвердевании, могут затвердевать в аморфном состоянии, которое при последующем нагреве или с течением времени кристаллизуется (в твёрдом состоянии с небольшим выделением тепла).
Аморфное состояние многих веществ получается при высокой скорости затвердевания (остывания) жидкого расплава, или при конденсации паров на охлаждённую заметно ниже температуры плавления поверхность-подложку. Соотношение реальной скорости охлаждения (dT/dt) и характеристической скорости кристаллизации определяет долю поликристаллов в аморфном объёме. Скорость кристаллизации — параметр вещества, слабо зависящий от давления и от температуры (около точки плавления) и сильно зависящий от сложности состава. У металлов и сплавов аморфное состояние формируется, как правило, если расплав охлаждается за время порядка сотни и тысячи лет; для стёкол достаточно намного меньшей скорости охлаждения — долей-десятков миллисекунд . Кварц (SiO2) также имеет низкую скорость кристаллизации, поэтому отлитые из него изделия получаются аморфными. Однако природный кварц, имевший сотни и тысячи лет для кристаллизации при остывании земной коры или глубинных слоёв вулканов, имеет крупнокристаллическое строение, в отличие от вулканического стекла, застывшего на поверхности и поэтому аморфного.
Из обычных полимеров (пластмасс) только самый простой (полиэтилен) имеет заметную скорость кристаллизации при комнатной температуре — порядка двух лет для мягкого (ПВД) и нескольких лет (даже с добавками-замедлителями) для твёрдого (ПНД) — уже примерно наполовину кристаллизованного вида. Это одна из причин недолговечности изделий из полиэтилена.
К стабильно-аморфным веществам принадлежат стекла (искусственные и вулканические), естественные и искусственные смолы, клеи, парафин, воск и др. Аморфные вещества могут находиться либо в стеклообразном состоянии (при низких температурах), либо в состоянии расплава (при высоких температурах). Аморфные вещества переходят в стеклообразное состояние при температурах заметно ниже температуры стеклования Tg. При температурах намного выше Tg аморфные вещества ведут себя как расплавы, то есть находятся в расплавленном состоянии. Вязкость аморфных материалов — непрерывная функция температуры: чем выше температура, тем ниже вязкость аморфного вещества.
Структура[править | править код]
Исследования показали, что структуры жидкостей и аморфных тел имеют много общего.
В аморфных и жидких телах наблюдается ближний порядок в упаковке частиц (атомов или молекул).
Также бывают промежуточные полуаморфные (полукристаллические) состояния.
Свойства[править | править код]
Все физические свойства аморфного и поликристаллического состояний одного и того же вещества, кроме плотности, заметно (иногда сильно) отличаются.
Электрические и механические свойства аморфных веществ ближе к таковым для монокристаллов, чем для поликристаллов, из-за отсутствия резких и сильно загрязнённых примесями межкристаллических границ с зачастую абсолютно другим химическим составом. Немеханические свойства полуаморфных состояний обычно являются промежуточными между аморфными и кристаллическими и изотропны.
При внешних воздействиях аморфные вещества обнаруживают одновременно упругие свойства, подобно кристаллическим твёрдым веществам, и текучесть, подобно жидкости, поэтому моделируются в механике сплошных сред как вязкоупругие среды. Так, при кратковременных воздействиях (ударах) они ведут себя как твёрдые вещества и при сильном ударе раскалываются на куски. Но при очень продолжительном воздействии (например, растяжении) аморфные вещества текут. Так, аморфным веществом также является смола (или гудрон, битум). Если раздробить её на мелкие части и получившейся массой заполнить сосуд, то через некоторое время смола сольётся в единое целое и примет форму сосуда.
В зависимости от электрических свойств, разделяют аморфные металлы, аморфные неметаллы и аморфные полупроводники.
Литература[править | править код]
- Скрышевский А. Ф. Структурный анализ жидкостей и аморфных тел. — 2-е изд., перераб. и доп.. — М.: Высшая школа, 1980. — С. 302-324. — 328 с.
- Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. — Л.: Наука, 1988. — 200 с. — ISBN 5-02-024564-X.
См. также[править | править код]
- Опыт с капающим пеком
- Неньютоновская жидкость
Подробности
Просмотров: 1020
Твердые тела отличаются постоянством формы и объема и делятся на кристаллические и аморфные.
Кристаллические тела
Кристаллические тела (кристаллы) — это твердые тела, атомы или молекулы которых занимают упорядоченные положения в пространстве.
Частицы кристаллических тел образуют в пространстве правильную кристаллическую пространственную решетку.

Каждому химическому веществу, находящемуся в кристаллическом состоянии, соответствует определенная кристаллическая решетка, которая задает физические свойства кристалла.
Знаете ли вы?
Много лет назад в Петербурге на одном из неотапливаемых складов лежали большие запасы белых оловянных блестящих пуговиц. И вдруг они начали темнеть, терять блеск и рассыпаться в порошок. За несколько дней горы пуговиц превратились в груду серого порошка. «Оловянная чума» — так к прозвали эту «болезнь» белого олова.
А это была всего лишь перестройка порядка атомов в кристаллах олова. Олово, переходя из белой разновидности в серую, рассыпается в порошок.
И белое и серое олово — это кристаллы олова, но при низкой температуре изменяется их кристаллическая структура, а в результате меняются физические свойства вещества.
Кристаллы могут иметь различную форму и ограничены плоскими гранями.
В природе существуют:
а) монокристаллы — это одиночные однородные кристаллы, имеющие форму правильных многоугольников и обладающие непрерывной кристаллической решеткой
Монокристаллы поваренной соли:

б) поликристаллы — это кристаллические тела, сросшиеся из мелких, хаотически расположенных кристаллов.
Большинство твердых тел имеет поликристаллическую структуру (металлы, камни, песок, сахар).
Поликристаллы висмута:

Анизотропия кристаллов
В кристаллах наблюдается анизотропия — зависимость физических свойств (механической прочности, электропроводности, теплопроводности, преломления и поглощения света, дифракции и др.) от направления внутри кристалла.
Анизотропия наблюдается в основном в монокристаллах.
В поликристаллах (например, в большом куске металла) анизотропия в обычном состоянии не проявляется.
Поликристаллы состоят из большого количества мелких кристаллических зерен. Хотя каждый из них обладает анизотропией, но за счет беспорядочности их расположения поликристаллическое тело в целом утрачивает анизотропию.
Любое кристаллическое вещество плавится и кристаллизуется при строго определенной температуре плавления: железо — при 1530°,олово — при 232°, кварц — при 1713°, ртуть — при минус 38°.
Нарушить порядок расположения в кристалле частицы могут, только если он начал плавиться.
Пока есть порядок частиц, есть кристаллическая решетка — существует кристалл. Нарушился строй частиц — значит, кристалл расплавился — превратился в жидкость, или испарился — перешел в пар.
Аморфные тела
Аморфные тела не имеют строгого порядка в расположении атомов и молекул (стекло, смола, янтарь, канифоль).

В амофных телах наблюдается изотропия — их физические свойства одинаковы по всем направлениям.
При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства (при ударах раскалываются на куски как твердые тела) и текучесть (при длительном воздействии текут как жидкости).
При низких температурах аморфные тела по своим свойствам напоминают твердые тела, а при высоких температурах — подобны очень вязким жидкостям.
Аморфные тела не имеют определенной температуры плавления, а значит,и температуры кристаллизации.
При нагревании они постепенно размягчаются.
Аморфные тела занимают промежуточное положение между кристаллическими твердыми телами и жидкостями.
Интересно
Одно и то же вещество может встречаться и в кристаллическом и в некристаллическом виде.
В жидком расплаве вещества частицы движутся совершенно беспорядочно.
Если, например, расплавить сахар, то:
1. если расплав застывает медленно, спокойно, то частицы собираются в ровные ряды и образуются кристаллы. Так получается сахарный песок или кусковой сахар;

2. если остывание происходит очень быстро, то частицы не успевают построиться правильными рядами и расплав затвердевает некристаллическим. Так, если вылить расплавленный сахар в холодную воду или на очень холодное блюдце, образуется сахарный леденец, некристаллический сахар.
Удивительно!
С течением времени некристаллическое вещество может «переродиться», или, точнее, закристаллизоваться, частицы в них собираются в правильные ряды.
Только срок для разных веществ различен:для сахара это несколько месяцев, а для камня — миллионы лет.
Пусть леденец полежит спокойно месяца два-три.Он покроется рыхлой корочкой. Посмотрите на нее в лупу: это мелкие кристаллики сахара. В некристаллическом сахаре начался рост кристаллов. Подождите еще несколько месяцев — и уже не только корочка, но и весь леденец закристаллизуется.
Даже наше обыкновенное оконное стекло может закристаллизоваться. Очень старое стекло становится иногда совершенно мутным,потому что в нем образуется масса мелких непрозрачных кристаллов.
На стекольных заводах иногда в печи образуется «козел», то есть глыба кристаллического стекла. Это кристаллическое стекло очень прочное.Легче разрушить печь, чем выбить из нее упрямого «козла».
Исследовав его, ученые создали новый очень прочный материал из стекла — ситалл. Это стеклокристаллический материал, полученный в результате объёмной кристаллизации стекла.
Любопытно!
Могут существовать разные кристаллические формы одного и того же вещества.
Например, углерод.

Графит — это кристаллический углерод. Из графита сделаны стержни карандашей, которые оставляют след на бумаге при легком надавливании. Структура графита слоиста. Слои графита легко сдвигаются, поэтому чешуйки графита пристают к бумаге при письме.
Но существует и другая форма кристаллического углерода — алмаз.
Так расположены атомы углерода в кристалле графита (слева) и алмаза (справа).
Алмаз — самый твердый на земле минерал.

Алмазом режут стекло и распиливают камни, применяют для бурения глубинных скважинах, полируют сверхтвердые сплавы, алмазы необходимы для производства тончайшей металлической проволоки диаметром до тысячных долей миллиметра, например, вольфрамовых нитей для электроламп.
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Твердыми являются кристаллические и аморфные тела. Кристалл — так в древности называли лед. А потом стали называть кристаллом кварц и горный хрусталь, считая эти минералы окаменевшим льдом. Кристаллы бывают природными и искусственными (синтетическими). Они используются в ювелирной промышленности, оптике, радиотехнике и электронике, в качестве опор для элементов в сверхточных приборах, как сверхтвердый абразивный материал.
Кристаллические тела характеризуются твердостью, имеют строго закономерное положение в пространстве молекул, ионов или атомов, в результате чего образуется трехмерная периодическая кристаллическая решетка (структура). Внешне это выражается определенной симметрией формы твердого тела и его определенными физическими свойствами. Во внешней форме кристаллические тела отражают симметрию, свойственную внутренней «упаковке» частиц. Это определяет равенство углов между гранями всех кристаллов, состоящих из одного и того же вещества.
В них равными будут и расстояния от центра до центра между соседствующими атомами (если они расположены на одной прямой, то это расстояние будет одинаковым на всей протяженности линии). Но для атомов, лежащих на прямой с другим направлением, расстояние между центрами атомов будет уже иным. Этим обстоятельством объясняется анизотропия. Анизотропность — главное, чем отличаются кристаллические тела от аморфных.

Более 90% твердых тел можно отнести к кристаллам. В природе они существуют в виде монокристаллов и поликристаллов. Монокристаллы — одиночные, грани которых представлены правильными многоугольниками; для них характерно наличие непрерывной кристаллической решетки и анизотропии физических свойств.
Поликристаллы — тела, состоящие из множества мелких кристаллов, «сросшихся» между собой несколько хаотично. Поликристаллами являются металлы, сахар, камни, песок. В таких телах (например, фрагмент металла) анизотропия обычно не проявляется из-за беспорядочного расположения элементов, хотя отдельно взятому кристаллу этого тела свойственна анизотропия.
Другие свойства кристаллических тел: строго определенная температура кристаллизации и плавления (наличие критических точек), прочность, упругость, электропроводность, магнитопроводность, теплопроводность.

Аморфные — не имеющие формы. Так дословно переводится это слово с греческого. Аморфные тела созданы природой. Например, янтарь, воск, вулканическое стекло. К созданию искусственных аморфных тел причастен человек — стекло и смолы (искусственные), парафин, пластмассы (полимеры), канифоль, нафталин, вар. Аморфные вещества не имеют кристаллической решетки вследствие хаотичного расположения молекул (атомов, ионов) в структуре тела. Поэтому физические свойства для какого-либо аморфного тела изотропны — одинаковы во всех направлениях. Для аморфных тел не существует критической точки температуры плавления, они постепенно размягчаются при нагревании и переходят в вязкие жидкости. Аморфным телам отведено промежуточное (переходное) положение между жидкостями и кристаллическими телами: при низких температурах они твердеют и становятся упругими, кроме того, могут раскалываться при ударе на бесформенные куски. При высоких температурах эти же элементы проявляют пластичность, становясь вязкими жидкостями.
Теперь вы знаете, что такое кристаллические тела!
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
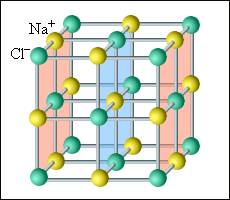
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl (рис. 3.6.1). Такие кристаллы называются ионными.
|
Рисунок 3.6.1. Кристаллическая решетка поваренной соли |
В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах.
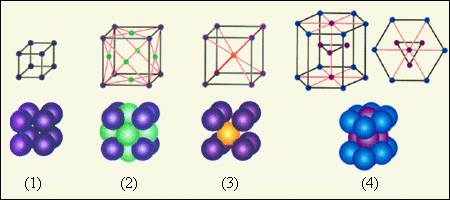
На рис. 3.6.2 приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
|
Рисунок 3.6.2. Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка |
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
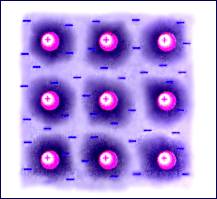
Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. 3.6.3). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.
|
Рисунок 3.6.3. Структура металлического кристалла |