Какое свойство одинаковое для газов и жидкостей
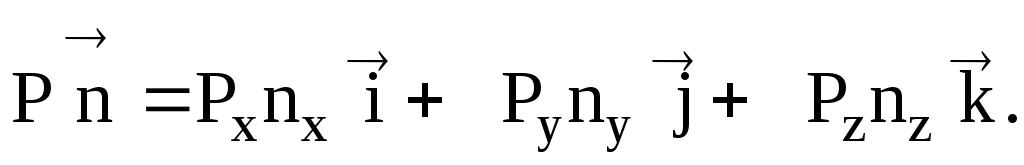

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характерное свойство жидких и газообразных тел – их текучесть, то есть малая сопротивляемость деформации сдвига: если скорость сдвига стремится к нулю, то силы сопротивления жидкости или газа этой деформации также стремятся к нулю. Иными словами, жидкие и газообразные вещества не обладают упругостью формы – они легко принимают форму того сосуда, в котором находятся.
Для изменения объема V жидкости или газа требуются конечные внешние силы. При изменении объема в результате внешних воздействий в жидкости и газе возникают упругие силы, которые уравновешивают действие внешних сил. Упругие свойства жидкости и газа определяются тем, что отдельные части их действуют друг на друга (взаимодействуют) или на соприкасающиеся с ними тела с силой, зависящей от степени сжимаемости жидкости или газа. Соответствующее взаимодействие характеризуют величиной, называемой давлением P.
Рассмотрим жидкость, находящуюся в равновесии, то есть в условиях, когда отдельные ее части не перемещаются друг относительно друга. Выделим элементарную площадку в жидкости DS (см. рис. 5.1). На DS действуют силы со стороны других частей жидкости, равные по величине, но противоположные по направлению. Для выяснения характера этих сил мысленно уберем жидкость над DS, и заменим ее равнодействующей силой Df, так, чтобы состояние других частей не было нарушено. Эти силы должны быть перпендикулярны DS, так как в противном случае тангенциальная составляющая сил привела бы частицы жидкости в движение вдоль DS, и равновесие было бы нарушено. Следовательно, равновесие жидкости будет иметь место, когда равнодействующая всех сил Df перпендикулярна DS.
Силу Df , отнесенную к единице поверхности площадки DS, называют давлением P, то есть
| (5.1.1) |
Если сила Df распределяется по DS неравномерно, то выражение (5.1.1) определяет среднее значение давления Pср. Чтобы найти давление в данной точке, необходимо устремить площадь DS к нулю: Давление в газе определяется аналогичным образом. Давление – скалярная величина и в системе СИ измеряется в Паскалях – Па = Н/м2.
Дата добавления: 2014-11-18; Просмотров: 2552; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
Анонимный вопрос · 14 февраля 2018
1,2 K
Как связаны свойства различных состояний со строением вещества?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Например, в твердых телах молекулы сильно сближены и связаны между собой и почти не движутся, составляют стройные кристаллические решетки. В жидкостях молекулы уже гораздо более подвижны, между ними больше расстояние и нет столь крепких связей, что позволяет жидкости иметь такое свойство, как текучесть. В газах молекулы находятся на большом расстоянии между собой и очень подвижны, поэтому газы — летучие вещества.
Железо твёрдое, потому что в нём молекулы и атомы спрессованы ближе друг у другу или в чём причина?
Researcher, Institute of Physics, University of Tartu
Нужно сначала избежать путаницы — «твердое» может значить две вещи: 1) агрегатное состояние, как твердое-жидкое-газ, и 2) механическая характеристика — твердость, как алмаз твердый, а мел — мягкий. Эти вещи в принципе связаны, но связь сложна и неоднозначная, поэтому не будем о ней :). Вероятно, Вы имеете в виду второе, механическую твердость (хотя железо отнюдь не чемпион, а вполне себе средненький материал по твердости, скорее для него имеет смысл говорить о довольно высокой прочности и пластичности).
Вы правы в том, что чем ближе элементы (молекулы, атомы, ионы) решетки друг к другу, тем прочнее будет свзь между ними. Но ключевым параметром здесь является тип химической связи, поскольку расстояние между атомами (молекулами, ионами) в решетке во многом определяется именно типом связи. Для железа, как и для других металлов, характерен металлический тип связи, когда, ну скажем, ионы металла в узлах решетки, а вокруг них общее электронное облако (это не совсем точное описание, но сгодится). Это дает 1) пластичность, поскольку связь кулоновская, а значит ненаправленная + ослабевает не так быстро при изменении расстояния. То есть, при сдвиге ионов из позиций (при механическом воздействии) связи не рвутся сразу, а имеют некий «запас прочности», 2) прочность, поскольку кулоновское взаимодействие достаточно сильное. Вот металлы они такие и есть — пластичные и прочные. Степень прочности/пластичности/твердости будет определяться во многом симметрией решетки, параметрами электронного газа и т.д.
Это можно сравнить с атомными кристаллами (типа того же алмаза) с ковалентными связями между атомами в узлах решетки (твердость может быть и повыше, поскольку если расстояние между атомами короткие, то энергия связи может быть очень высока. Зато пластичности никакой — связь направленная, любое смещение атома ее рвет). Или с молекулярными кристаллами, где связь между молекулами в узлах решетки Ван-дер-ваальсова (прочность никакая, поскольку энергия связи маленькая, зато пластичность может быть неплохая, поскольку связь ненаправленная, вопрос только в том, чтобы механическое воздействие было не слишком сильное, поскольку независимо от пластичности предел прочности очень низкий). Решетки с одним и тем же типом химсвязи всегда будут иметь много общего, хотя и могут различаться между собой достаточно сильно по количественным критериям в зависимости от других параметров.
Чем определяется агрегатное состояние вещества?
Агрегатное состояние вещества в первую очередь определяется расстоянием между молекулами. Если таковое расстояние меньше размера молекулы, то это твёрдое. Если примерно равно молекуле — то жидкость. Если больше — соответственно газообразное.
Какое давление на стенки сосуда производят молекулы газа?
бегаю марафоны, люблю Таню
Основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:
p=1/3 * m0 * n * υ²
Концентрацию молекул газа n находят как отношение числа молекул N к объему газа V:
n = N/V
Тогда имеем:
p=m0 *N * υ²/3V
Произведение массы одной молекулы m0 на количество молекул N по смыслу есть масса газа m, поэтому:
p=m * υ²/3V
Подставив в эту формулу исходные данные, можно вычислить какое давление на стенки сосуда производят молекулы газа.
Прочитать ещё 1 ответ
Теория строения жидкостей: сравнение со структурой газов и твердых тел Строение (структура) жидкостей. Структура жидкостей является в настоящее время предметом пристального изучения физико-химиков. Для исследований в этом направлении используются самые современные методы, включая спектральные (ИК, ЯМР, рассеивание света различных длин волн) , рассеивание ренгеновских лучей, квантово-механических и статистических методов расчета и т. д. Теория жидкостей разработана гораздо хуже, чем газов, поскольку свойства жидкостей зависят от геометрии и полярности взаимно близко расположенных молекул. Кроме того, отсутствие определенной структуры жидкостей затрудняет их формализованное описание – в большинстве учебников жидкостям уделено гораздо меньше места, чем газам и твердым кристаллическим веществам. Каковы же особенности каждого из трех агрегатных состояний вещества: твердого тела, жидкости и газа. (таблица)
1) Твердое: тело сохраненяет объем и форму
2) Жидкость сохраняют объем, но легко меняют форму.
3) Газ не имеют ни формы ни объема.
Эти состояния одного и того же вещества различаются не сортностью молекул (она одинакова) , а тем как молекулы расположены и движутся.
1) В газах расстояние между молекулами много больше размеров самих молекул
2) Молекулы жидкости не расходятся на большие расстояния и жидкость в обычных условиях сохраняет свой объем.
3) Частицы твердых тел расположены в определенном порядке. Каждая из частиц движется около определенной точки в кристаллической решетке, подобно маятнику часов, т. е. колеблется.
При понижении температуры жидкости затвердевают, а при повышении выше температуры кипения переходят в газообразное состояние. Уже этот факт указывает на то, что жидкости занимают промежуточное положение между газами и твердыми телами, отличаясь от того и другого. Однако жидкость имеет черты сходства с каждым из этих состояний.
Существует такая температура, при которой граница между газом и жидкостью полностью исчезает. Это, так называемая, критическая точка. Для каждого газа известна температура, выше которой он не может быть жидким ни при каком давлении; при этой критической температуре исчезает граница (мениск) между жидкостью и ее насыщенным паром. Существование критической температуры («температуры абсолютного кипения») установил Д. И. Менделеев в 1860 г. Второе свойство, объединяющее жидкости и газы – это изотропность. Т. е. , на первый взгляд можно предположить, что жидкости ближе к газам, чем к кристаллам. Так же как и газы, жидкости изотропны, т. е. их свойства во всех направлениях одинаковы. Кристаллы, напротив, анизотропны: показатель преломления, сжимаемость, прочность и многие другие свойства кристаллов в разных направлениях оказываются различными. Твердые кристаллические вещества обладают упорядоченной структурой с повторяющимися элементами, что позволяет исследовать их методом дифракции рентгеновских лучей (метод рентгеноструктурного анализа, используется с 1912 г.) .
Что общего у жидкостей и газов?
А) Изотропность. Свойства жидкости, как и у газов, одинаковы во всех направлениях, т. е. изотропны, в отличие от кристаллов, которые анизотропны.
Б) Жидкости, подобно газам, не имеют определенной формы и принимают форму сосуда (низкая вязкость и высокая текучесть) . Уже из этого примера можно заключить, что ка
Согласно
классической механике газы и жидкости
характеризуются как сплошные среды, в
которых при равновесии касательные
напряжения не возникают, так как они не
обладают упругостью формы (кроме жидких
пленок и поверхностных слоев жидкости).
Касательные напряжения могут только
вызвать изменение формы элементарных
объемов тела, а не величины самих объемов.
Для таких деформаций в жидкостях и газах
усилий не требуется, так как в них, при
равновесии, касательные напряжения не
возникают.
Газы и жидкости
обладают только объемной упругостью.
В состоянии равновесия напряжения в
них всегда нормальны к площадке, на
которую они действуют, т. е.
![]() .
.
(7.13)
Соответственно
напряжение на площадках к координатным
осям
![]()
где
![]() –
–
координатные орты.
После
подстановки последнего выражения в
(7.10), получим
![]()
(7.14)
Скалярно
умножив правую, и левую части выражения
(7.14) на
![]() найдем, что
найдем, что
Р
= Рх
=
Ру
=
Рz.
(7.15)
Таким
образом, получили закон
Паскаля: в состоянии равновесия величина
нормального напряжения (давления) в
газах или жидкостях не зависит от
ориентации площадки, на которую оно
действует.
В случае газов
нормальное напряжение всегда направлено
внутрь газа, т. е. является давлением.
Как
исключение, в жидкостях могут реализоваться
натяжения
(отрицательное давление),
т. е. жидкость оказывает сопротивление
на разрыв.
Так
как обычные жидкости неоднородны, то в
них напряжения также имеют характер
давления. При переходе давления в
натяжение происходит нарушение
однородности сплошной среды. С этим
положением связано то обстоятельство,
что, газы обладают неограниченным
расширением, т. е. полностью занимают
весь объем сосуда, в котором они заключены,
а жидкости характеризуются собственным
объемом в сосуде.
Давление,
существующее в жидкости, вызвано ее
сжатием. Поэтому упругие свойства
жидкостей, по отношению к малым деформациям
(касательные напряжения не возникают),
характеризуются коэффициентом сжимаемости
![]() (7.16)
(7.16)
или модулем
всестороннего сжатия
![]() .
.
(7.17)
Формула
(7.16) справедлива и для газов. Температура
жидкости при сжатии остается постоянной.
Малую сжимаемость жидкости можно
проверить на ряде опытов. Например, при
выстреле из винтовки в сосуд с водой,
он разрывается на мельчайшие осколки.
Это происходит потому, что при попадании
пули в воду она должна либо сжать ее на
величину своего объема, либо вытеснить
наверх. Но для вытеснения недостаточно
времени. Поэтому происходит мгновенное
сжатие –
в жидкости возникает большое давление,
которое и разрывает стенки сосуда.
Аналогичные явления наблюдаются при
взрывах глубинных бомб. Вследствие
малой сжимаемости воды, в ней развиваются
громадные давления, приводящие к
разрушению подводных лодок.
Замечание:
согласно теории «Великого Объединения»
после горячего сингулярного состояния
(10–20 млрд. лет назад), в первые мгновения
возникновения Вселенной, за период
1034
–1032
с от начала расширения, решающую роль
сыграла гравитация вакуума.
Свойства
вакуума таковы, что вместе с плотностью
энергии должны появиться и натяжения
(как в упругом теле). Согласно теории,
при температуре 1027
К и выше, существовало скалярное поле,
которое обладало свойствами физического
вакуума У такого поля имелось огромное
отрицательное давление (натяжение),
равное плотности энергии всего поля.
Такое поле называют «ложным вакуумом»,
его плотность 1074
г/cм3
=
сonst.
В
момент времени менее 10–34
с плотность расширяющейся реальной
Вселенной была больше и гравитационные
свойства «ложного вакуума» не проявлялись.
При t
=1034c
эти плотности стали равными. В этот
момент и проявились свойства «ложного
вакуума», вызвавшие стремительное
расширение Вселенной при постоянной
плотности «ложного вакуума». За период
10–34–10–32
с размеры Вселенной увеличились в 1050
раз.
Но
состояние раздувающейся Вселенной
неустойчиво. Температура и плотность
обычной материи резко уменьшаются при
таком темпе расширения. В это время
происходит фазовый переход из состояния
«ложного вакуума» с огромной плотностью
в состояние, когда вся плотность массы
(и энергии) переходит в плотность массы
обычной материи. Это снова, привело к
разогреванию вещества Вселенной до
температуры 1027
К.
Такой процесс сопровождался флуктуациями
плотности первичного вещества Вселенной
в силу квантовой природы материи. В
веществе материи возникают звуковые
волны. После дальнейшей эволюции
вещества материи происходит возникновение
протогалактик и других космических
объектов. В настоящее время размер
наблюдаемой области Метагалактики
составляет
1010
световых лет, а полный размер ее
1033
световых лет.
II. ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
1. СРАВНЕНИЕ СВОЙСТВ ЖИДКОСТЕЙ СО СВОЙСТВАМИ ГАЗОВ И ТВЕРДЫХ ТЕЛ
Жидкости по своим свойствам занимают промежуточное положение между газами и твердыми телами. Вряд ли имеет смысл обсуждать вопрос о том, к чему ближе свойства жидкостей: к свойствам ли соответствующего пара или твердого тела. Ответ на этот вопрос будет зависеть от того, при какой температуре и давлении производят это сравнение.
Если производить сравнение при температуре, близкой к температуре кристаллизации вещества, то жидкость будет иметь больше сходства с твердым телом.
Действительно, при плавлении твердого тела объем изменяется незначительно. Для большинства веществ это изменение составляет около 10%. Следовательно, при плавлении не может произойти больших изменений в расположении молекул вещества, бывшего до того твердым телом. К этому необходимо добавить, что теплоемкость жидкости при температуре плавления близка к теплоемкости соответствующего твердого тела, что свидетельствует о сходстве в характере движения частиц вещества в этих двух состояниях. Поскольку расположение частиц материи и их движение при плавлении твердого тела изменяются незначительно, то очевидно, что в жидкостях при этих условиях должны сохраняться некоторые черты упорядоченного расположения частиц, характерные для твердого тела.
В настоящее время имеются экспериментальные доказательства наличия частичной упорядоченности в расположении молекул жидкости при температурах, близких к температуре кристаллизации.
Сближает жидкости с твердыми телами также их способность сопротивляться растяжению, если только предупредить образование пара. Для того чтобы разорвать жидкость без образования паровой фазы, подчас необходимы большие усилия. Жидкость может существовать в растянутом состоянии, о котором говорилось уже при обсуждении уравнения Ван-дер-Ваальса.
Следует, однако, отметить, что наряду с чертами сходства с твердыми телами жидкости обладают одновременно физическими свойствами, отличными от свойств твердых тел. Жидкости изотропны, т. е. их физические свойства не зависят от направления, в то время как свойства кристаллических твердых тел зависят от направления.
Кроме того, жидкости отличаются от твердых тел текучестью. Частицы, образующие жидкость, могут легко перемещаться одна относительно другой. Можно представить себе некую идеальную, крайне текучую жидкость, для которой модуль сдвига будет равен нулю, т. е. у которой перемещение частиц не будет требовать никакого усилия.
Как сказано выше, свойства жидкостей зависят от температуры, и отмеченные черты сходства жидкостей с твердыми телами с повышением температуры постепенно уступают место все более усиливающемуся сходству жидкости с соответствующим паром. Если изучать свойства жидкости, находящейся в равновесии с паром при температурах, близких к критическим, то придется отметить, что при этих условиях сходными оказываются уже плотности жидкости и пара, а не плотности жидкости и твердого тела. В данном случае на первый план выступают черты сходства жидкого и парообразного состояний вещества.
Исторически первоначально большее значение придавалось сходству между жидкостью и паром. Жидкость рассматривалась как сильно сжатый газ.
В последнее время иногда наблюдается обратная тенденция: подчеркивается преимущественно сходство жидкости с твердыми телами. Взятые в своих крайних формах, обе тенденции неверны. Жидкое состояние — это промежуточное состояние, в котором свойства вещества по мере возрастания температуры переходят от свойств твердого тела к свойствам соответствующего пара, что неразрывно связано с соответствующим изменением молекулярного строения.
Из сказанного выше становится ясной трудность исчерпывающего определения понятия жидкого состояния.
В дальнейшем изложении мы будем считать, что жидкость отличается от газов тем, что ей всегда можно предоставить объем, достаточно большой для того, чтобы она занимала бы его не полностью, в то время как газ или пар всегда занимают полностью предоставленный им объем.
Таким образом, жидкость, как и твердое тело, будет отличаться от пара или газа наличием свободной поверхности.
Примем дальше, что от твердого тела жидкость отличается подвижностью своих частиц относительно друг друга, т. е. способностью течь.
