Какое строение вещества сказывается на его свойствах

Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи — связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи — связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь — химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие — то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается.
Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь — химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие — наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная — между разными.
Электроотрицательность — мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются + и -, например: .
По характеру перекрывания электронных облаков («орбиталей») ковалентная связь делится на -связь и -связь.
-Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов), -связь — за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков — предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp-, sp2 и sp3-гибридизация. Например:
sp-гибридизация — в молекулах C2H2, BeH2, CO2 (линейное строение);
sp2-гибридизация — в молекулах C2H4, C6H6, BF3 (плоская треугольная форма);
sp3-гибридизация — в молекулах CCl4, SiH4, CH4 (тетраэдрическая форма); NH3 (пирамидальная форма); H2O (уголковая форма).
Металлическая связь — химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения — отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью — металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества — интерметаллические соединения (AlCr2, Ca2Cu, Cu5Zn8 и др.).
Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь — межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой — атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:
H—O—H ··· OH2, H—O—H ··· NH3, H—O—H ··· F—H, H—F ··· H—F.
Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
Мерой прочности любой связи является энергия связи.
Энергия связи — энергия необходимая для разрыва данной химической связи в 1 моле вещества. Единица измерений — 1 кДж/моль.
Энергии ионной и ковалентной связи — одного порядка, энергия водородной связи — на порядок меньше.
Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия.
Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических — немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение — слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников — кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы («кристаллические решетки») делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Основной структурной единицей веществ, имеющих молекулярное строение является молекула. Молекула состоит из ограниченного числа атомов, связанных друг с другом ковалентными химическими связями. Заряд молекулы также как и атома равен нулю.
Объединяясь в молекулу, атомы образуют определённую 2D или 3D-структуру (треугольник, квадрат, тетраэдр, октаэдр и т.д.).
Молекула – электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями и имеющая определённую пространственную структуру.
Отметим, что в некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь «молекулярное строение», например, все инертные газы. Для инертных газов понятия атом и молекула пересекаются.
Ковалентные связи между атомами образуются в результате обобществления атомами валентных электронов.
Валентные электроны — это электроны, принимающие участие в образовании химических связей.
Валентные электроны в атомах элементов главных подгрупп находятся на внешнем электронном слое. В атомах элементов побочных подгрупп часть валентных электронов находится на внешнем электронном слое, их там как правило 2, а иногда 1, с учётом эффекта провала электрона, а оставшаяся часть на d-подуровне предвнешнего электронного слоя.
При обобществлении валентных электронов атомами возникают общие электронные пары. Поэтому более точно, ковалентная связь — это связь, возникающая за счёт общих электронных пар.
Общие электронные пары могут возникать двумя способами: в результате обобществления неспаренных валентных электронов (обменный или коллигативный механизм) и в результате обобществления неподелённой электронной пары одного из атомов (донорно-акцепторный механизм). Более подробно речь об этих механизмах пойдёт в соответствующей главе.
Обобществление неспаренных электронов атомов водорода (обменный механизм образования ковалентной связи)
Валентный штрих Купера, показывающий общую электронную пару
Количество общих электронных пар, образуемых атомом принято называть его валентностью.
Валентность — это количество ковалентных связей атома с другими атомами.
Особо отметим, что если связи между атомами ковалентные, то это не свидетельство того, что вещество имеет молекулярное строение, т.е. состоит из молекул. Например, связи между атомами кремния и кислорода в SiO2 являются ковалентными, но SiO2 имеет атомное строение.
Чтобы однозначно определить имеет ли вещество молекулярное строение, необходимо знать его физические свойства: температуру кипения, температуру плавления и т.д. Вещества, имеющие молекулярное строение, как правило легкоплавки, имеют относительно низкую температуру кипения, так как связи между молекулами (межмолекулярное взаимодействие) достаточно слабые, имеющие низкие значения энергии.
Молекулы всегда имеют постоянный состав, поэтому и вещества молекулярного строения имеют постоянный состав, т.е. являются дальтонидами. Дальтониды подчиняются закону постоянства состава — закону Пруста (Ж. Л. Пруст, 1801—1808 гг.).
Для того, чтобы отразить состав молекулы применяют условную запись под названием химическая формула.
Химическая формула — условная запись, отражающая качественный и количественный состав веществ, имеющих молекулярное строение (условная запись состава молекулы).
Если вещество имеет немолекулярное строение (атомное или ионное), то его состав отражает формульная единица.
К примеру, если хлорид натрия находится при стандартных условиях, то он имеет ионное строение, а значит запись NaCl для кристаллического хлорида натрия не является химической формулой, а является записью формульной единицы.
При достаточно высоких температурах хлорид натрия можно перевести в газообразное агрегатное состояние, в этом случае резко повышается степень ковалентности связи. Это значит, что в газовой фазе существуют молекулы состава NaCl. На сей счёт имеются экспериментальные доказательства. Действительно, подобные молекулы в настоящее время удаётся получить, изолировав их друг от друга в твёрдом аргоне при температуре -2630 С. В приведённом примере запись NaCl является химической формулой, отражающей состав молекулы.
Во многих пособиях и учебниках до сих пор встречается определение молекулы, как наименьшей частицы вещества, обладающей его химическими свойствами.
Отметим, что данное определение является устаревшим и неправильным. Так молекулу определял Канницаро в 1860 году.
Ошибочность определения заключается в следующем.
Молекула не является наименьшей частицей вещества, так как существуют вещества атомного строения.
Молекула не является носителем химических свойств вещества, свойства обусловлены не единичной частицей, а их совокупностью, характером их взаимодействия.
Одна молекула тринитротолуола не обладает свойством взрывчатости, как даже две, три и большее их количество. Свойством взрывчатости будет обладать совокупность громадного числа молекул тринитротолуола — вещество.
Состав и строение молекулы определяют свойства вещества, но не молекула является носителем этих свойств.
Для наглядного изображения пространственного строения молекул применяют различные модели: шаростержневая модель, полусферическая модель Стюарта-Бриглеба, модель Драйдинга.
В татье рассмотрены вопросы: Что такое радиация, причины возникновения радиации. Распад радиоактивных веществ. Строение атома, что такое протоны, нейтроны, электроны, изотопы, нуклиды.
Строение вещества

Все что мы видим вокруг, что нас окружает, состоит из крошечных кирпичиков — молекул, которые в свою очередь состоят из атомов. Атомы состоят из еще более мелких частиц — нейтронов, протонов, электронов. Одна молекула может содержать несколько различных атомов, количество и вид которых определяет химические и физические свойства вещества. Например, одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
Структура любого атома похожа на миниатюрную модель солнечной системы, у которой в центре расположено ядро, состоящее из нейтронов и протонов, а вокруг ядра вращаются электроны. Каждый элемент атома имеет свой заряд: электрон — отрицательный; протон — положительный; нейтрон — нейтрален. В нормальном состоянии атом имеет нейтральный заряд, так как количество электронов и протонов всегда одинаковое.
От количества протонов в ядре атома зависит к какому химическому элементу относится сам атом. У одного и того же химического элемента в ядре атома может содержаться различное количество нейтронов. Например, атом водорода в своем ядре может содержать один или два протона, либо вообще не содержать протонов. При этом все три вида вещества будут относится к одному химическому элементу — водороду, но будут иметь разные физические свойства. Подобные элементы называются изотопами элемента. Группа изотопов одного элемента называется — нуклидами.

Значительная часть изотопов из-за своей сложной структуры и большого количества элементов в ядре атома, имеют не стабильную структуру и как следствие непродолжительное время существования. Если в ядре атома количество протонов и нейтронов сильно различается, то такой элемент является нестабильным. В результате одни элементы распадаются, образуя более простые элементы, а те в свою очередь так же могут распадаться на еще более простые и стабильные элементы. Данный процесс называется радиоактивным распадом вещества, а время, за которое часть вещества распадается, называется периодом полураспада вещества. Одни элементы могут оставаться стабильными миллиарды лет, другие могут существовать лишь тысячные доли секунды. Процесс распада в природе происходит по определённым цепочкам, от одного вещества к другому на протяжении всего существования материи.
Существует и обратный процесс, кода из более простых веществ, образуются более сложные вещества — данный процесс называется синтезом. Подобные процессы происходят в звездах и других небесных телах, в которых протекают активные термоядерные реакции. Например, в нашем солнце один из основных процессов, это слияние молекул водорода и образование из них молекул гелия.
Радиация

В процессе распада вещества или его синтеза происходит выброс элементов атома (протонов, нейтронов, электронов, фотонов), иначе можно сказать происходит излучение этих элементов. Подобное излучение называют — ионизирующее излучение или что чаще встречается радиоактивное излучение, или еще проще радиация. К ионизирующим излучениям относится так же рентгеновское и гамма излучение.
Радиоактивное излучение, сталкиваясь с материей, проникает в нее, начинает взаимодействовать с атомами и молекулами, вырывая электроны с внешних оболочек атомов, что приводит к изменению заряда атома.
Ионизация — это процесс образования положительно или отрицательно заряженных ионов или свободных электронов из нейтрально заряженных атомов или молекул.
Все элементарные частицы атома обладают огромной энергией и движутся с большими скоростями. В процессе радиоактивного (ионизирующего) излучения, излучаемые элементы сталкиваются с материей, встречающейся у нее на пути, и оказывают на нее мощное энергетическое воздействие. В этом и кроется основная опасность радиации как процесса или воздействия. Под воздействием радиации, как живая, так и не живая материя, может претерпевать значительные изменения, поглощая энергию излучения.
От того, какие элементы излучаются атомом вещества в виде радиации, зависит степень воздействия радиации на вещество.
Строение вещества
Мельчайшей частицей вещества, которая определяет все свойства данного вещества, является молекула. Молекула состоит из атомов. Число атомов и их распределение в молекуле является различным. В природе существует немногим более сотни атомов различного вида. Элементы обобщены и расположены в периодической таблице химических элементов, им даны наименования, например, водород, азот, углерод.
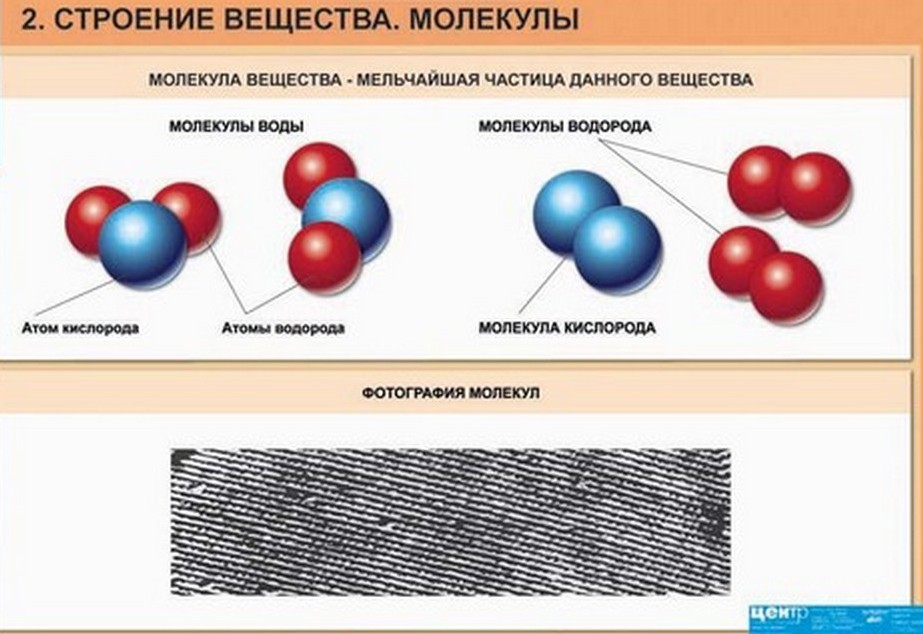
Движение частиц вещества называют тепловым движением.
Броуновское движение — беспорядочное движение микроскопических видимых, плавающих в жидкости или газе частиц твёрдого вещества, вызываемое тепловым движением частиц жидкости или газа.
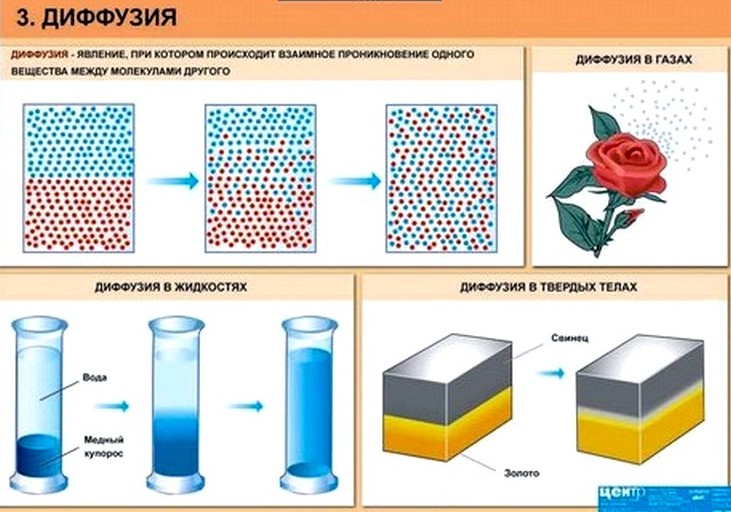
Взаимное проникновение частиц одного вещества в другое, обусловленное движением молекул, называют диффузией (от латинского «диффузио» — распространение, растекание).
Состояние вещества.
Вещества в природе встречаются в трёх состояниях:
- твёрдом
- жидком
- газообразном
 Твёрдые тела сохраняют объём и форму. Жидкости сохраняют объём, но легко меняют свою форму. Газы не имеют постоянного объёма и собственной формы. Редко встречающимся состоянием вещества является плазма, которая сходна с газом и излучает свет. Плазму часто называют четвёртым агрегатным состоянием вещества.
Твёрдые тела сохраняют объём и форму. Жидкости сохраняют объём, но легко меняют свою форму. Газы не имеют постоянного объёма и собственной формы. Редко встречающимся состоянием вещества является плазма, которая сходна с газом и излучает свет. Плазму часто называют четвёртым агрегатным состоянием вещества.
Молекулы одного и того же вещества в различных состояниях не отличаются друг от друга. Различные свойства вещества во всех состояниях определяются тем, что его молекулы расположены иначе и движутся по-разному.
Каждому твёрдому телу характерна твёрдость. Твёрдость — способность тела сопротивляться воздействию другого тела. Твёрдость вещества выясняют, царапая его каким-либо другим веществом.
Существуют различные шкалы твёрдости. Одна из них составлена в 1811 году немецким минералогом Фридрихом Моосом. Она состоит из 10 уровней, самым мягким веществом в ней является тальк, а самым твёрдым — алмаз. Алмаз в 58 раз твёрже стоящего на втором месте по твёрдости минерала корунда, из которого изготавливают рубины и сапфиры.
Свойством тел, изготовленных из твёрдого вещества, является их деформация. Деформация — изменение формы или размера тела под воздействием другого тела.
Эластичностью называют возможность тела после деформации возвращать себе первоначальную форму. Пластилин является пластичным, ему легко придать любую форму, которая сохраняется.
Прочность — способность вещества сопротивляться разрушению. У каждого материала имеется свой предел прочности. Стекло нельзя гнуть, т.к. оно хрупкое. Очень прочными являются металлы.
Кристаллы — это твёрдые тела, в которых атомы расположены закономерно, упорядоченно, образуя кристаллическую решётку. Это лёд, соль, металлы, минералы и т.д.
Аморфные тела — тела, не имеющие строгой кристаллической решётки, бесформенные тела. («аморфный» происходит от греч. «аморфос» — бесформенный)
В отличие от кристаллов, стабильно-аморфные вещества не затвердевают с образованием кристаллических граней.
Структуры жидкостей и аморфных тел имеют много общего. По этой причине принято считать аморфные тела очень густыми, вязкими, застывшими жидкостями. Аморфные вещества могут находиться либо в стеклообразном состоянии при низких температурах, либо в состоянии расплава при высоких температурах. Аморфные тела обладают текучестью, хотя и значительно меньшей, чем жидкости. При повышении температуры текучесть аморфных тел увеличивается. Благодаря этому из капли нагретого стекла можно выдуть стеклянный сосуд.
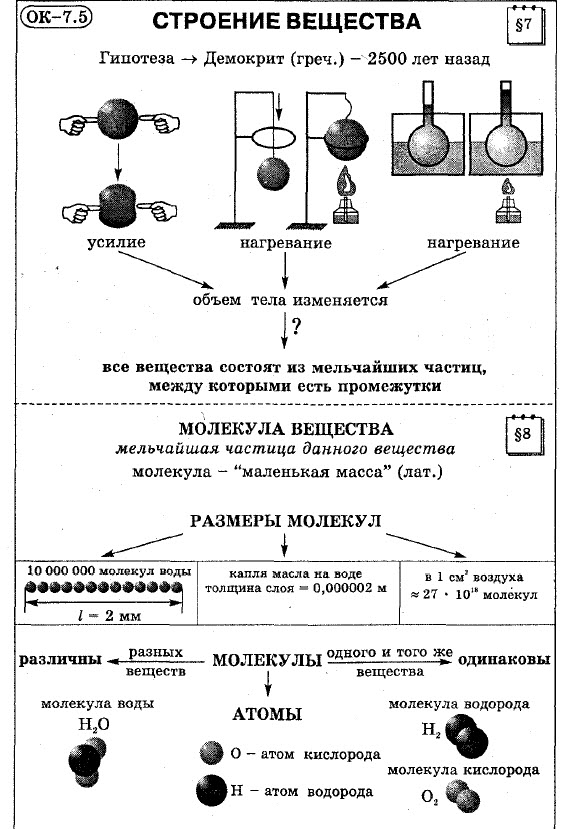
Это конспект по теме «Строение вещества». Ваши дальнейшие действия:
- Пройти тест по теме Строение вещества
- Перейти к следующему конспекту: Масса и плотность.
- Вернуться к списку конспектов по Физике.
