Какое соединение хлора проявляет только окислительные свойства
Основаны на процессе окисления анионов Cl-
2Cl— 2e- = Cl20
Электролиз водных растворов хлоридов, чаще — NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl— 2e- = Cl20
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

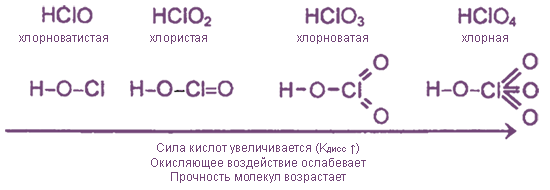
гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
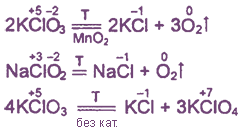
Хлорная известь
Хлорная (белильная) известь — смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
При температуре, соответ. твующей химическому равновесию данной реакционной смеси, окислительные свойства хлора будут равны окислительным свойствам кислорода. [c.82]
Что является более сильным окислителем — хлор или кислород — в системе, состоящей из газообразных Ог, С 2, НС и НгО Ответ дайте для комнатной температуры и 1000 К, а также вычислите температуру, при которой в данной системе окислительные свойства хлора и кислорода одинаковы. [c.66]
П р и мер 87. Что является более сильным окислителем хлор или кислород в смеси, состоящей из газообразных Oj, I2, H l л Н2О при стандартных условиях. Ответ дать для комнатной температуры и 1000°К, а также вычислить температуру, при которой в данной смеси окислительные свойства хлора и кислорода одинаковы. [c.80]
Чем объясняются окислительные свойства хлора и хлорной извести [c.254]
Окислительные свойства хлора [c.60]
Окислительные свойства хлора. Опыты проводить под тягой ) [c.302]
Сильные окислительные свойства хлор проявляет при взаимодействии с металлами. При этом атомы металла отдают электроны, а молекулы хлора их принимают. Например [c.168]
Хлор, обладающий токсическими и стерилизующими свойствами, применяется для обеззараживания технической и питьевой воды и сточных вод, для дезинфекции и т. п. На окислительных свойствах хлора основано его применение в текстильной и целлюлозно-бумажной про.мышленности в качестве отбеливающего средства. Широкое применение как активные окислители имеют хлорокислородные соединения — гипохлориты, хлораты, перхлораты, двуокись хлора, белильная известь. Соляная кислота (водный раствор хлористого водорода) является одной из наиболее распространенных минеральных кислот и находит разнообразное применение в различных отраслях народного хозяйства. Хлор используется также для получения трех- и пятихлористого фосфора, хлорокиси фосфора, хлористого алюминия, хлорного железа и др. [c.328]
ЛАБОРАТОРНЫЕ РАБОТЫ Работа №22, ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА ХЛОРА [c.187]
Написать уравнение реакции, учтя сильные окислительные свойства хлора. [c.169]
Сильные окислительные свойства- хлор проявляет при взаимодействии с металлами. При этом атомы металла отдают электроны, а мо- [c.201]
Окислительные свойства хлора и еще в большей мере его свойство отнимать связанный водород тканей ведут к нарушению их жизненных функций, что и лежит в основе действия хлора на организм человека. При взаимодействии хлора с водой получается соляная кислота, поэтому вдыхание хлора вызывает воспаление дыхательных путей и разъедание легочных тканей. Первая помощь при отравлении хлором свежий воздух и покой теплые щелочные полоскания, внутрь теплое молоко с содой или боржомом при кашле — дионин, кодеин, вдыхание паров смеси спирта с эфиром или паров нашатырного спирта. [c.201]
Окислительные свойства хлора и еще в большей мере его свойство отнимать связанный водород тканей ведут к нарушению их жизненных функций, что и лежит в основе действия хлора на организм человека. При взаимодействии хлора с водой получается соляная кислота, поэтому вдыхание хлора вызывает воспаление дыхательных путей и разъедание легочных тканей. [c.243]
Нужно использовать окислительные свойства хлора, которыми не обладает СО2. Например пропустив газы через раствор иодида калия. [c.248]
Окислительные свойства хлора, брома и иода [c.140]
Окислительные свойства хлора. (Опыты проводить под тягой ), а) В один из цилиндров опустить полоску медной фольги, предварительно слегка нагретой над пламенем горелки (при отсутствии фольги можно воспользоваться многожильным электрическим проводом, расщепленным на отдельные проволочки). Что происходит [c.274]
Окислительные свойства хлор- [c.302]
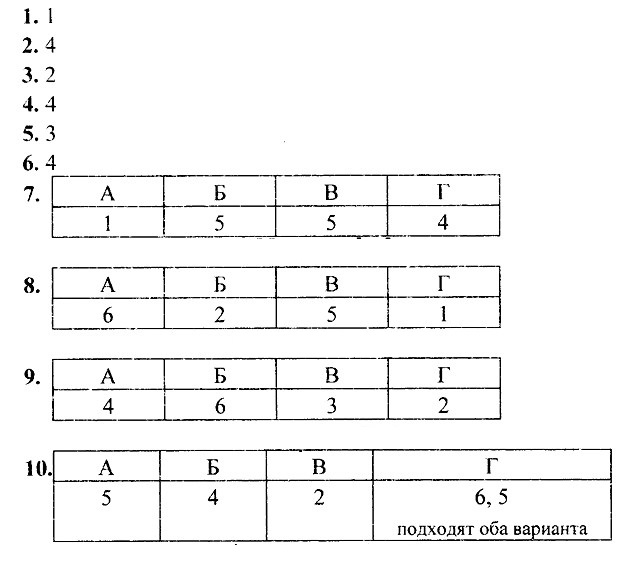
НС1-С1а—НСЮ-НСЮа—НСЮз—НСЮ (2> увеличение окислительных свойств хлора [c.410]
Сильные окислительные свойства хлор проявляет при взаимодейст вии с металлами. При )том атомы меп-атла отдают электроны, а молекулы хлора их принимают. Папример [c.202]
Кислородные соединения галогенов получаются лишь косвенным путем. Это сравнительно малоустойчивые вещества, обладающие окислительными свойствами. Хлор и иод в них проявляют степень окисления от +1 до +7, а бром — от + 1 до +5. При взаимодействии галогенов с водой устанавливается равновесие Hal24-HOH HHalO-l-HHal. В случае иода равновесие сильно сдвинуто влево. Раствор хлора в воде (хлорная вода) содержит наряду с молекулами хлора две кислоты, образующиеся в результате реакции диспропорцио-нирования [c.144]
Карл Грин нашёл, что ослабление окислительных свойств хлора при псиользованпи хлораминов приводит к тому, что запахи, обусловленные образованием хлорфзнолов и других органических содержащих хлор соединений, большей частью не устраняются вследствие того, что хлораминами эти вещества не разрушаются. [c.75]
Окислительные свойства хлора. В один из цилиндров опустить полоску медной фольги, предварительно слегка нагретой над пламенем горелки (при отсутствии фольги можно восполь-зсваться многожильным электрическим проводом, расщепленным на отдельные проволочки). Что происходит Стеклянной лопаточкой взять немного порошкообразной сурьмы (свежерастертой) и стряхнуть ее в другой цилиндр с хлором. Что происходит В третий цилиндр опустить железную ложечку с положенным в нее кусочком металлического натрия. Что происходит Составить уравнения реакций. [c.257]
Смотреть страницы где упоминается термин Окислительные свойства хлора:
[c.52]
[c.410]
[c.94]
Второй типческий элемент VII группы – хлор характеризуется меньшей неметаллической активностью по сравнению с фтором. Обусловлено это малым потенциалом ионизации (в атоме хлора валентные электроны находятся дальше от ядра, чем в атоме фтора, что и приводит к снижению потенциала ионизации, хотя он остается еще настолько велик, что катиона Cl+ не существует) и малой относительной электроотрицательностью, а также увеличением радиуса атома и энтальпии диссоциации молекулы на атомы.
Межэлектронное отталкивание валентных электронов в атоме хлора заметно меньше, чем в атоме фтора, и лишний электрон не так сильно дестабилизирует систему, поэтому из всех атомов галогенов атом хлора обладает максимальным сродством к электрону.
Большая прочность молекул хлора по сравнению с молекулами фтора объясняется не только эффектом обратного экранирования в атоме фтора, приводящим к ослаблению связи в его молекулах. В молекулах хлора имеет место дополнительное π-связывание за счет p-электронов и d-атомной орбитали. π-связывание возникает по донорно-акцепторному механизму, когда каждый атом хлора одновременно является и донором и акцептором электронной пары (дативная связь). В рамках МВС дополнительное π-связывание можно представить схемой:

Здесь знаком σ показано возникновение основной σ-связи по обменному механизму, а стрелками – дополнительное π-связывание (неподеленная p-электронная пара одного атома хлора взаимодействует с d-АО другого). При этом происходит лишь частичный перенос электронной плотности на d-АО атома партнера и поэтому порядок связи менее 1,5.
Наличие 3d-АО атома хлора резко повышает валентные возможности и вариации его положительных степеней окисления. Теоретически максимальная ковалентность хлора может достигать 9 (9 АО при n=3). Однако практически наблюдаемая координационная валентность хлора не превышает 6. При взаимодействии атомов хлора между собой и с другими элементами хлор проявляет степени окисления -1, 0, +1, +3, +4, +5, +6, +7. Разнообразие валентных состояний и степеней окисления делают химию хлора во многих отношениях отличной от химии фтора. В то же время оба элемента – типичные неметаллы с ярко выраженными окислительными свойствами. Поэтому главное в химии этих элементов – функционирование в качестве анионообразователей в бинарных и более сложных соединениях.
В большинстве соединений хлор как сильно электроотрицательный элемент (ОЭО=3,0) выступает в отрицательной степени окисления -1. В соединениях же с более электроотрицательными фтором, кислородом и азотом он проявляет положительные степени окисления. Особенно разнообразны соединения хлора с кислородом, в которых хлор проявляет степени окисления +1, +3, +5, +7, а также +4 и +6.
Хлор – активный окислитель:
1/2Cl2(г) + → Cl—(г), ΔG°298 = -240 кДж
1/2Cl2(г) + → Cl—(р), ΔG°298 = -131 кДж
Он весьма энергично реагирует с металлами и большинством неметаллов (за исключением кислорода, азота, благородных газов, углерода), легко окисляет многие сложные соединения.
Так, расплавленный натрий сгорает в атмосфере хлора с ослепительной вспышкой. Подобным образом ведут себя многие металлы и неметаллы: медь, олово, порошок сурьмы, кристаллический фосфор, натрий…
2Na + Cl2 = 2NaCl, ΔH° = -822 кДж
2P + 3Cl2 = 2PCl3, ΔH° = -624 кДж
PCl3 + Cl2 = PCl5 (при нагревании)
I2 + 3Cl2 = 2ICl3, ΔH° = -176 кДж
Фосфор, мышьяк, сурьма, кремний, натрий, калий и магний уже при низкой температуре реагируют с хлором с выделением большого количества теплоты.
Sb + 3/2Cl2 = SbCl3, ΔH° = -381,2 кДж
Mg + Cl2 = MgCl2, ΔH° = -644,8 кДж
S + Cl2 = SCl2
S + 2Cl2 = SCl4 (при нагревании)
Однако реакция с водородом при стандартных условиях заморожена. При повышенной температуре, сильном освещении (УФ) или электрическом разряде хлор взаимодействует с водородом со взрывом
H2 + Cl2 + hν = 2HCl, ΔH° = -184 кДж
Эта реакция протекает по цепному механизму:
Cl2 + hν → 2Cl·
H2 + Cl· → HCl + H·
H· + Cl2 → HCl + Cl·
Cl· + Cl· → Cl2
H· + H· → H2
H· + Cl· → HCl
Аналогично протекают реакции хлора с различными углеводородами.
Хлор взаимодействует с другими галогенами:
F2 + Cl2 = 2ClF
3F2 + Cl2 = 2ClF3
Br2 + Cl2 = 2BrCl
Br2 + 5Cl2 + 6H2O = 2HbrO3 + 10HCl
I2 + Cl2 = 2ICl
I2 + 3Cl2 = 2ICl3
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
При этом в реакции со фтором хлор выступает в качестве восстановителя, а в остальных случаях в качестве окислителя.
Хлор способен окислять и сложные вещества:
2FeCl2·aq + Cl2(г) = 2FeCl3·aq
2NH3 + 3Cl2 = N2 + 6HCl
H2S + Cl2 = 2HCl + S
Na2S2O3 + Cl2 + NaOH = NaCl + Na2SO4
SO2 + Cl2 = SO2Cl2
SO32- + Cl2 + H2O = SO42- + 2HCl
Вода катализирует многие реакции с участием хлора. Например, хорошо осушенный хлор при стандартных условиях практически не реагирует со многими металлами, в частности с железом. Это позволяет хранить хлор в стальных баллонах.
Наиболее эффективным окислителем хлора в водной среде является сам хлор, вступающий при растворении в воде в реакцию диспропорционирования, для протекания которой наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов:
Cl2 + H2O ↔ HCl + HClO (1)
3Cl2 + 6OH— ↔ 5Cl— + ClO3— + 3H2O (2), Kp = 7,5·1015
Cl2 + 2OH— ↔ Cl— + ClO— + H2O (3)
Равновесие реакции (1) сдвинуто влево (Kp = 4,2·10-4) поэтому молярная концентрация хлорноватистой кислоты при 20 °C достигает лишь 0,03 моль/л.
Растворение хлора в водном растворе щелочи (реакции 2 и 3) практически нацело смещает равновесие вправо. Состав образующихся при этом солей зависит от температуры.
Образующийся на первой стадии гипохлорит анион склонен к диспропорционированию:
3ClO— ↔ ClO3— + 2Cl— (a)
4ClO— ↔ ClO4— + 3Cl— (b)
2ClO— ↔ ClO2— + Cl— (c)
Как показывает опыт, при комнатной и более низкой температуре скорость всех реакций диспропорционирования аниона ClO— низка. Поэтому реакция хлора с холодным (лучше охлаждаемым льдом) раствором гидроксида натрия или калия позволяет получить смесь хлорида натрия и гипохлорита натрия, хлорида калия и гипохлорита калия соответственно, называемых жавелевой водой, из которой можно выделить кристаллогидраты солей NaClO или KClO. Аналогичная реакция хлора с гидроксидом кальция дает смешанную соль CaCl(ClO) или CaCl2·Ca(ClO)2 и CaCl2·Ca(OH)2, называемой хлорной известью.
При нагревании до 70-80 °C, а тем более до кипения, реакция (a) протекает быстро, причем с большой скоростью, чем реакция (c), в то время как скорость реакции (b) остается очень низкой. Следовательно, реакция хлора с горячим раствором щелочи позволяет получать соли иона ClO3— (например, KClO3 – бертолетова соль).
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества.
Окислитель — вещество (элемент в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель — вещество (элемент в составе этого вещества), отдающее электроны. Само оно при этом окисляется.
Примеры тестовых заданий и рекомендации к их выполнению
1. Веществом, которое за счёт аниона проявляет только восстановительные свойства, является
1)H2SO4 2) SO2 3) Na2SO3 4) H2S
Восстановителем является та частица, в которой элемент имеет наименьшее значение степени окисления. Так как все анионы веществ, данных в вариантах ответов, образованы серой, то наименьшее значение степени окисления равно -2 (сера — элемент VI группы, и её атому недостаёт до завершения внешнего слоя именно двух электронов). Это значение степени окисления имеет сера в сероводороде. Ответ: 4.
2. Хлор проявляет только восстановительные свойства в соединении, формула которого
1)КСlO 2) КСlO4 3)Сl2O7 4) НСl
Данное задание выполняется по аналогии с предыдущим. Ответ: 4.
3. Процессу восстановления соответствует схема

Достаточно сложное задание, однако эту сложность легко преодолеть, используя логику. Так как процесс восстановления — это понижение степени окисления, то сразу следует исключить ответ 3 и обратить внимание на ответ 4, поскольку сера изменила степень окисления. Определив значение этого изменения с 0 до -2, можно сделать вывод, что именно ответ 4 является верным. В этом случае не нужно будет испытывать затруднений и тратить время для определения степеней окисления в катионе аммония и в сульфит-анионе. Ответ: 4.
4. Элемент бром является восстановителем в реакции, уравнение которой
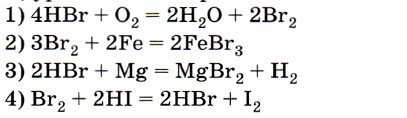
Ответы 2 и 3 из претендентов на верный ответ следует сразу исключить, так как металлы (простые вещества) проявляют только восстановительные свойства. Анализ изменения степени окисления брома для первого уравнения (от -1 до 0) позволяет сделать вывод, что этот ответ является верным. Ответ: 1.
5. Азот в аммиаке проявляет восстановительные свойства в реакции, уравнение которой
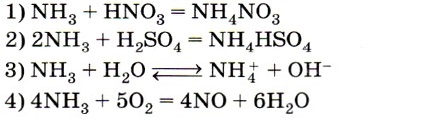
Следует знать, что в аммиаке и ионе аммония азот имеет одинаковую степень окисления -3, поэтому из числа возможных верных ответов исключаются ответы 1,2 и 3. В ответе 4 азот повышает свою степень окисления с -3 в аммиаке до +2 в оксиде азота (II). Ответ: 4.
6. Схеме превращения  соответствует схема
соответствует схема
реакции
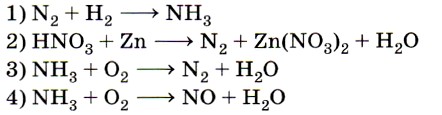
Отправной точкой для нахождения верного ответа служит  в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
7. Изменению степени окисления
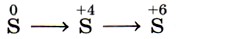
соответствует схема превращений

Так как во всех четырёх вариантах первое звено представлено простым веществом — серой, все они соответствуют первому звену искомой схемы. Следовательно, анализируются вторые звенья на предмет нахождения соединений серы в степени окисления +4. Это варианты 1 и 4. Третье звено (сера в степени окисления +6) содержится в варианте 4. Это и есть верный ответ. Ответ: 4.
Возможный равноценный вариант поиска верного ответа мог быть основан на определении последних звеньев, в которых записаны соединения серы в степени окисления +6. Это варианты ответов 2 и 4. Анализ вторых звеньев данных вариантов на предмет нахождения соединений серы в степени окисления +4 также позволяет определить верный ответ. Ответ: 4.
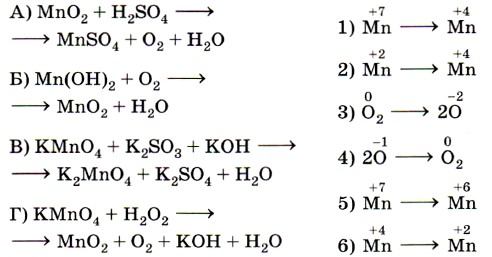
8. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
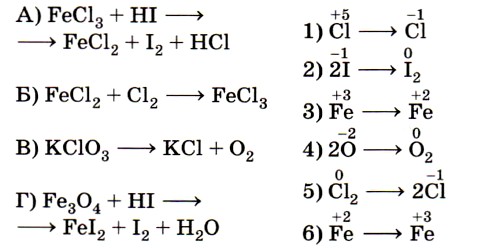
Ключевыми словами для выполнения этого задания являются «изменение степени окисления окислителя», т. е. элемента, понижающего значение степени окисления. Это позволит исключить из правого столбика процессы с участием восстановителей (отдачи электронов) — 2, 4 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степени окисления окислителей. Схеме А, в которой степень окисления железа +3, соответствует процесс 3; схеме Б, в которой хлор имеет степень окисления 0, соответствует процесс 5; схеме В, в которой хлор имеет степень окисления +5, соответствует процесс 1.
Некоторые сложности вызовет схема Г, так как железо в железной окалине (Fe3O4) имеет два значения степени окисления: +2 и +3 (FeO • Fe2O3) и именно железо в степени окисления +3 является окислителем (соответствие Г — 3). Ответ: 3513.
9. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Ключевыми словами для выполнения этого задания являются «изменение степени окисления восстановителя», т. е. элемента, отдающего электроны и соответственно повышающего свою степень окисления. Это позволит исключить из правого столбика процессы с участием окислителей (принятия электронов)— 1, 5 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степеней окисления восстановителей. Схеме А, в которой степень окисления иода 0, соответствует процесс 2; схеме Б, в которой азот катиона аммония имеет степень окисления -3, соответствует процесс 3.
Некоторые сложности вызовут схемы В и Г, так как это реакции диспропорционирования, в которых один и тот же элемент выступает как в роли окислителя, так и в роли восстановителя. Однако выполнение этого задания ограничено рамками его условия. Для схемы В из двух вариантов происходящих изменений степени окисления иода выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие В— 2). Аналогично для схемы Г из двух вариантов происходящих изменений степени окисления азота выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие Г —4). Ответ: 2324.
10. Установите соответствие между схемой превращения элемента (левый столбец) и уравнением ОВР (правый столбец).
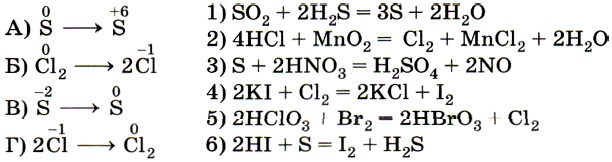
Превращению А в качестве продуктов реакции соответствуют соединения серы в форме сульфат-иона 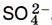 . Следовательно, этому превращению соответствует уравнение 3.
. Следовательно, этому превращению соответствует уравнение 3.
Превращению Б в качестве продуктов реакции соответствуют соединения хлора в форме хлорид-иона — Сl-. Следовательно, этому превращению соответствует уравнение 4.
Легко установить соответствие В — 1, так как свободная сера указана только в одном из приведённых уравнений.
Аналогично устанавливается соответствие Г — 2, так как хлор в степени окисления -1 указан в левой части только одного из приведённых уравнений. Ответ: 3412.

1. Не является окислительно-восстановительной реакция, схема которой
2. Только восстановительные свойства проявляет вещество, формула которого
1)SO2 2) НСl 3)Н2 4) Na2S
3. Только окислительные свойства проявляет вещество, формула которого
1)I2 2) F2 3)Н2 4)N2
4. Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
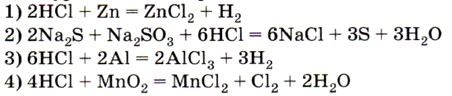
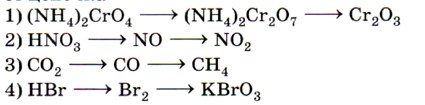
5. Процессу последовательного восстановления соответствует цепочка
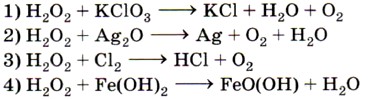
6. Пероксид водорода проявляет окислительные свойства в реакции, схема которой
7. Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нём (правый столбец).
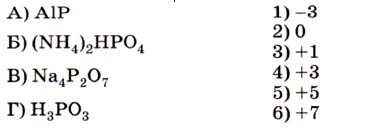
8. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
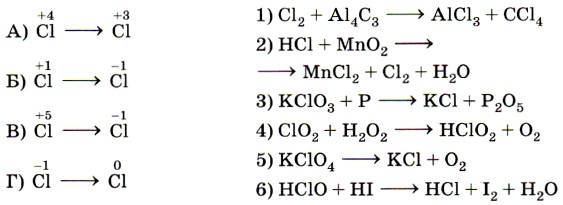
9. Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).
10. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).
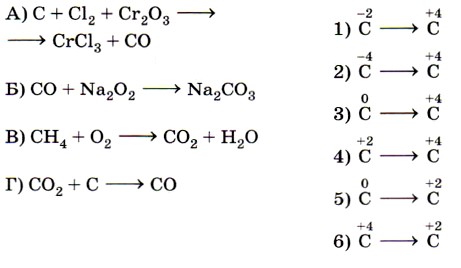
Окислительно-восстановительные реакции. Ответы

