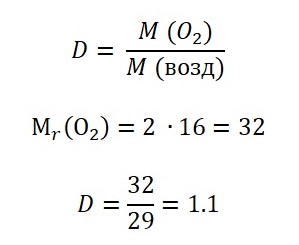Какое количество вещества атомов водорода содержится в сероводороде
Все вещества состоят из атомов. Атом – это мельчайшая, химически неделимая частица вещества. Все типы химических элементов объединены в Периодической системе химических элементов. Атомы одного типа называются химическими элементами. Количество атомов может меняться. Количество атомов одного типа обозначается коэффициентом.
Например, запись 6K означает 6 атомов калия. Запись 7P – это 7 атомов фосфора.
Атомы образуют молекулы. Здесь полезно упомянуть закон постоянства состава: любое определенное химически чистое соединение, состоит из одних и тех же химических элементов, причём отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава). Однако условно состав многих бертоллидов записывают, как постоянный.
Например, молекула серной кислоты выглядит так: H2SO4. Она состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Количество молекул также обозначается коэффициентом перед формулой молекулы.
Количество любых частиц обозначается, как N.
Например, 7 молекул воды записывается так: 7H2O.
6 молекул углекислого газа: 6CO2. При этом в 6 молекулах углекислого газа содержится 6 атомов углерода C и 12 атомов кислорода O.
Задача. Определите, сколько атомов водорода содержится в 15 молекулах фосфорной кислоты.
N(H3PO4) = 15
В каждой молекуле фосфорной кислоты содержится по 3 атома водорода. Следовательно, атомов водорода в 3 раза больше, чем молекул фосфорной кислоты:
N(H) = 45.
Ответ: в 15 молекулах фосфорной кислоты содержится 45 атомов водорода.
Задача. Определите, какое число молекул сероводорода H2S содержит 300 атомов водорода H.
В каждой молекуле сероводорода содержится по 2 атома водорода. Следовательно, число атомов водорода в 2 раза меньше, чем число молекул сероводорода:
N(H2S) = 1/2*N(H) = 1/2*300 = 150.
Ответ: 300 атомов водорода содержится в 150 молекулах сероводорода.
Задача 1. Определите количество атомов водорода в 12 молекулах аммиака NH3?
Задача 2. Определите количество атомов кислорода, если число молекул хлорангидрида серной кислоты SO2Cl2 равно 6000?
Задача 3. Определите число атомов кислорода в порции, содержащей 6 миллионов частиц медного купороса CuSO4•5H2O.
Задача 4. Определите число молекул в порции метана CH4, если известно, в этой порции содержится 3•106 атомов водорода.
Задача 5. В некоторой порции карбида алюминия Al4C3 содержится 300000 атомов алюминия. Определите число молекул.
Задача 6. Известно, что в некоторой порции серной кислоты H2SO4 всего содержится 350 атомов. Определите число молекул серной кислоты в этой порции.
Задача 7. В некоторой порции содержится смесь углекислого газа СO2 и оксида фосфора (V) P2O5 в соотношении 1:2. Известно, что число молекул углекислого газа в этой смеси равно 42. Определите число атомов кислорода в этой порции.
Задача 8. Известно, что в порции содержится 300 молекул угарного газа CO и 400 молекул сернистого газа SO2. Определите, какое число атомов кислорода содержится в этой порции.
Задача 9. Известно, что в водном растворе фосфорной кислоты на каждую молекулу фосфорной кислоты H3PO4 приходится 20 молекул воды H2O. Общее количество атомов водорода в этом растворе равно 8600. Определите количество атомов кислорода в этом растворе.
Задача 10. Известно, что порции медного купороса CuSO4•5H2O содержится 2700 атомов кислорода. Определите количество атомов водорода в этой порции.
1. В каком случае применяют физическую величину «количество вещества» и в каких единицах ее измеряют? Ответ поясните примерами.
Количество вещества применяют в случаях, когда интересует отношение количества частиц, вступающих и/или образующихся в процессе химической реакции.
При горении водорода 2 молекулы водорода соединяются с 1 молекулой кислорода и образуют 2 молекулы воды:
2H2 + O2 = 2H2O
При горении метана 1 молекула метана вступает в химическое взаимодействие с 2 молекулами кислорода и образованием 2 молекул воды и 1 молекулы углекислого газа:
CH4 + 2O2 = CO2 + 2H2O
2. Что означает величина «молярная масса» и чем она отличается от физических величин «относительная молекулярная масса» и «относительная атомная масса»?
Молярная масса — масса одного моля вещества. А один моль это количество вещества, содержащее столько же частиц, сколько их содержится в 12 г углерода, масса которого равна 12 а. е. м.
Или, другими словами: молярная масса — это масса вещества, содержащего столько же частиц, сколько их содержится в 12 г углерода, масса которого равна 12 а. е. м.
Количество частиц, содержащихся в 1 моле вещества это постоянная величина, называемая числом или постоянной Авогадро, и равная 6,02 * 1023.
Поэтому можно сказать, что молярная масса — это масса 6,02 * 1023 частиц (атомов, молекул, ионов) данного вещества.
Относительная атомная (молекулярная) масса — значение массы атома (молекулы), выраженное в атомных единицах массы. Определяется как отношение массы атома данного элемента к 1/12 массы нейтрального атома изотопа углерода 12C.
§ 11 Относительная атомная масса химических элементов
3. Рассчитайте молярные массы воды H2O, углекислого газа CO2, серной кислоты H2SO4, сероводорода H2S.
Молярная масса численно совпадает с относительной молекулярной массой вещества:
M (H2O) = 2*1 + 16 = 18 г/моль
M (CO2) = 12 + 2*16 = 44 г/моль
M (H2SO4) = 2*1 + 32 + 4*16 = 98 г/моль
M (H2S) = 2*1 + 32 = 34 г/моль
4. Дано уравнение реакции 2Mg + O2 = 2MgO. Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом атомов и количеством вещества.
| Масса (m) | Число атомов | Количество вещества (n) | |||
|---|---|---|---|---|---|
| Mg | O | Mg | O | Mg | O |
| 48 г | 32 г | 12,04 * 1023 | 6,02 * 1023 | 2 моль | 1 моль |
| 24 г | 16 г | 6,02 * 1023 | 3,01 * 1023 | 1 моль | 0,5 моль |
| 12 г | 8 г | 3,01 * 1023 | 1,505 * 1023 | 0,5 моль | 0,25 моль |
5. Составьте 2-3 уравнения известных вам химических реакций и поясните, в каких массовых и количественных соотношениях реагируют вещества.
Ca + 2H2O = Ca(OH)2 + H2
Количественное соотношение кальция и воды 1 к 2.
Чтобы найти массовое соотношение, нудно найти молярную массу вещества, а затем выразить ее через количественное соотношение:
M (Ca) = 40 г/моль
M (H2O) = 18 г/моль
Так как 1 атом кальция вступает во взаимодействие сразу с 2-мя молекулами воды, то соотношение масс будет:
m (Ca) : m (H2O) = 40 : 2*18 = 40 : 36
Для реакции
2Na + 2H2O = 2NaOH + H2
Количественное отношение 1:1, массовое отношение 23:18.
Для реакции
Fe + S = FeS
Количественное отношение 1:1, массовое отношение 56:32.
Тестовые задания
1. Медь, взятая количеством вещества 6 моль, имеет массу
1) 60 г 2) 192 г 3) 384 г 4) 400 г
Ar (Cu) = 64 а. е. м.
Поэтому
m (Cu) = 6 * Ar (Cu) = 6 * 64 = 384 г
Ответ: 3.
2. Масса 0,1 моль алюминия равна
1) 0,1 г 2) 2,7 г 3) 260 г 4) 540 г
Ответ: 2.
3. Количество вещества, соответствующее 32 кг оксида железа (III), — это
1) 10 моль 2) 20 моль 3) 100 моль 4) 200 моль
n = m / Mr = 32 000 / 160 = 200 моль
Ответ: 4
3. Количество вещества, соответствующее 560 г карбоната кальция CaCO3, — это
1) 0,56 моль 2) 5,6 моль 3) 6,5 моль 4) 10 моль
n = m / Mr = 560 / 100 = 5,6 моль
Ответ: 2.
найдем количество водорода 1. = m/M =20г :2 г/моль = 10 моль.
число Авогадро = 6.0221415 × 10^23отсюда
2. число молекул =10 *6.0221415 × 10^23=
3. полученное число умножим на количество атомов в молекуле водорода т. е . на 2
=(10 *6.0221415 × 10^23)* 2= считай
и
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные) , таблицу Менделеева, манометр, термометр.
Инструкция
1
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
2
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
3
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
4
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С) , определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту) , выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром) , то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Решение задач на количественные характеристики вещества:
количества вещества, массу и объем
Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:
 в которых
в которых
Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
NA = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
№ 1.
Определите абсолютную массу (в г) одной молекулы воды.
 Ответ: m (молекулы Н2O) = 2,99 • 10–23 г.
Ответ: m (молекулы Н2O) = 2,99 • 10–23 г.
№ 2.
Определите массу порции оксида серы (VI), содержащей 7,224 • 1023 атомов кислорода.

Ответ: m(SO3) = 32 г.
№ 3.
Сколько атомов азота содержится в оксиде азота (I), объем которого (н. у.) равен 20,16 л?
 Ответ. N(N) = 10,836 • 1023.
Ответ. N(N) = 10,836 • 1023.
№ 4.
Определите объем (н. у.) оксида углерода (IV), в котором содержится столько же атомов кислорода, сколько их содержится в 48 г карбоната кальция.

Ответ. V(СO2) = 16,12 л.
№ 5.
Определите относительную плотность сероводорода по водороду и по воздуху.

Ответ: DH2(H2S) = 17; Dвозд(H2S) = 1,17.
№ 6.
Плотность газа по кислороду равна 0,875. Определите число молекул, содержащихся в 15,4 г этого газа.

Ответ. N(газа) = 3,311 • 1023.
ЗАДАЧИ с КРАТКИМ ОТВЕТОМ
№ 7. Сплав содержит 16 г меди и 11,2 г железа. Атомов какого метала будет больше в данном образце сплава?
№ 8. Смешали 16,8 г азота и 15,68 л (н. у.) водорода. Какое суммарное число молекул обоих газов будет содержаться в данной смеси?
№ 9. Чему равна масса порции хлорида бария, содержащая 1,3244 • 1024 ионов хлора?
№ 10. Какую массу должен иметь образец нитрата калия, чтобы в нем было столько же атомов кислорода, сколько их содержится в образце сульфата натрия массой 21,3 г?
№ 11. Сколько атомов хлора содержится в смеси, состоящей из 16,68 г хлорида фосфора (V) и 16,5 г хлорида фосфора (III)?
№ 12. Вычислите массу смеси, содержащей 672 мл (н. у.) оксида азота (I), 0,125 моль оксида азота (II) и 1,15 г оксида азота (IV). Сколько атомов азота будет содержаться в этой смеси?
№ 13. Молекула некоторого газа имеет массу 6,063* 10–23г. Определите плотность данного газа по гелию.
№ 14. Вычислите плотность газа по азоту, если 1 л (н. у.) этого газа имеет массу 1,7857 г.
№ 15. Плотность газа по воздуху равна 2,207. Найдите плотность этого газа по хлору и массу одной молекулы этого газа (в г).
№ 16. Масса порции оксида алюминия равна массе порции оксида кремния (IV). В какой порции будет содержаться больше атомов кислорода?
№ 17. Порции метана СН4 и аммиака NH3 содержат одинаковое число атомов водорода. Какая порция будет иметь большую массу?
№ 18. Десять молекул газа имеют массу 6,063 * 10–22г. Определите плотность данного газа по водороду.
№ 19. Определите массу и объем (н. у.) аммиака, содержащего столько же атомов водорода, сколько их содержится в 2,55 г сероводорода.
Решение задач на основные количественные характеристики вещества. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач с долей вещества в смеси, в соединении.
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
План урока:
Химическая формула
Массовая характеристика вещества
Количество вещества
Закон Авогадро и следствия с закона
Химическая формула
Химия — уникальная наука, которая обладает своим языком и «алфавитом». Каждый химический элемент имеет своё название и собственный «адрес» в периодической системе.
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
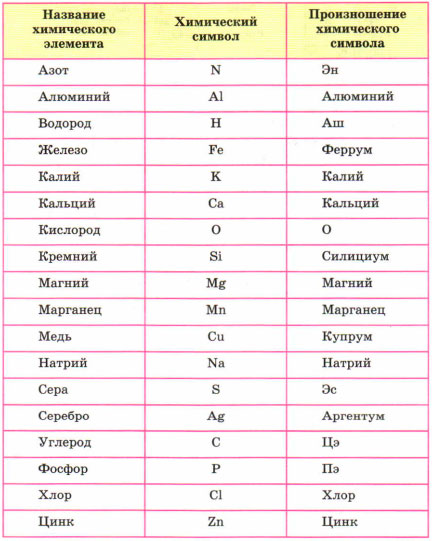
(Источник)
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
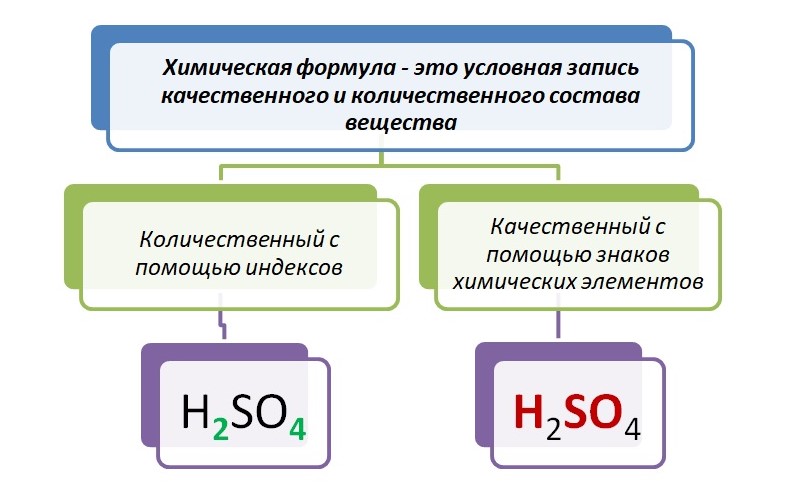
H2SO4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H2SO4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
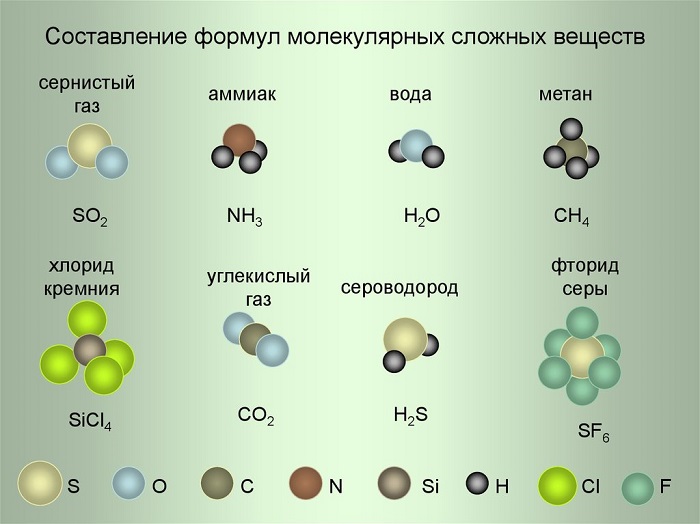 (Источник)
(Источник)
- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Представим перед собой два кубика одинакового объёма 1 см3, только один сделан из свинца, а второй – из алюминия. ρ(Al) = 2.7 г/см3, ρ(Pb) = 11,3 г/см3. Свинцовый кубик будет 4,2 раза тяжелее алюминиевого. С чем это связано?
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10−10м и масса m = 19.94∙10−27кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Как показывают числовые данные — масса и радиус очень малы, их достаточно трудно увидеть даже в современные оптические микроскопы. Именно по этой причине стали сравнивать атомные массы. На данный момент стандартом сравнения является химический элемент Углерод, а точнее 1/12 часть его массы.
Важно запомнить
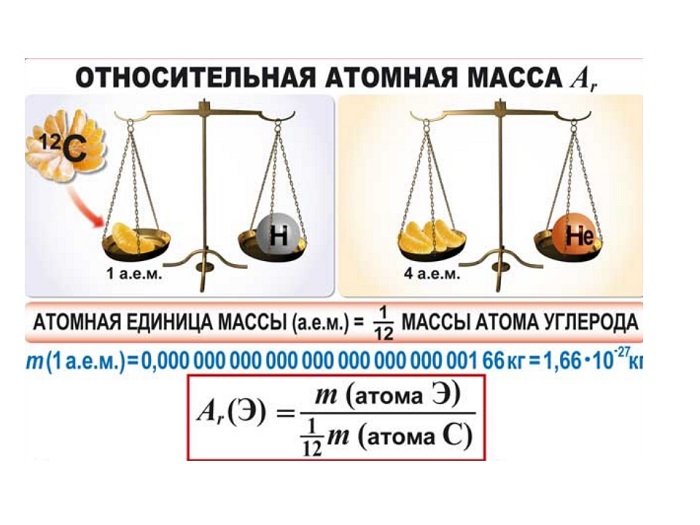 (Источник)
(Источник)
Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Чему равно Ar элемента подскажет периодическая система. Достаточно часто порядковый номер принимают за Ar. Чтобы избежать путаницы, запомним, что порядковый номер — целое число, а Ar записывается десятичной дробью, которую в химических расчётах общепринято округлять до целых (исключение составляет только Хлор).
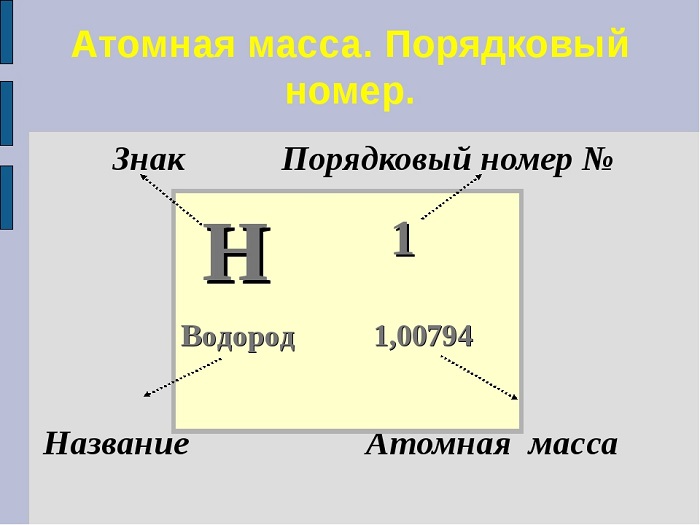 (Источник)
(Источник)
Например: Ar(Mg) = 24,305 ~ 24
Ar(Fe) = 55,847 ~ 56
Ar(Cl) = 35.453 ~ 35,5
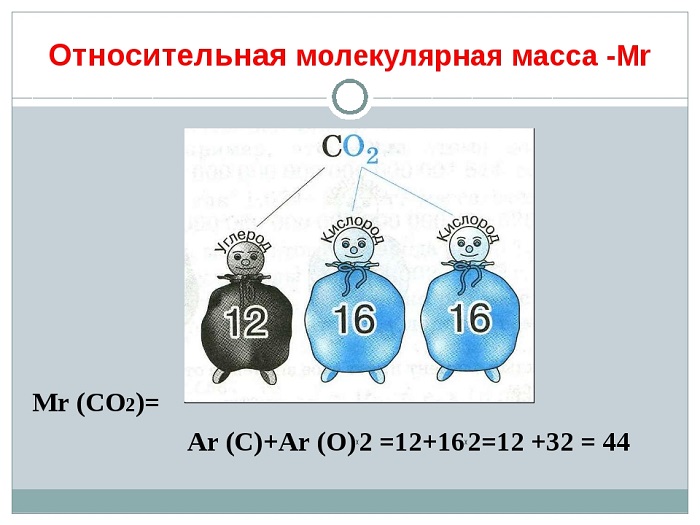
Относительная молекулярная масса (ОММ)
Данная величина относится также к количественным характеристикам. Более точное название — относительная формульная масса, потому что строение веществ бывает разным (в зависимости от того, какими частицами оно образовано).
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.
 (Источник)
(Источник)
Определим ОММ, например:
Сероводорода
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797 ~ 1) и S (32,064 ~ 32) и путём сложения вычисляем Mr(H2S).
Глюкозы
Mr (C6H12O6) = 6∙Ar(C) + 12∙Ar(H) + 6∙Ar(O) = 6∙12+12∙1 + 6∙16 = 180
Гашёной извести
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Фосфата кальция
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
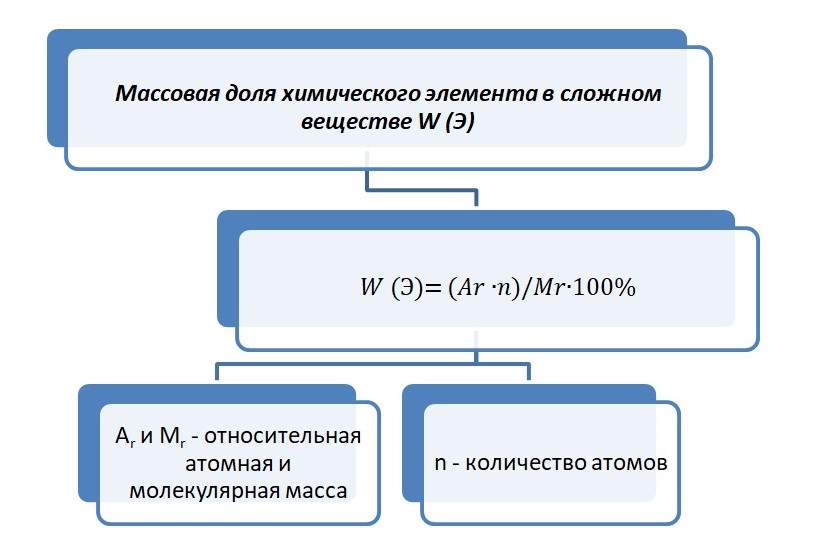
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Состав:
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
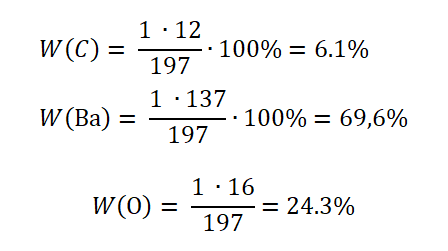
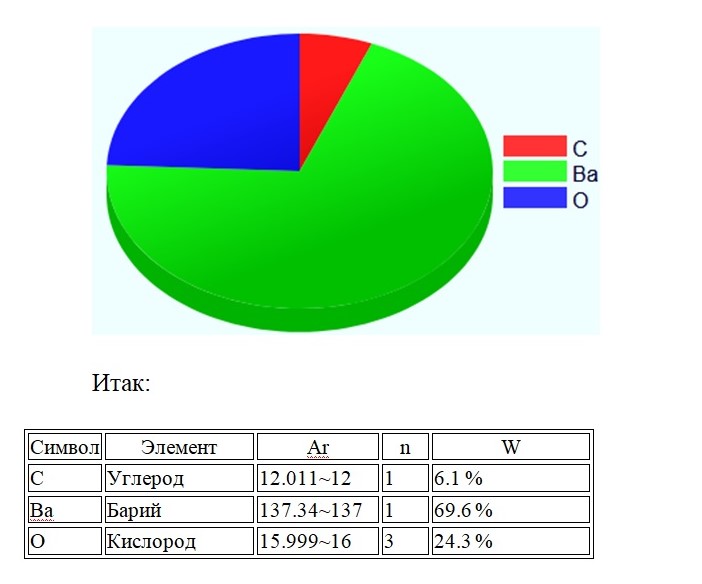
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
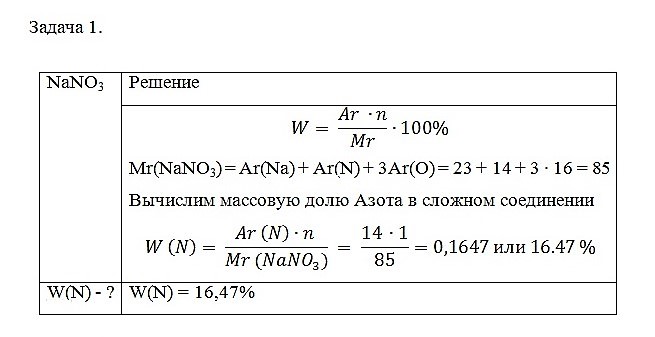
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?

Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
 (Источник)
(Источник)
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
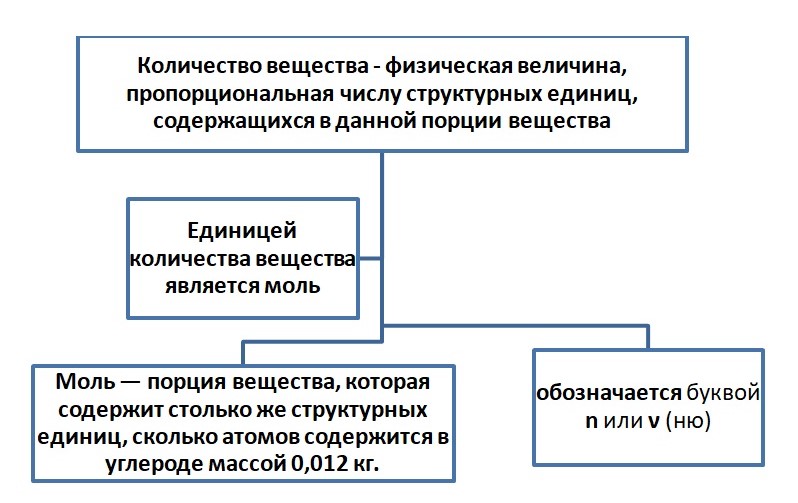
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10−23г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
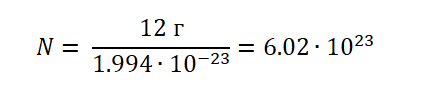
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙1023 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
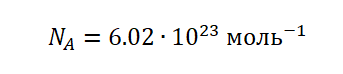
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
N = n * NA
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N — количество структурных единиц,
n — количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 1024 молекул хлора? 
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)

Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г/моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
m = n * M
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.
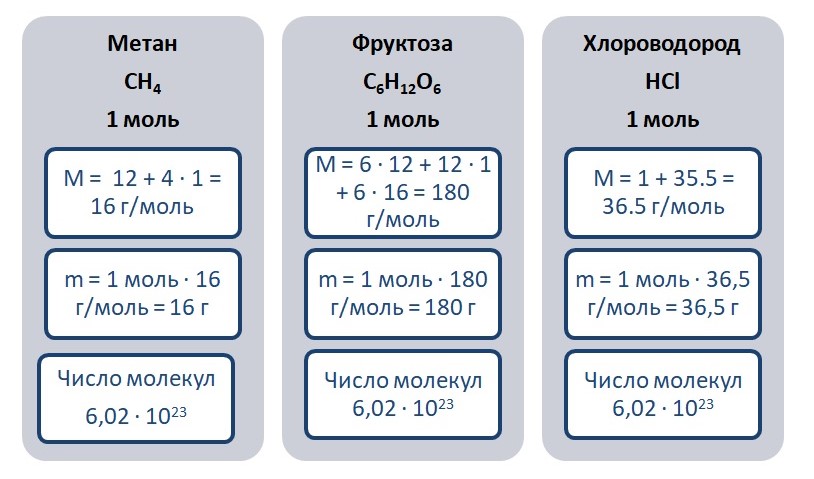
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
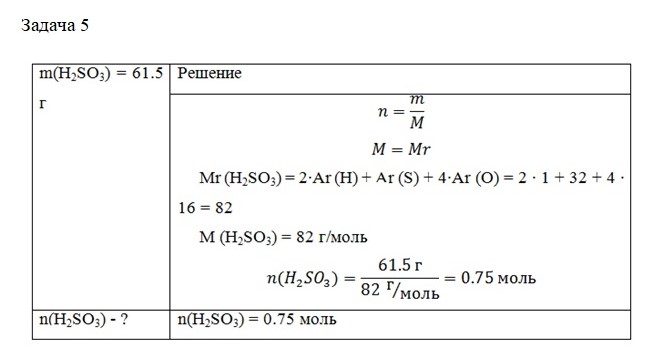
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 1023 структурных единиц.
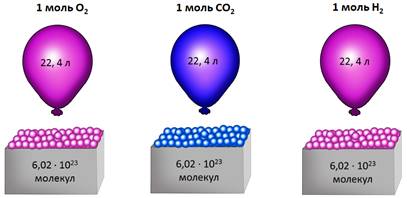
(Источник)
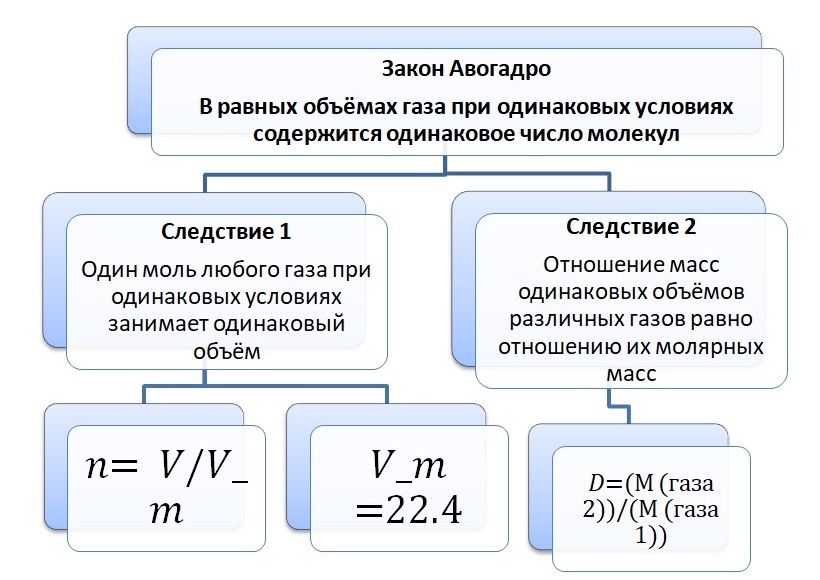
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
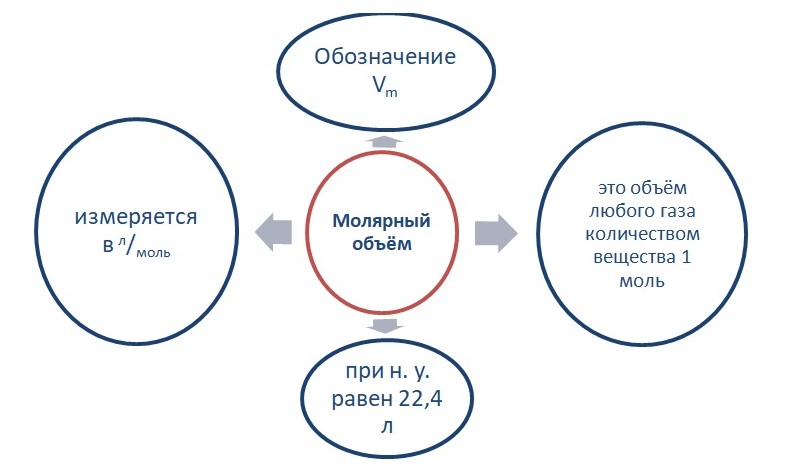
Связь количества вещества и объёма выражается в следующем виде:
V = n * Vm
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?

Как можно увидеть, количество вещества связывает три величины:
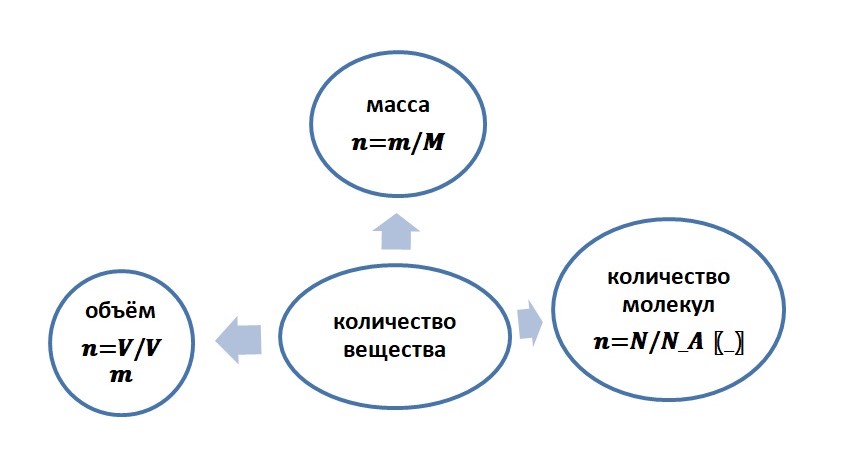
Приравняв между собой три выражения, а именно:
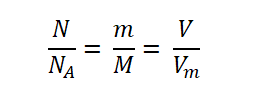
Получаем следующую взаимосвязь
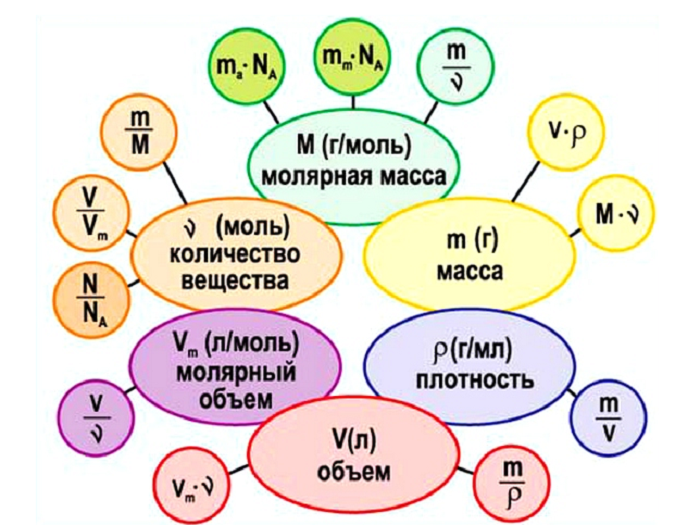
(Источник)
Задача 7. Какую массу составляют 18.06 ∙1023 молекул аммиака (NH3)?

Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?

Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(He) = 4
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Задача 9. Вычислите относительную плотность кислорода по воздуху
Относительная плотность кислорода по воздуху равна