Какими свойствами обладают соединения азота

Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
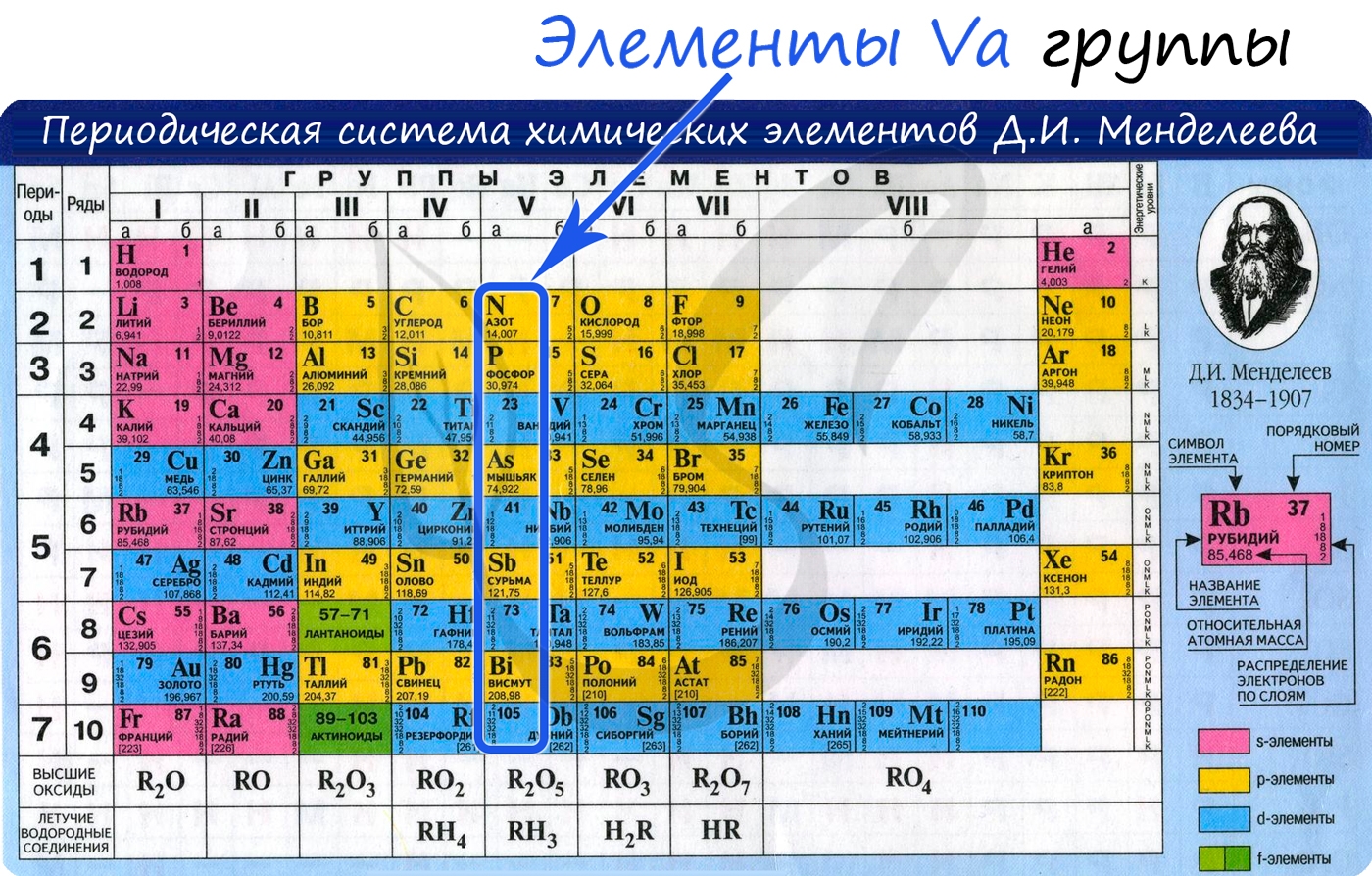
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
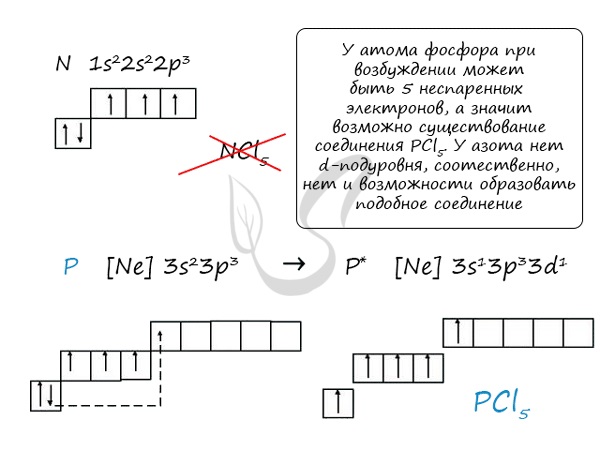
Основное и возбужденное состояние азота
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
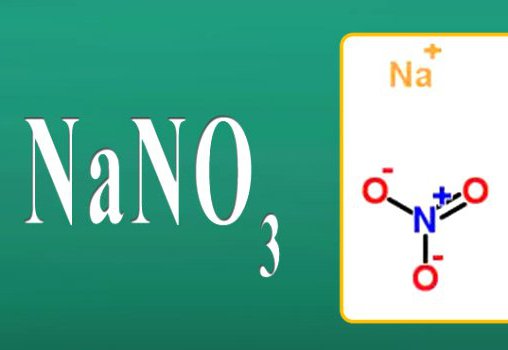
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
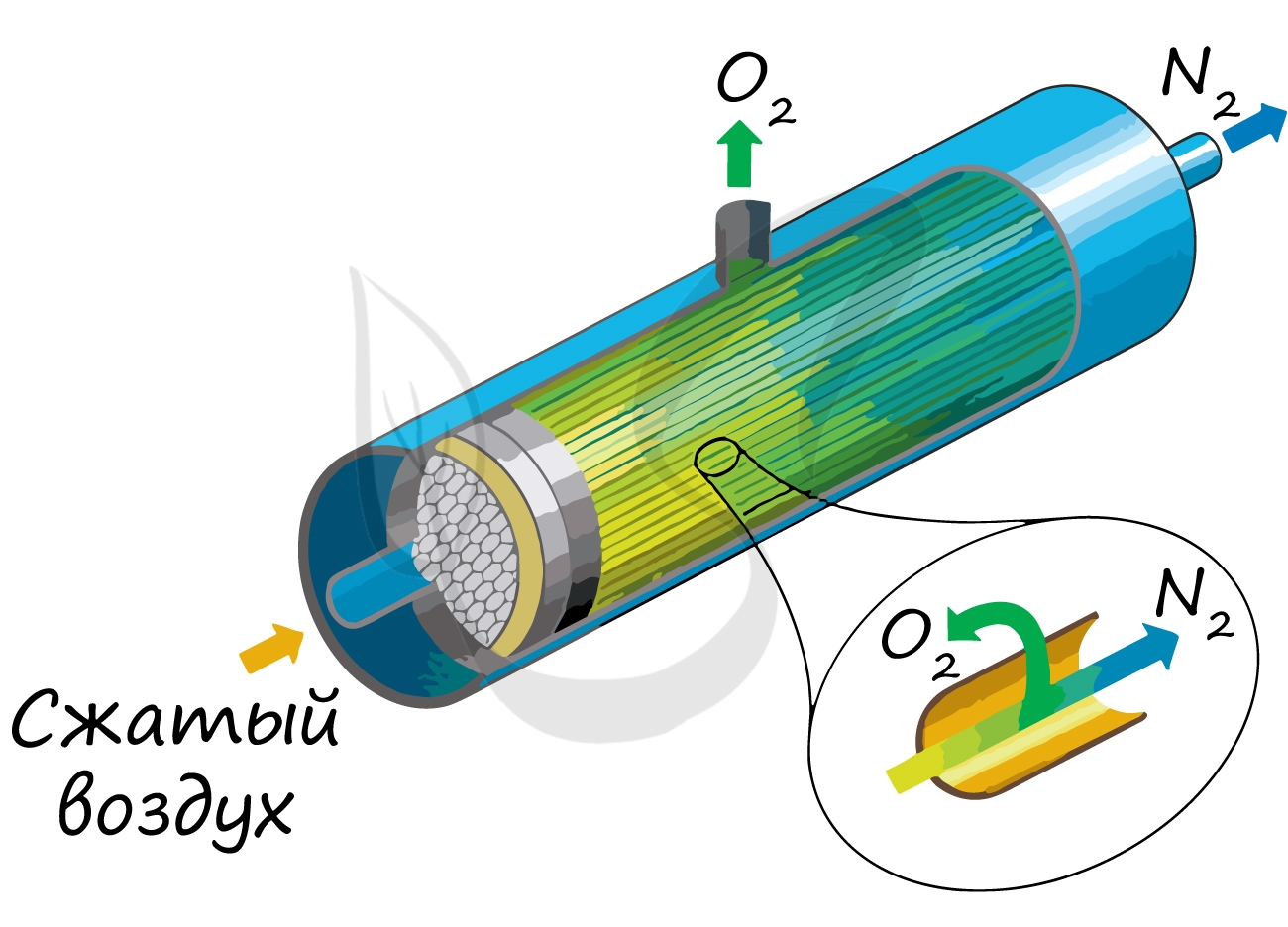
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
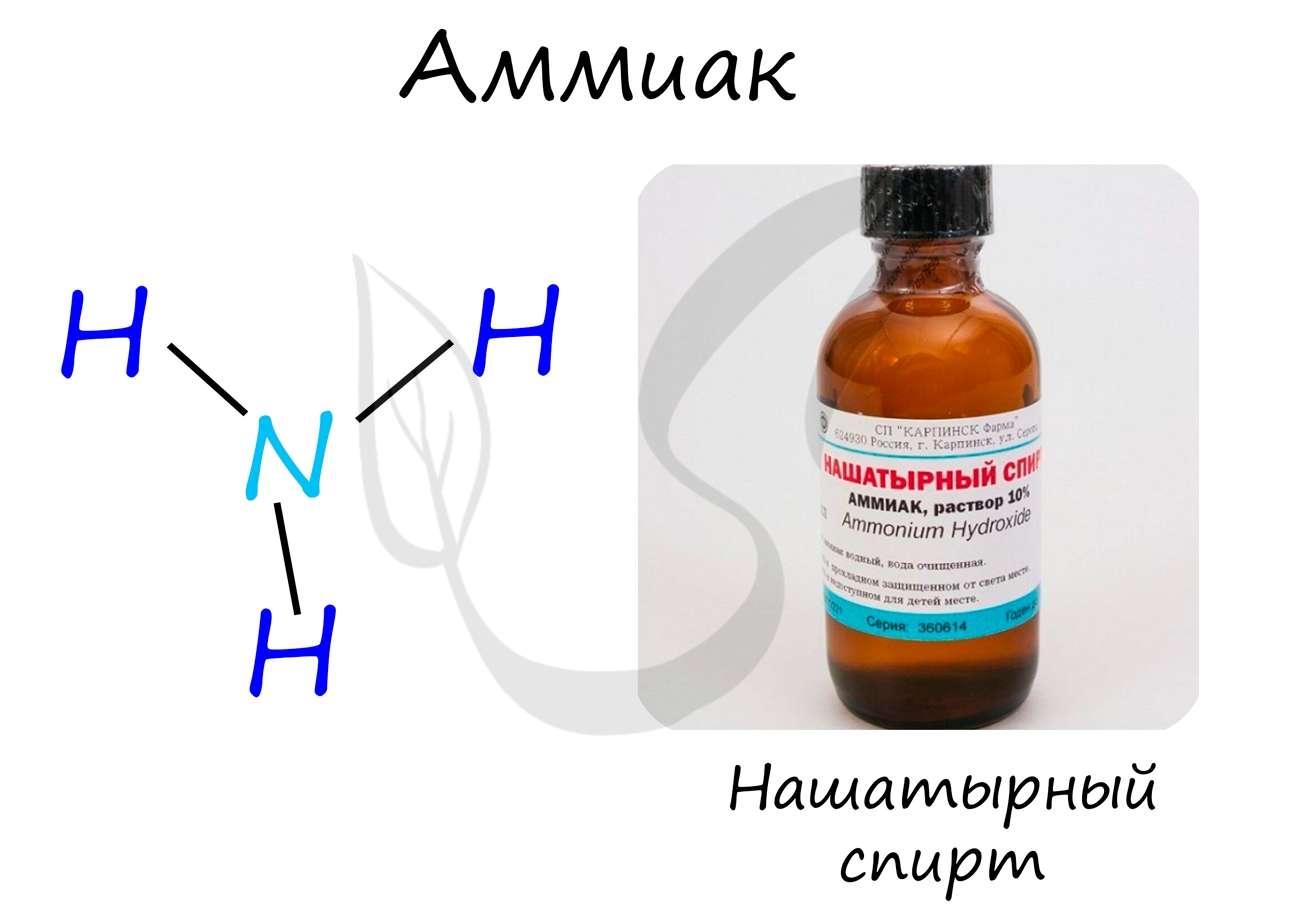
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 → H3AsO 3 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота — HNO2, соли которой называются нитриты (NO2-).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Рождающий селитру — так переводится с латинского языка слово Nitrogenium. Это название азота — химического элемента с атомным номером 7, возглавляющего 15-ю группу в длинном варианте периодической таблицы. В форме простого вещества распространен в составе воздушной оболочки Земли — атмосферы. Разнообразные соединения азота встречаются в земной коре и живых организмах, находят широкое применение в отраслях промышленности, военном деле, сельском хозяйстве и медицине.
Почему азот называли «удушливым» и «безжизненным»
Как предполагают историки химии, первым получил это простое вещество Генри Кавендиш (1777). Ученый пропускал воздух над раскаленными углями, для поглощения продуктов реакции использовал щелочь. В результате опыта исследователь обнаружил бесцветный газ без запаха, не вступивший в реакцию с углем. Кавендиш назвал его «удушливым воздухом» за неспособность поддерживать дыхание, а также горение.
Современный химик объяснил бы, что кислород прореагировал с углем, образовался углекислый газ. Оставшаяся «удушливая» часть воздуха состояла по большей части из молекул N2. Кавендиш и другие ученые в то время об этом веществе еще не знали, хотя соединения азота и селитры тогда широко использовались в хозяйстве. Ученый сообщил о необычном газе своему коллеге, проводившему аналогичные опыты, — Джозефу Пристли.
Одновременно Карл Шееле обратил внимание на неизвестную составную часть воздуха, но не сумел правильно объяснить ее происхождение. Только Даниэль Рутерфорд в 1772 году понял, что присутствующий в экспериментах «удушливый» «испорченный» газ — азот. Какого ученого считать его первооткрывателем — об этом до сих пор ведут спор историки науки.

Через 15 лет после опытов Рутерфорда знаменитый химик Антуан Лавуазье предложил сменить термин «испорченный» воздух, относившийся к азоту, на другой — Nitrogenium. К тому времени было доказано, что это вещество не горит, не поддерживает дыхание. Тогда же появилось русское название «азот», которое трактуется по-разному. Чаще всего говорят, что термин означает «безжизненный». Последующие работы опровергли распространенное мнение о свойствах вещества. Соединения азота — белки — важнейшие макромолекулы в составе живых организмов. Для их построения растения поглощают из почвы необходимые элементы минерального питания — ионы NO32- и NH4+.
Азот — химический элемент
Разобраться в строении атома и свойствах помогает периодическая система (ПС). По положению химического элемента в таблице Менделеева можно определить заряд ядра, количество протонов и нейтронов (массовое число). Необходимо обратить внимание на значение атомной массы — это одна из главных характеристик элемента. Номер периода соответсвует количеству энергетических уровней. В коротком варианте периодической таблицы номер группы соответствует числу электронов на внешнем энергатическом уровне. Обобщим все данные в общей характеристике азота по его положению в периодической системе:
- Это неметаллический элемент, находится в правом верхнем углу ПС.
- Химический знак: N.
- Порядковый номер: 7.
- Относительная атомная масса: 14,0067.
- Формула летучего водородного соединения: NH3 (аммиак).
- Образует высший оксид N2O5, в котором валентность азота равна V.
Строение атома азота:
- Заряд ядра: +7.
- Число протонов:7; число нейтронов: 7.
- Количество энергетических уровней: 2.
- Общее число электронов: 7; электронная формула: 1s22s22p3.
Подробно изучены стабильные изотопы элемента № 7, их массовые числа — 14 и 15. Содержание атомов более легкого из них составляет 99,64 %. В ядрах короткоживущих радиоактивных изотопов находится также 7 протонов, а число нейтронов сильно варьируется: 4, 5, 6, 9, 10.
Азот в природе
В составе воздушной оболочки Земли присутствуют молекулы простого вещества, формула которого — N2. Содержание газообразного азота в атмосфере составляет по объему примерно 78,1 %. Неорганические соединения этого химического элемента в земной коре — различные соли аммония и нитраты (селитры). Формулы соединений и названия некоторых из важнейших веществ:
- NH3, аммиак.
- NO2, диоксид азота.
- NaNO3, нитрат натрия.
- (NH4)2SO4, сульфат аммония.
Валентность азота в двух последних соединениях — IV. Каменный уголь, почва, живые организмы также содержат атомы N в связанном виде. Азот является составной частью макромолекул аминокислот, нуклеотидов ДНК и РНК, гормонов и гемоглобина. Общее содержание химического элемента в теле человека достигает 2,5 %.
Простое вещество
Азот в виде двухатомных молекул — самая большая по объему и массе часть воздуха атмосферы. Вещество, формула которого N2, не обладает запахом, цветом и вкусом. Этот газ составляет более 2/3 воздушной оболочки Земли. В жидком виде азот представляет собой бесцветную субстанцию, напоминающую воду. Кипит при температуре –195,8 °C. М (N2) = 28 г/моль. Простое вещество азот немного легче кислорода, его плотность по воздуху близка к 1.
Атомы в молекуле прочно связывают 3 общие электронные пары. Соединение проявляет высокую химическую устойчивость, что отличает его от кислорода и ряда других газообразных веществ. Для того чтобы молекула азота распалась на составляющие ее атомы, необходимо затратить энергию 942,9 кдж/моль. Связь из трех пар электронов очень прочная, начинает разрушаться при нагревании свыше 2000 °С.
При нормальных условиях диссоциация молекул на атомы практически не происходит. Химическая инертность азота также обусловлена полным отсутствием полярности в его молекулах. Они очень слабо взаимодействуют друг с другом, чем обусловлено газообразное состояние вещества при нормальном давлении и температуре, близкой к комнатной. Низкая химическая активность молекулярного азота находит применение в разных процессах и устройствах, где необходимо создать инертную среду.
Диссоциация молекул N2 может происходить под влиянием солнечного излучения в верхних слоях атмосферы. Образуется атомарный азот, который при нормальных условиях реагирует с некоторыми металлами и неметаллами (фосфором, серой, мышьяком). В результате идет синтез веществ, которые в земных условиях получают косвенным путем.

Валентность азота
Наружный электронный слой атома образуют 2 s и 3 p электрона. Эти отрицательные частицы азот может отдать при взаимодействии с другими элементами, что соответствует его восстановительным свойствам. Присоединяя недостающие до октета 3 электрона, атом проявляет окислительные способности. Электроотрицательность азота ниже, его неметаллические свойства менее выражены, чем у фтора, кислорода и хлора. При взаимодействии с этими химическими элементами азот отдает электроны (окисляется). Восстановлением до отрицательных ионов сопровождаются реакции с другими неметаллами и металлами.
Типичная валентность азота — III. В этом случае химические связи образуются за счет притяжения внешних р-электронов и создания общих (связывающих) пар. Азот способен к образованию донорно-акцепторной связи за счет своей неподеленной пары электронов, как это происходит в ионе аммония NH4+.
Получение в лаборатории и промышленности
Один из лабораторных способов основан на окислительных свойствах оксида меди. Используется соединение азота с водородом — аммиак NH3. Этот неприятно пахнущий газ взаимоддействует с порошкообразным оксидом меди черного цвета. В результате реакции выделяется азот и появляется металлическая медь (красный порошок). На стенках трубки оседают капли воды — еще одного продукта реакции.
Другой лабораторный способ, в котором используется соединение азота с металлами — азид, например NaN3. Получается газ, который не надо очищать от примесей.
В лаборатории проводят разложение нитрита аммония на азот и воду. Для того чтобы реакция началась, требуется нагревание, затем процесс идет с выделением тепла (экзотермический). Азот загрязнен примесями, поэтому его очищают и осушают.
Получение азота в промышленности:
- фракционная перегонка жидкого воздуха — способ, в котором используются физические свойства азота и кислорода (разные температуры кипения);
- химическая реакция воздуха с раскаленным каменным углем;
- адсорбционное газоразделение.
Взаимодействие с металлами и водородом — окислительные свойства
Инертность прочных молекул не позволяет получать некоторые соединения азота прямым синтезом. Для активации атомов необходимо сильное нагревание или облучение вещества. Азот может прореагировать с литием при комнатной температуре, с магнием, кальцием и натрием реакция идет лишь при нагревании. Образуются нитриды соответствующих металлов.
Взаимодействие азота с водородом происходит при высоких значениях температуры и давления. Также для этого процесса необходим катализатор. Получается аммиак — один из важнейших продуктов химического синтеза. Азот, как окислитель, проявляет в своих соединениях три отрицательные степени окисления:
- −3 (аммиак и другие водородные соединения азота — нитриды);
- −2 (гидразин N2H4);
- −1 (гидроксиламин NH2OH).
Важнейший нитрид — аммиак — в больших количествах получают в промышленности. Большой проблемой долгое время оставалась химическая инертность азота. Его сырьевыми источниками были селитры, но запасы минералов стали быстро сокращаться с ростом производства.

Большим достижением химической науки и практики стало создание аммиачного метода связывания азота в промышленных масштабах. В специальных колоннах проводится прямой синтез — обратимый процесс между азотом, полученным из воздуха, и водородом. При создании оптимальных условий, сдвигающих равновесие этой реакции в сторону продукта, применении катализатора выход аммиака достигает 97 %.
Взаимодействие с кислородом — восстановительные свойства
Для того чтобы началась реакция азота и кислорода, необходимо сильное нагревание. Достаточной энергией обладают электрическая дуга и грозовой разряд в атмосфере. Важнейшие неорганические соединения, в которых азот находится в своих положительных степенях окисления:
- +1 (оксид азота (I) N2O);
- +2 (монооксид азота NO);
- +3 (оксид азота (III) N2O3; азотистая кислота HNO2, ее соли нитриты);
- +4 (диоксид азота (IV) NO2);
- +5 (пентаоксид азота (V) N2O5, азотная кислота HNO3, нитраты).
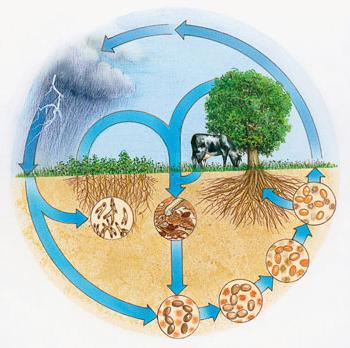
Значение в природе
Растения поглощают ионы аммония и нитратные анионы из почвы, используют для химических реакций синтез органических молекул, постоянно идущий в клетках. Атмосферный азот могут усваивать клубеньковые бактерии — микроскопические существа, образующие наросты на корнях бобовых культур. В результате эта группа растений получает необходимый элемент питания, обогащает им почву.
Во время тропических ливней происходят реакции окисления атмосферного азота. Оксиды растворяются с образованием кислот, эти соединения азота в воде поступают в почву. Благодаря круговороту элемента в природе постоянно восполняются его запасы в земной коре, воздухе. Сложные органические молекулы, содержащие в своем составе азот, разлагаются бактериями на неорганические составляющие.
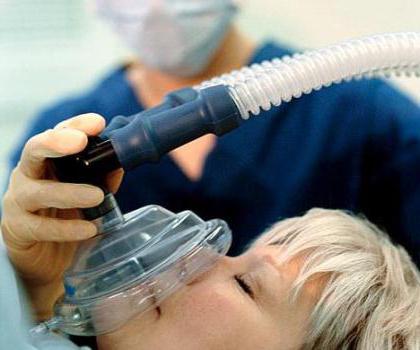
Практическое использование
Важнейшие соединения азота для сельского хозяйства — это хорошо растворимые соли. Усваиваются растениями мочевина, селитры (натриевая, калиевая, кальциевая), аммонийные соединения (водный раствор аммиака, хлорид, сульфат, нитрат аммония).
Инертные свойства азота, неспособность растений усваивать его из воздуха приводят к необходимости ежегодно вносить большие дозы нитратов. Части растительного организма способны запасать макроэлемент питания «впрок», что ухудшает качество продукции. Избыток нитратов в овощах и фруктах может вызвать у людей отравления, рост злокачественных новообразований. Кроме сельского хозяйства, соединения азота используются в других отраслях:
- для получения медикаментов;
- для химического синтеза высокомолекулярных соединений;
- в производстве взрывчатки из тринитротолуола (тротила);
- для выпуска красителей.
Оксид NO находит применение в хирургии, вещество обладает обезболивающим эффектом. Потерю ощущений при вдыхании этого газа заметили еще первые исследователи химических свойств азота. Так появилось тривиальное название «веселящий газ».
Проблема нитратов в сельскохозяйственной продукции
В солях азотной кислоты — нитратах — содержится однозарядный анион NO3-. До сих пор используется старое наименование этой группы веществ — селитры. Применяются нитраты для удобрения полей, в теплицах, садах. Вносят их ранней весной перед посевом, летом — в виде жидких подкормок. Сами по себе вещества не представляют большой опасности для людей, но в организме они превращаются в нитриты, затем в нитрозамины. Нитритные ионы NO2- — токсичные частицы, они вызывают окисление двухвалентного железа в молекулах гемоглобина в трехвалентные ионы. В таком состоянии главное вещество крови человека и животных не способно переносить кислород и удалять из тканей углекислый газ.
Чем опасно нитратное загрязнение продуктов питания для здоровья человека:
- злокачественными опухолями, возникающими при превращении нитратов в нитрозамины (канцерогены);
- развитием язвенного колита,
- гипотензией или гипертензией;
- сердечной недостаточностью;
- нарушением свертываемости крови
- поражениями печени, поджелудочной железы, развитием диабета;
- развитием почечной недостаточности;
- анемией, нарушениями памяти, внимания, интеллекта.
Одновременное употребление разных продуктов с большими дозами нитратов приводит к острому отравлению. Источниками могут быть растения, питьевая вода, готовые мясные блюда. Замачиванием в чистой воде и кулинарной обработкой можно снизить в продуктах питания содержание нитратов. Исследователи выяснили, что более высокие дозы опасных соединений отмечены в незрелой и тепличной растительной продукции.

Фосфор — элемент подгруппы азота
Атомы химических элементов, которые находятся в одном вертикальном столбце периодической системы, проявляют общие свойства. Фосфор расположен в третьем периоде, относится к 15 группе, как и азот. Строение атомов элементов сходное, но существуют различия в свойствах. Азот и фосфор проявляют отрицательную степень окисления и валентность III в своих соединениях с металлами и водородом.
Многие реакции фосфора идут при обычных температурах, это химически активный элемент. Взаимодействует с кислородом с образованием высшего оксида Р2О5. Водный раствор этого вещества обладает свойствами кислоты (метафосфорной). При ее нагревании получается ортофосфорная кислота. Она образует несколько типов солей, многие из которых служат минеральными удобрениями, например суперфосфаты. Соединения азота и фосфора составляют важную часть круговорота веществ и энергии на нашей планете, используются в промышленной, сельскохозяйственной и других сферах деятельности.
