Какими свойствами обладают силы молекулярного взаимодействия
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Межмолекулярное взаимодействие имеет электростатическую природу. Предположение о его существовании было впервые использовано Я. Д. Ван-дер-Ваальсом в 1873 году для объяснения свойств реальных газов и жидкостей. В наиболее широком смысле под ним можно понимать такие взаимодействия между любыми частицами (молекулами, атомами, ионами), при которых не происходит образования химических, то есть ионных, ковалентных или металлических связей. Иными словами, эти взаимодействия существенно слабее ковалентных и не приводят к существенной перестройке электронного строения взаимодействующих частиц.
На больших расстояниях преобладают силы притяжения, которые могут иметь ориентационную, поляризационную (индукционную) и дисперсионную природу (см. подробнее в статьях Силы Ван-дер-Ваальса и Дисперсионные силы). При усреднении по вращению частиц, происходящему вследствие теплового движения, потенциал межмолекулярных сил обратно пропорционален шестой степени расстояния, а ион-дипольных (как с постоянным, так и с наведенным диполем) — четвёртой степени. На малых расстояниях начинают преобладать силы отталкивания электронных оболочек частиц. Особым случаем является водородная связь — возникающее на малом расстоянии взаимодействие между атомом водорода одной молекулы и электроотрицательным атомом другой, когда эти атомы несут достаточно большой эффективный заряд.
Упаковку частиц и расстояние между ними в конденсированной фазе, определяющиеся равновесием между притяжением и отталкиванием, можно предсказать, исходя из ван-дер-ваальсовых радиусов составляющих молекулы атомов (ионных в случае ионов): расстояния между атомами разных молекул не должны превышать суммы радиусов этих атомов. Для моделирования межмолекулярных взаимодействий используют эмпирические потенциалы, среди которых наиболее известны потенциалы Леннард-Джонса (отталкивание описывается двенадцатой степенью обратного расстояния, притяжение — шестой) и Бакингема (с более физически обоснованным экспоненциальным отталкиванием), из которых первый более удобен для расчетов. В конденсированной фазе, где мультипольное разложение для молекул плохо применимо из-за близости молекул друг к другу, может применяться метод атом-атомных потенциалов, основанный на тех же потенциалах, но уже для парных взаимодействий атомов и с добавкой кулоновских членов, описывающих взаимодействие их эффективных зарядов.
Межмолекулярное взаимодействие, водородная связь[править | править код]
Дипольная молекула создает вокруг себя электростатическое поле и ориентирует остальные диполи системы, что приводит к снижению энергии. Рассчитанная П.Кизомом средняя энергия ориентационного диполь-дипольного взаимодействия между полярными молекулами составляет:
(формула 1) где — дипольный момент молекулы; r — расстояние между центрами молекул; k — константа Больцмана; T — температура по Кельвину.
Множитель (kT) в знаменателе отражает влияние флуктуации на ориентацию диполей вследствие теплового движения, которое возрастает с увеличением температуры. Кроме ориентационного, следует учитывать индукционный эффект (), то есть взаимодействие диполя с приведенным диполем, который, соответственно с П.Дебаем, равен:
(формула 2)
Ориентационные и индукционные силы возникают между полярными молекулами и не могут объяснить межмолекулярное взаимодействие между неполярными. Учитывание так сказать слабой квадруполь-квадруполь взаимодействия не решает проблему, тем более, что молекула типа и атомы инертных газов не имеют вообще квадрупольного момента (отметим, что квадрупольный момент (без дипольного) имеют молекулы типа квадруполями можно считать двухатомные гомоядерные молекулы — и т.д.).
Природа межмолекулярных сил в неполярных системах была определена Ф.Лондоном с помощью квантовой механики. Можно сказать лишь, что учитывание корреляции во время движения атомных электронов приводит к снижению энергии. Если движение электронов в разных атомах скоррелировано, то это также способствует снижению энергии. Атомы с подвижными электронами можно считать диполями, которые осциллируют с некоторой частотой . При синхронном движении электронов мгновенные диполи ориентируются всегда так, что это приводит к снижению энергии:
(формула 3)
Заменив на , где — энергия ионизации молекулы (атома), получим:
(формула 4) Эту формулу можно получить более последовательно (не применяя модель осциллирующих диполей) на основе теории возмущений.
Дж.Слетер и Дж.Кирквуд для взаимодействия многоэлектронных атомов вывели следующую формулу:
(формула 5) где N — количество электронов на внешней оболочке; m — масса электрона; е — его заряд.
Формулы (3) и (5) совпадают при N=1, если вместо подставить его выражение: Из приведенных формул можно сделать вывод о том, что основная характеристика, которая определяет величину сил Лондона, — это поляризованность () атомов (молекул). В связи с тем, что поляризованность тесно связана с коэффициентом преломления света и характеризует способность вещества к рассеиванию энергии (дисперсии) света, силы Лондона часто называют дисперсионными ().
Поляризованность зависит от размера частички, поэтому прочность молекулярных решеток должна возрастать с увеличением размеров атомов и молекул, которые взаимодействуют. Эта закономерность хорошо иллюстрируется увеличением температур кипения (аналогические зависимости наблюдаются для теплот и температур плавления, сублимации, испарения и т.д., то есть для величин, которые зависят от прочности молекулярных связей) в группе инертных газов в гомологическом ряду парафинов.
Атом Гелия настолько мал и дисперсионные силы при взаимодействии атомов Гелия такие слабые, что Гелий не может существовать в кристаллическом состоянии даже при обычном давлении и 0К. Причина этого — существование нулевой кинетической энергии, которая для гелия больше, чем энергия связи. Наличие кинетической энергии ядер в связанных атомах (при 0К) является следствием соотношения неопределенностей Гейзенберга.
Энергия связи для гелия кДж/моль, где m — масса атома Гелия.
Поэтому, и кристаллическое состояние не может реализоваться даже при 0К. Лишь при большом внешнем давлении гелий может перейти в кристаллическое состояние.
Все межмолекулярные взаимодействия (их часто объединяют общим названием — взаимодействие Ван дер Вальса) можно выразить в таком виде:
Ориентационное, индукционное и дисперсионное взаимодействия делают разный вклад в энергию связи. Для атомов и неполярных молекул и равны нулю и остается только дисперсионное взаимодействие. Вклад ориентационных и индукционных сил увеличивается с ростом дипольного момента молекул. В молекуле (1D-дебай= Кл * м) вносит 0,005%, а — 14,4%, — 4,2%; В — 3,3%, — 2,2%; — 14,4%, — 4,2%.
Благодаря приведенным формулам можно сделать вывод, что даже для очень полярных молекул дисперсионное взаимодействие делает огромный вклад.
См. также[править | править код]
- Силы Ван-дер-Ваальса
- Межатомное взаимодействие
Литература[править | править код]
- [www.xumuk.ru/encyklopedia/2477.html Межмолекулярные взаимодействия] // Химическая энциклопедия. Т. 3. — М.: Большая Российская энциклопедия, 1992. С. 12-15.
- Маррел Дж., Кеттл С., Теддер Дж. Химическая связь / Пер. с англ. С. В. Христенко. Под ред. И. В. Александрова. — М.: Мир, 1980.— 382 с.
- Бараш Ю. С. «Силы Ван-дер-Ваальса» М.: Наука, 1988. 344с.
- Каплан И. Г. «Введение в теорию межмолекулярных взаимодействий» М.: Наука, 1982. 312с.
- Каплан И. Г. Межмолекулярные взаимодействия. Физическая интерпретация, компьютерные расчеты и модельные потенциал М.: БИНОМ. Лаборатория знаний, 2012. — 400 с. ISBN 978-5-94774-939-7
- «Межмолекулярные взаимодействия; от двухатомных молекул до биополимеров» Пюльман Б. (ред) Пер. с англ., М.: Мир, 1981. — 592с.
- Израелашвили Дж. Межмолекулярные и поверхностные силы. М.: Научный мир, 2011. — 456 с. ISBN 978-5-91522-222-8
Ссылки[править | править код]
- Межмолекулярное взаимодействие в ФЭ
- [www.xumuk.ru/bse/1603.html Межмолекулярное взаимодействие] в БСЭ
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Ионная связь
Как известно, молекулы состоят из атомов. Электроны около ядра в атоме удерживаются кулоновскими силами притяжения разноимённых зарядов. Атом в целом, при этом электрически нейтрален. Силы, удерживающие вместе атомы в молекуле, по своей природе тоже электрические. Существует два типа связей атомов в молекуле: ионная связь и ковалентная. В некоторых атомах электрон (или электроны) очень слабо связаны с атомом в целом. Эти электроны легко теряются атомом, тогда образуется положительно заряженный ион. Либо все электроны очень крепко связаны с атомом, но при благоприятных условиях атом захватывает электрон или даже два и превращается в отрицательно заряженный ион. Между ионами существуют силы кулоновского притяжения, которые и обеспечивают образование молекулы. К числу таких молекул относят, например, молекулы N$a^+$C$l^-$. Потенциальная энергия притяжения ионов N$a^+$ и C$l^-$ равна:
где — заряд электрона, $r_0$- равновесное расстояние между ионами, ${varepsilon }_0$- электрическая постоянная.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Наряду с энергией (1) существует энергия, связанная с силами отталкивания между ионами при их очень большом сближении, так как они не могут проникнуть друг в друга. Эти силы велики лишь при очень малых расстояниях между ионами и очень быстро убывают при увеличении этого расстояния. Соответственно, их вклад в полную энергию мал (около 10%). Поэтому для расчета энергии диссоциации ($triangle E$) молекулы N$a^+$C$l^-$ используют соотношение: ($triangle E=left|Uright|$.
С физической точки зрения ионная связь характеризуется полным обменом зарядом (электроном) между ионами.
Ковалентная связь
При частичном обмене зарядом возникает ковалентная связь. Поясним, как образуется ковалентная связь:
Два положительных иона (например, в молекуле водорода $H_2$) отталкиваются кулоновскими силами. Поместим между ними посередине отрицательный заряд по модулю равный положительным зарядам ионов. Тогда со стороны этого заряда на положительные ионы действуют силы притяжения, в четыре раза большие, чем силы отталкивания положительных зарядов. Квантовая механика объясняет, как возникает движение электронов, при котором некоторые электроны при своем движении большую часть времени проводят между положительно заряженными ядрами.
Не существует универсального закона, описывающего межмолекулярное взаимодействие. Оно зависит от свойств молекул, условий взаимодействия, механизма его осуществления и других конкретных факторов. Межмолекулярное взаимодействие описывается всегда приближенными формулами с границами их справедливости.
Если средняя кинетическая энергия молекул меньше абсолютного значения средней энергии из взаимного притяжения (т.е., если энергия взаимодействия + кинетическая энергия отрицательна), то возникает связанное состояние системы молекул, т.е. либо жидкость, либо твердое тело.
Помимо сил, которые заставляют атомы образовывать молекулы, существуют и другие силы, которые заставляют взаимодействовать и молекулы. Они, например, являются причиной конденсации газов и превращения их в жидкие и твердые тела. Силы межмолекулярного взаимодействия, которые действуют в газах.
Три вида ван-дер-ваальсовских сил
Между молекулами любого газа действуют силы межмолекулярного притяжения и отталкивания. Они имеют электромагнитную и квантовую природу. Силы притяжения, которые проявляются на расстояниях между центрами молекул порядка $10^{-9}м$, называются ван-дер-ваальсовскими силами. Они являются причиной поправки на внутреннее давление в уравнении состояния Ван-дер Ваальса и убывают с расстоянием $sim frac{1}{r^7}$. Это соответствует потенциальной энергии, изменяющейся по закону:$Usim frac{1}{r^6}$.
Различают три вида ван-дер-ваальсовских сил:
- Ориентационные силы, действующие между двумя молекулами, которые обладают дипольными моментами pe и стремятся расположить молекулы упорядоченно так, чтобы векторы дипольных моментов ориентировались вдоль одной прямой. Этому препятствует тепловое движение молекул. При высоких температурах потенциальная энергия $U_{or}$ ориентационного взаимодействия равна:
- Индукционные силы возникают между молекулами, обладающими высокой поляризуемостью. Если молекулы достаточно сближены, то под действием электрического поля одной из них в другой возникает индуцированный дипольный момент $overrightarrow{p_e}={varepsilon }_0alpha overrightarrow{E}, $ где $alpha $- поляризуемость молекулы, $overrightarrow{E}$- напряженность поле первой молекулы. Потенциальная энергия Uind индукционного взаимодействия не зависит от температуры:
- Дисперсионные силы возникают в результате возбуждения колебаний электронов в молекуле (атоме) под влиянием колебаний электронов в других молекулах (атомах). Дисперсионное взаимодействие определяется нулевой энергией молекул (атомов), если колебания их могут быть рассмотрены как колебания линейных гармонических осцилляторов. В этом приближении потенциальная энергия $U_{disp} $дисперсиального взаимодействия:
[Uor=-frac{p^4_e}{24{pi }^2{varepsilon }^2_0kT}frac{1}{r^6}left(2right),]
где k — постоянная Больцмана, T — термодинамическая температура, ${varepsilon }_0$- электрическая постоянная.
[U_{ind}=-frac{alpha p^2_e}{8{pi }^2{varepsilon }^2_0}frac{1}{r^6}left(3right).]
[U_{disp}=-frac{e^4{nu }_0h}{32 pi^2 {varepsilon_o}^2 a^2}frac{1}{r^6}left(4right),]
где $h$ — постоянная Планка, e — элементарный заряд, ${nu }_0=frac{1}{2pi }sqrt{frac{a}{m}}$, — частота колебаний атомов — осцилляторов, a — коэффициент пропорциональности.
Энергию дисперсного взаимодействия в первом приближении можно рассчитать при помощи формулы Лондона:
[U_{disp}=-left(frac{1}{16{pi }^2}right)left(frac{3I_1I_2}{2left(I_1{+I}_2right)}right)left(frac{{alpha }_1{alpha }_2}{r^6}right)left(2.3right),]
где $I_1I_2$- потенциалы ионизации молекул. Они являются справочными для конкретных веществ.
Полная энергия ван-дер-ваальсовских сил:
[U=U_{disp}+U_{ind}+Uor left(5right).]
Для полярных молекул основную роль играют ориентационные силы, для остальных — дисперсионные. В большинстве случаев ван-дер — ваальсовы силы притяжения перекрываются значительно превосходящими их химически валентными силами.
Межмолекулярное взаимодействие на малых расстояниях не может быть выражено степенным законом и носит сложный характер. Силы межмолекулярного взаимодействия определяют агрегатное состояние вещества.
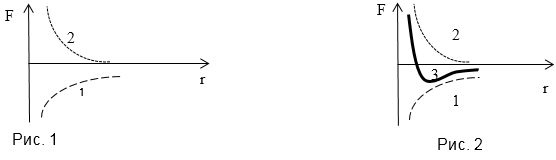
Пример 1
Задание: Силы отталкивания убывают с увеличением расстояния между центрами молекул по закону$f_{ott}sim frac{1}{r^n}, где nge 13$ то есть значительно быстрее, чем силы притяжения. На рисунке (рис.1) представлены зависимость от r сил притяжения (1) и сил отталкивания кривая (2). Нарисуйте результирующую кривую взаимодействия.
Решение: Сложим, имеющиеся кривые графически, получим (3) кривая взаимодействия:

Пример 2
Задание: Для системы Kr-HCl (криптон — хлороводород) укажите возможные виды межмолекулярных взаимодействий. Дипольные моменты веществ считать известными. Как рассчитать энергию разных видов взаимодействия при известных температуре (T) и расстоянии между диполями r?
Решение:
Криптон — инертный газ, он имеет завершенную электронную оболочку, его собственный дипольный момент равен нулю. Он способен только к дисперсионному взаимодействию. Оно проявляется между атомами Kr-Kr.
Хлороводород — соединение полярное, его электронная плотность смещена в сторону хлора. Полярные соединения способны ко всем видам взаимодействия между молекулами и между молекулами хлороводорода возникают ориентационные взаимодействия (HCl-HCl), но в паре с криптоном (HCl-Kr) ориентационные силы не проявляются — возможен только индукционный и дисперсионный эффекты.
Средняя энергия ориентационного взаимодействия двух молекул с дипольными моментами${ p}_{e1 }и{ p}_{e2 }$ при температуре T:
[U_1=-frac{2}{3}frac{p^2_{e1}p^2_{e2}}{{left(4pi {varepsilon }_0right)}^2}frac{1}{r^6}frac{1}{kT}left(2.1right),]
где r — расстояние между диполями, k — постоянная Больцмана.
Величина энергии индуцированного взаимодействия зависит от величины постоянного дипольного момента ($p^2_{e1}$) полярной молекулы HCl и от поляризуемость криптона (${alpha }_2$):
[U_{ind}=-2left(frac{p^2_{e1}}{16{pi }^2{varepsilon }_0}right)left(frac{{alpha }_2}{r^6}right)left(2.2right),]
где ${alpha }_2=2,43cdot 10^{-30}м^3$— поляризуемость криптона (справочная величина).
Энергия дисперсного взаимодействия в первом приближении дает формула Лондона:
[U_{disp}=-left(frac{1}{16{pi }^2}right)left(frac{3I_1I_2}{2left(I_1{+I}_2right)}right)left(frac{{alpha }_1б_2}{r^6}right)left(2.3right),]
где $I_1I_2$- потенциалы ионизации молекул. Для криптона $I_1=4,1cdot 10^2кДж/моль$, для HCl $I_2$=$12,3cdot 10^2кДж/моль$ , зная r можно рассчитать энергию дисперсного взаимодействия.
Ответ: Общая энергия взаимодействия криптона и хлороводорода определяется как сумма U=$U_{disp}$+$U_{ind}+Uor$, где соответствующие энергии определены формулами (2.1), (2.2), (2.3).
Коллоидная химия
Силы межмолекулярного взаимодействия.
Когда вещество находится в газообразном состоянии, тогда образующие его частицы – молекулы или атомы –
хаотически движутся и при этом преобладающую часть времени находятся на больших расстояниях
(в сравнении с их собственными размерами) расстояниях друг от друга. Вследствии этого силы взаимодействия между ними пренебрежимо малы.
Иначе обстоит дело, когда вещество находится в конденсированном состоянии – в жидком или твёрдом.
Здесь расстояния между частицами вещества малы и силы взаимодействия между ними велики.
Эти силы удерживают частицы жидкости или твёрдого тела друг около друга. Поэтому вещества в конденсированном состоянии имеют,
в отличии от газов, постоянный при данной температуре объём.
Все силы, удерживающие частицы жидкости или твёрдого тела друг около друга, имеют электрическую природу.
Но в зависимости от того, что представляют собой частицы – являются ли они атомами металического или неметалического элемента,
ионами или молекулами – эти силы существенно различны.
Неметалы с атомным строением
Если вещество состоит из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью.
Металлы
Если вещество – металл, то часть электронов его атомов становится общими для всех атомов. Эти электроны свободно
движутся между атомами, связывая их друг с другом.
Вещества с ионным строением
Если вещество имеет ионное строение, то образующие его ионы удерживаются друг около друга силами электростатического притяжения.
Вещества с молекулярным строением
В веществах с молекулярным строением имеет место межмолекулярное взаимодействие.
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются
на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах
механизм возникновения диполей различен.
1. Ориентационное взаимодействие.
Если вещество состоит из полярных молекул, например, Н2О, НCl, то в конденсированном состоянии молекулы
ориентируются друг по отношению к другу своими разноимённо заряженными концами, вследствии чего наблюдается их взаимное притяжение.
Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул
препятствует их взаимной ориентации, поэтому с ростом температуры ориентационный эффект ослабевает.
2. Индукционное взаимодействие.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например СО2,
наблюдается возникновение наведённых или индуцированных диполей.
Причина их появления обычно состоит в том, что каждый атом создаёт вблизи себя электрическое поле,
оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся
индуцированный диполь в свою очередь поляризует соседние молекулы.
В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается
также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
3. Дисперсионное взаимодействие.
Дисперсионные силы (Лондоновские силы) — силы электростатического притяжения мгновенного и индуцированного
(наведённого) диполей электрически нейтральных атомов или молекул.
В атомах и молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты
неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение.
Поэтому мгновенное значение дипольного момента (например, у атома водорода) отлично от нуля.
Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей.
Считается, что дисперсионная энергия не имеет классического аналога и определяется квантовомеханическими флуктуациями электронной плотности.
Как показывает квантовая механика, мгновенные диполи возникают в твёрдых телах и жидкостях согласованно, причём концы
соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению.
Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии.
В частности, оно обуславливает переход благородных газов при низких температурах в жидкое состояние.
Соотношение молекулярных сил.
Относительная величина рассмотренных видов межмолекулярных сил зависит от полярности и от поляризуемости молекул вещества.
Чем больше полярность молекул, тем больше ориентационные силы.
Чем крупнее атомы, чем слабее связаны внешние электроны атомов, чем больше деформируется электронное облако,
тем значительнее дисперсионные силы.
Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов,
составляющих размеры этих веществ.
Например:
- в случае HCl на долю дисперсионных сил приходится 81% всего
межмолекулярного взаимодействия, - для НBr эта величина составляет 95%,
- для HI — 99,5%.
Индукционные силы почти всегда малы.
