Какими свойствами обладают оксид и гидроксид алюминия

Алюминий. Применение алюминия и его сплавов
Алюминий расположен в 3-й группе главной подгруппы, в 3 периоде. Порядковый номер 13. Атомная масса ~27. Р-элемент. Электронная конфигурация: 1s22s22p63s23p1.На внешнем уровне 3s23p1 находятся 3 валентных электрона. Степень окисления +3, валентность – III.
Физические свойства:алюминий – металл серебристо-белого цвета, мягкий, механически прочный, тепло– и электропроводный, легко вытягивается в проволоку, прокатывается в тонкую фольгу, легко образует сплавы.
Химические свойства:
1) при обычной температуре реагирует с кислородом, образую окисную пленку, препятствуя дальнейшему окислению металла: 4Аl + 3О2 = 2Аl2О3;
2) алюминий, лишенный защитной оксидной пленки, взаимодействует с водой: 2Аl + 6Н2О = 2Аl(ОН)3? + 3Н2?;
3) алюминий энергично взаимодействует с растворами щелочей:
4) при нагревании алюминий взаимодействует с галогенами, с азотом, с углеродом, с серой, а также с аммиаком:
Получение.В промышленности алюминий получают электролизом раствора Аl2О3 в расплавленном криолите Na3AlF6 с добавлением СаF2. Алюминий выделяется на катоде.
Нахождение в природе:алюминий – один из наиболее распространенных элементов в земной коре – до 250 руд, содержащих алюминий: боксит – Аl2О3?хH2O – содержит от 32–60 % Аl2О3 (глинозема); корунд – Аl2О3 – кристаллическая модификация глинозема; рубин и сапфир – драгоценные камни; нефелин – (К, Na)2О?Аl2О3?2SiО2 – одна из важнейших алюминиевых руд; каолин – Аl2О3?2SiО2?2H2O – составляет основу всех глин; алунит – К2SO4?Аl2(SO4)3?2Аl2О3?6H2O – относятся к важнейшим алюминиевым рудам; криолит Na3[AlF6]; шпинель Мg(АlО2)2 и метаалюминаты типа шпинели Zn(АlО2)2. Сплавы алюминия: дюралюминий – 94 % Аl, 4 % Сu, по 0,5 % Мg, Мn, Fe и Si; силумин – Аl + ~13 % Si; магналий – Аl с содержанием Мg – 0,5—11,5 %.
Применение алюминия и его соединений и сплавов:алюминий и его соединения применяется в быту и во всех отраслях народного хозяйства: в машиностроении, автостроении, в химической промышленности (для производства и транспортировки холодной концентрированной HNO3, т. к. алюминий в ней пассивируется). При помощи алюмотерапии производят сварку рельсов, проводят сварочные работы под водой. Чистым алюминием покрывают бензобаки, что способствует предохранению бензина от теплового излучения.
Оксид алюминия – Al2O3. Физические свойства:оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность – 3,97 г/см3, температура плавления – 2053 °C, температура кипения – 3000 °C.
Химические свойства:оксид алюминия проявляет амфотерные свойства – свойства кислотных оксидов и основных оксидов и реагирует и с кислотами, и с основаниями. Кристаллический Аl2О3 химически пассивен, аморфный – более активен. Взаимодействие с растворами кислот дает средние соли алюминия, а с растворами оснований – комплексные соли – гидроксоалюминаты металлов:
При сплавлении оксида алюминия с твердыми щелочами металлов образуются двойные соли – метаалюминаты(безводные алюминаты):
Оксид алюминия не взаимодействует с водой и не растворяется в ней.
Получение:оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия , открытый Бекетовым :
Применение:оксид алюминия применяется для производства алюминия, в виде порошка – для огнеупорных, химически стойких и аб-разивных материалов, в виде кристаллов – для изготовления лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Сr2О3 (красный цвет), Тi2О3 и Fe2О3 (голубой цвет).
Гидроксид алюминия – А1(ОН)3 . Физические свойства:гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; молекулярная масса – 78,00, плотность – 3,97 г/см3.
Химические свойства:типичный амфотерный гидроксид реагирует:
1) с кислотами, образуя средние соли: Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2) с растворами щелочей, образуя комплексные соли – гидроксоалюминаты: Al(ОН)3 + КОН + 2Н2О = К[Al(ОН)4(Н2О)2].
При сплавлении Al(ОН)3 с сухими щелочами образуются метаалюминаты: Al(ОН)3 + КОН = КAlO2 + 2Н2О.
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
Оксид
алюминия – Al2O3. Физические свойства:
оксид
алюминия – белый аморфный порошок или
очень твердые белые кристаллы. Молекулярная
масса = 101,96, плотность – 3,97 г/см3,
температура плавления – 2053 °C, температура
кипения – 3000 °C.
Химические
свойства: оксид
алюминия проявляет амфотерные свойства
– свойства кислотных оксидов и основных
оксидов и реагирует и с кислотами, и с
основаниями. Кристаллический Аl2О3
химически пассивен, аморфный – более
активен. Взаимодействие с растворами
кислот дает средние соли алюминия, а с
растворами оснований – комплексные
соли – гидроксоалюминаты
металлов:
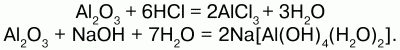
При
сплавлении оксида алюминия с твердыми
щелочами металлов образуются двойные
соли – метаалюминаты
(безводные
алюминаты):
![]()
Оксид
алюминия не взаимодействует с водой и
не растворяется в ней.
Получение:
оксид
алюминия получают методом восстановления
алюминием металлов из их оксидов: хрома,
молибдена, вольфрама, ванадия и др. –
металлотермия,
открытый Бекетовым:
![]()
Применение:
оксид
алюминия применяется для производства
алюминия, в виде порошка – для огнеупорных,
химически стойких и аб-разивных
материалов, в виде кристаллов – для
изготовления лазеров и синтетических
драгоценных камней (рубины, сапфиры и
др.), окрашенных примесями оксидов других
металлов – Сr2О3 (красный цвет), Тi2О3 и
Fe2О3 (голубой цвет).
Гидроксид
алюминия – А1(ОН)3.
Физические
свойства: гидроксид
алюминия – белый аморфный (гелеобразный)
или кристаллический. Почти не растворим
в воде; молекулярная масса – 78,00, плотность
– 3,97 г/см3.
Химические
свойства: типичный
амфотерный гидроксид реагирует:
1)
с кислотами, образуя средние соли:
Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2)
с растворами щелочей, образуя комплексные
соли – гидроксоалюминаты: Al(ОН)3 + КОН +
2Н2О = К[Al(ОН)4(Н2О)2].
При
сплавлении Al(ОН)3 с сухими щелочами
образуются метаалюминаты: Al(ОН)3 + КОН =
КAlO2 + 2Н2О.
Получение:
1)
из солей алюминия под действием раствора
щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2)
разложением нитрида алюминия водой:
AlN + 3Н2О = Аl(ОН)3 + NН3?;
3)
пропусканием СО2 через раствор
гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3
+ НСО3-;
4)
действием на соли Аl гидратом аммиака;
при комнатной температуре образуется
Аl(ОН)3.
62. Общая характеристика подгруппы хрома
Элементы
подгруппы
хрома занимают
промежуточное положение в ряду переходных
металлов. Имеют высокие температуры
плавления и кипения, свободные места
на электронных орбиталях. Элементы хром
и
молибден
обладают
нетипичной электронной структурой –
на внешней s-орбитали имеют один электрон
(как у Nb из подгруппы VB). У этих элементов
на внешних d– и s-орбиталях находится 6
электронов, поэтому все орбитали
заполнены наполовину, т. е. на каждой
находится по одному электрону. Имея
подобную электронную конфигурацию,
элемент обладает особенной стабильностью
и устойчивостью к окислению. Вольфрам
имеет
более сильную металлическая связь,
нежели молибден.
Степень окисления у элементов подгруппы
хрома сильно варьирует. В надлежащих
условиях все элементы проявляют
положительную степень окисления от 2
до 6, максимальная степень окисления
соответствует номеру группы. Не все
степени окисления у элементов стабильны,
у хрома самая стабильная – +3.
Все
элементы образуют оксид MVIO3, известны
также оксиды с низшими степенями
окисления. Все
элементы данной подгруппы амфотерны –
образуют комплексные соединения и
кислоты.
Хром,
молибден и
вольфрам
востребованы
в металлургии и электротехнике. Все
рассматриваемые металлы покрываются
пассивирующей оксидной пленкой при
хранении на воздухе или в среде
кислоты-окислителя. Удалив пленку
химическим или механическим способом,
можно повысить химическую активность
металлов.
Хром.
Элемент
получают из хромитной руды Fe(CrO2)2,
восстанавливая углем: Fe(CrO2)2 + 4C = (Fe + 2Cr)
+ 4CO?.
Чистый
хром получают восстановлением Cr2O3 с
помощью алюминия или электролиза
раствора, содержащего ионы хрома. Выделяя
хром с помощью электролиза, можно
получить хромовое покрытие, используемое
в качестве декоративных и защитных
пленок.
Из
хрома получают феррохром, применяемый
при производстве стали.
Молибден.
Получают
из сульфидной руды. Его соединения
используют при производстве стали. Сам
металл получают при восстановлении его
оксида. Прокаливая оксид молибдена с
железом, можно получить ферромолибден.
Используют для изготовления нитей и
трубок для обмотки печей и электроконтактов.
Сталь с добавлением молибдена используют
в автомобильном производстве.
Вольфрам.
Получают
из оксида, добываемого из обогащенной
руды. В качестве восстановителя используют
алюминий или водород. Получившийся
вольфрам в идее порошка впоследствии
формуют при высоком давлении и термической
обработке (порошковая металлургия). В
таком виде вольфрам используют для
изготовления нитей накаливания, добавляют
к стали.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
![]()
03.12.2015
В природе найдено 5 модификаций гидроксидов алюминия: диаспор, бемит, гиббсит, байерит, нордстрандит и 1 модификация оксида алюминия — корунд. Остальные оксиды и гидроксиды алюминия являются искусственными продуктами.
Природные гидроксиды алюминия в процессе минералообразования образуются в следующей последовательности:
алюмогель → бемит → байерит → гиббсит.
Причем скорость процесса зависит от температуры и щелочности среды и увеличивается с их повышением. В табл. 1.7 приведены основные физические свойства гидроксидов и оксидов алюминия.

Гиббсит (гидраргиллит) — гидроксид алюминия Аl(ОН)3. Это один из основных глиноземсодержащих минералов боксита, являющийся основным промежуточным продуктом в щелочных способах производства глинозема. Он кристаллизуется в моноклинной системе. Структура гиббсита построена из алюмогидроксильных слоев, которые составлены из двойных слоев гидроксильных групп с расположенным между ними слоем ионов Аl3+. Каждый ион алюминия Аl3+окружен шестью группами ОН-, образующими октаэдр. Октаэдры сочленены ребрами, образуя гексагональную сетку. Алюмогидроксильные слои связаны между собой водородными связями, являющимися в сравнении с обычными валентными менее прочными. Поэтому у кристаллов гиббсита характерный шестиугольнотаблитчатый облик и совершенная спайность по (001). Кристаллическая структура гиббситта слоистая. Каждый слой состоит из двух листов, сложенных гидроксильными ионами параллельно плоскости (001), между которыми расположен лист катионов Аl3+. Гидроксильные ионы в слое образуют несколько искаженную плотную гексагональную упаковку. В проекции на плоскость (001) получается сеть шестиугольников, образованных группами ионов ОН-. Ионы алюминия, располагаясь также по углам правильного шестиугольника, занимают центры шестиугольников, состоящих из ионов ОН- (см. рис. 1.2, а). В решетке гиббсита катионы Аl3+ занимают только две трети шестиугольников. Каждый заполненный шестиугольник представляет собой искаженный октаэдр, состав которого можно выразить формулой Аl(ОН)63-. Октаэдры объединены в кольца по шесть штук в каждом (см. рис. 1.3). Состав колец Аl6(ОН)246-, в них каждый октаэдр имеет по два общих иона ОН-с обоими соседними октаэдрами. Из совокупности колец Аl6(ОН)24в6- с общими гидроксильными ионами и построены тройные слои в решетке гиббсита.
Тройные слои сочленены так, что в каждом анион ОН- одного слоя противостоит каждому гидроксильному иону следующего слоя (см. рис. 1.2, б). Между собой тройные слои удерживаются гидроксильными связями, которые менее прочны по сравнению с обычными валентными связями.

В основной своей массе гиббсит в земной коре распространен как тонкочешуйчатый или скрытокристаллический. Гиббсит, образующийся при разложении щелочно-алюминатных растворов в процессе декомпозиции, в основном состоит из листовато-пластинчатых частиц и псевдосферолитов (см. рис. 1.4).

Гиббсит является самым устойчивым соединением алюминия в природе. Химический состав: Аl2О3 — 65,36 %, Н2О — 36,64 %. В виде изоморфных примесей встречаются до 2 % Fе2О3, а также Ga2О3— 0,006 %. Кривые нагревания гиббсита имеют 2 и 3 эндотермических эффекта в зависимости от его происхождения. Обезвоживание при термическом нагревании сопровождается перестройкой кристаллической решетки. В интервале температур от 200 до 290 °С удаляется 0,5 молекул Н2О; при 290-320 °С — 1,5 молекул Н2О и образуется соединение — бемит; при 500 °С удаляется последняя моль Н2О с кристаллизацией g-Аl2О3. Гиббсит обладает амфотерными свойствами. С большой скоростью взаимодействует и со щелочными растворами, образуя соответствующие алюминаты, и с кислыми растворами, образуя соли алюминия соответствующих кислот. Со щелочными растворами скорость реакции достаточно высока уже при 80-100 °С.
Байерит — Аl(ОН)3, кристаллизуется в моноклинной системе. Обладает малой спайностью. Вид кристалла — шестиугольные призмы, элементарная ячейка: 4Аl(ОН)3. Подобно гиббситу, байерит обладает слоистой структурой с тройными слоями. В промежуточных тройных слоях все октаэдры выродились в пустые тригональные призмы (см. рис. 1.5). Байерит отличается от гиббсита правильностью расположения гидроксилов соседних слоев. Анионы в структуре байерита образуют псевдотригональную искаженную плотнейшую упаковку. Третья часть атомов водорода располагается в октаэдрических пустотах внутри кислородных слоев, остальные занимают тетраэдрические пустоты между соседними пакетами. У байерита совершенная спайность по (001) и характерный иглообразный облик. Кристаллы байерита обычно очень мелкие (1—20 мкм), клиновидные. Назван данный минерал в честь К.И. Байера. Преимущественно данный минерал получают искусственным путем, и в бокситах он встречается крайне редко.
Данное соединение кристаллизуется при карбонизации алюминатных растворов, затем оно переходит в гиббсит. Кривая нагревания аналогична термограмме гиббсита. Байерит искусственно может быть также получен при быстром разложении алюминатного раствора. Это очень неустойчивое соединение, быстро переходящее в щелочном растворе в гиббсит, особенно при повышенной температуре.
Нордстрандит — один из политипов гиббсита, наиболее часто встречаются радиально-лучистые агрегаты. Кристаллизуется в триклинной системе, твердость — 4 ед, плотность — 2,4 г/см3. Кривая нагревания минерала аналогична термограмме природного гиббсита и отличается лишь большей интенсивностью эндоэффекта при 500—600 °C. Искусственно может быть получен при осаждении Al(OH)3 из аммиачного раствора хлористого алюминия при высоком рН и длительном старении осадка.
Алюмогель — особое место среди гидроксидов Аl занимает алюмогель — аморфная или коллоидная разновидность А1(ОН)3, кристаллическое строение которой не обнаруживается на рентгенограммах. К этой разновидности относят свежеосажденные гели гидроксида алюминия, выпадающие при нейтрализации щелочами растворов солей алюминия или кислотами алюминатных растворов. Для алюмогеля характерно отсутствие кристаллического строения, высокое содержание влаги и высокая химическая активность. Высушенный при 300—400 °С алюмогель обладает высокими адсорбционными свойствами. Алюмогель неустойчив и со временем превращается в гиббсит.
Бемит — АlООН (см. рис. 1.6), один из основных глиноземсодержащих минералов бокситов, обычно дисперсен и находится в слабокристаллической или скрытокристаллической форме. Бемит кристаллизуется в ромбической системе. Элементарная ячейка имеет состав Аl4О4(ОН)4, что соответствует 4 молекулам AlOOH. Кристаллическая структура бемита подобна структуре лепидокрокита FeOOH (см. рис. 1.7). Каждый ион Al3+ окружен шестью ионами кислорода, расположенного по вершинам искаженных октаэдров. Октаэдры связаны между собой в цепи параллельно оси а, цепи соединены друг с другом боковыми связями (через ребра октаэдров) в непрерывные двойные октаэдрические слои параллельно оси (010), т. е. перпендикулярно плоскости чертежа (в вертикальном направлении). Двойные слои соединены между собой водородными связями в виде О-Н-О-Н-О. Ионы кислорода, находящиеся внутри двойных октаэдрических слоев, связаны только с ионами алюминия. Наружные ионы кислорода связаны с ионами водорода и алюминия. Считается, что гидроксильные ионы в структуре бемита отсутствуют. Различие структуры бемита и диаспора состоит в том, что в диаспоре все атомы кислорода соединены между собой водородной связью, а в бемите только половина из них.

Теоретический химический состав минерала: Аl2O3 — 85 %, Н2O — 15 %, однако в бокситах бемит всегда содержит посторонние оксиды в пределах от 3 до 12 %, постоянными из которых являются ТіO2 и Fе2О3. Искусственно бемит может быть получен обжигом гиббсита или байерита при 330 °С или обработкой гиббсита водой или щелочным раствором при температуре выше 130 °С, а также при старении аморфного гидроксида алюминия. Растворимость данного минерала в технологическом цикле зависит от его дисперсности и особенности структуры. Тонкодисперсный и полнокристаллический бемит хорошо уже растворяется при температуре 190 °С и концентрации каустической щелочи в растворе 250—280 г/л. Бемит хорошо идентифицируется по оптическим свойствам и ИК-спектрам (vOН-3000—3500 см-1).
Диаспор — АlООН. Имеет тот же состав, что бемит. В переводе с греческого означает «рассеивание», что указывает на способность этого минерала при нагревании растрескиваться и распадаться на мелкие частички. Также является одним из основных глиноземсодержащих минералов боксита. Кристаллизуется в ромбической системе, элементарная ячейка содержит Н4Аl4O8, что соответствует 4 молекулам НАlO2. Облик кристалла пластинчатый или таблитчатый, часто встречается мелкочешуйчатая форма. Структура диаспора и проекция ее на плоскость (100) представлены на рис. 1.8 и 1.9. В плотной гексагональной упаковке ионов кислорода размещаются ионы А13+; каждый из них связан с тремя ионами О2-. Обычно считают, что ионы водорода располагаются симметрично между парами ионов кислорода (вероятные места положения протонов показаны на рис.1.9 звездочками), т. е. являются самостоятельными катионами.
Кристаллы природного диаспора обычно тонкопластинчатые, иногда игольчатые, реже таблитчатые, распространены в виде листовых или тонкочешуйчатых сростков. Для синтетического диаспора обычно характерны игольчатые кристаллы.


Химический состав: Аl2О3 — 85 %, Н2О — 15 %. Для него характерно изоморфное замещение алюминия марганцем, хромом, 3-валентным железом до 4-6 %. Кривая нагревания имеет один эндоэффект (от 400 до 650 °С). При этом происходит выделение конституционной воды, разрушение решетки диаспора и образование α-Аl2O3. Полученный в данном интервале температур α-Аl2O3 хорошо растворяется в щелочных растворах, благодаря своей дисперсности и несовершенству структуры. Получение данного минерала можно осуществить искусственным путем, выдерживая бемит в гидротермальной бомбе при 300-500 °С. Диаспор — наиболее упорный гидроксид алюминия при растворении в щелочно-алюминатных растворах. Для достижения высокой скорости взаимодействия в щелочных растворах температура должна быть не ниже 230 °С.
Оксид алюминия (Аl2О3) подразделяется по строению кристаллической решетки на α- и γ-модификации: α-Аl2O3 и у-Аl2O3. Форма α-Аl2О3, или корунд, известна с древнейших времен; она является единственной формой оксида Аl, встречающейся в природе. Природный корунд представлен как простыми (наждак), так и драгоценными разновидностями (бесцветный лейкосапфир, синий сапфир, красный рубин и др.). Искусственные рубины получают плавлением корунда в присутствии небольшого количества оксида хрома Сr2O3, а синие сапфиры получают при плавлении корунда в присутствии небольшого количества оксида титана. Получение искусственных рубинов в последнее время нашло большое применение в лазерной промышленности и других отраслях техники.
Кристаллизуется α-Аl2О3 в тригональной системе, с характерным веретено- и бочкообразным габитусом кристаллов и полным отсутствием спайности. Элементарная ячейка состоит из 4 ионов Аl3+ и 6 ионов О2-, что соответствует двум молекулам Аl2O3. Кристаллическая структура α-Аl2О3 (рис. 1.10) представлена в виде групп Аl2О3 по углам двух ромбоэдров, составляющих элементарную ячейку. Ионы О2- находятся в плотной гексагональной упаковке и расположены листами перпендикулярно тройной оси, причем листы наложены один на другой. Ионы Аl3+ расположены между двумя такими листами — шестиугольниками (с незаселенным центром) и заполняют две трети октаэдрических пустот.
Корунд оптически отрицателен, Nm = 1,767; N = 1,759. Для него характерна высокая твердость (9 по шкале Мооса), отсутствие гигроскопичности. Плотность α-Аl2О3-4 г/см3; температура плавления 2050 °С, кипения — 3400-3700 °С.
Корунд наиболее химически стоек по отношению ко многим химическим реагентам и расплавам. Он очень медленно реагирует с растворами кислот и щелочей даже при высокой температуре.
Искусственный корунд может быть получен плавкой глинозема боксита в электропечах, а также нагреванием гидроксидов Аl или γ-глинозема. Все виды гидроксидов Аl при нагревании до 1200 °С превращаются в α-Аl2O3.
Форма γ-Аl2О3 в природе неизвестна. Ее можно получить обезвоживанием гиббсита, байерита и бемита при 400—950 °С.
Кристаллизуется в кубической системе, являясь структурным аналогом шпинели (рис. 1.11). У шпинели (Ме2+Ме2в3+О4) приходится 24 иона металла. Элементарная ячейка γ-Аl2О3 содержит 32 иона кислорода, на которые приходится 21 1/3 иона металла. Это связано с тем, что у γ-Аl2О3 ион Аl3+ играет роль и Ме2+, и Ме3+ катионов. Ионы Аl3+ распределены статистически по 8 тетраэдрическим и 16 октаэдрическим положениям. Скрытокристаллический γ-Аl2О3 отличается большой дисперсностью и гигроскопичностью, особенно если был получен обезвоживанием при низких температурах (500—600 °С). На этом основано применение его для осушки воздуха, для регенерации отработанных минеральных масел и для других целей. Также подвержены колебаниям в зависимости от температурных условий получения и показатель преломления 1,63—1,69, и плотность 3,22—3,77. Нижние значения отвечают температуре 450—500 °С, а верхние — 950—1050 °С. При дальнейшем повышении температуры γ-Аl2O3 переходит в α-Аl2O3. Температура перехода γ в α зависит от природы стабилизирующего оксида. В присутствии Н2O температурный интервал превращения — 850—1050 °С; в присутствии Li2O переход осуществляется при температуре больше 1500 °С.

Модификация γ-Аl2O3 амфотерна, хорошо растворяется в кислотах и щелочах. При 490—500 °С легко взаимодействует с ИБ, образуя АlF3. Это применяется в системах сухой газоочистки при электролитическом получении Аl.
γ-Al2O3 — промежуточный продукт дегидратации всех гидроксидов алюминия, он подразделяется на следующие модификации:
— низкотемпературные. Образующиеся при t<800 °С. К ним относятся: λ; η; γ-Аl2O3 * nH2O, где 0<n<0,6.
— высокотемпературные, полученные при t≥900 °С. К ним относятся: ae, θ, δ-Al2O3
Большое влияние на структуру и температурный интервал устойчивости метастабильных фаз оказывают примеси, структура исходного материала и условия его термообработки.
Гиббсит → бемит → χ → γ → ae → θ → α-Al2O3
Байерит → бемит → η → θ → α-Al2O3
Бемит → γ-Al2O3 → δ → θ → α-Al2O3
Диаспор → α-Al2O3
На рис. 1.12 представлены температурные области устойчивости переходных форм гидроксидов и оксидов алюминия, полученные при термической обработке образцов. Процентное содержание отдельных фаз в зависимости от температуры определяется точками пересечения температурных горизонталей с пограничными кривыми областей существования смежных фаз. Показано, что термическое разложение гидроксидов алюминия, за исключением диаспора, сопровождается образованием вначале слабого кристаллического вещества, которое в дальнейшем через серию промежуточных фаз превращается в хорошо откристаллизованный корунд.

В настоящий момент можно выделить два направления во взглядах на структуру оксида алюминия. Одни исследователи считают, что существует две модификации: γ-Аl2O3 с плотной кубической упаковкой и α-Аl2O3 с гексагональной упаковкой ионов кислорода, а изменение удельной активности оксида алюминия с температурой объясняют резкой величиной удельной поверхности материала.
В ряду гидроксид-оксид алюминия различными исследователями отмечается несколько вариантов превращений при одном конечном продукте — α-Аl2O3. На рис. 1.13 показаны поля стабильности гидроксидов алюминия в зависимости от температуры и давления (по Эрвину и Осборну).

Как видно из диаграммы, поле ниже 130 °С занято гиббситом; поля между 130 °С и 385 °С при давлении ниже 140 кг/см2 занято бемитом, а при давлении выше 140 кг/см2 поле бемита простирается в температурном интервале между 130 и 300 °С. Поле устойчивости диаспора простирается только в области высоких давлений в пределах температур от 275 °С до 415 °С. Все остальное поле занято корундом. На диаграмме имеется точка пересечения трех пограничных кривых (т. А); в частности: корунд-диаспор, диаспор-бемит, бемит-корунд. В этой точке диаспор, бемит и корунд находятся в равновесии между собой и водяным паром. Давление в этой точке соответствует 140,6 кг/см2.
Для всех данных схем характерны сложность и многоступенчатость в превращениях гиббсита и бемита в отличие от диаспора. Это может быть объяснено исходными структурами гидроксидов. Одинаковый тип упаковки диаспоровой и корундовой структур позволяет им легко осуществлять этот переход. Путь же бемитовой структуры к той же равновесной корундовой лежит через ряд модификаций — от плотнейшей кубической до плотнейшей гексагональной.
- Мировые запасы бокситового сырья и темпы роста добычи бокситов
- Бокситы месторождений России и Казахстана
- Исходное алюминиевое сырье. Бокситы
- Защита металлоконструкций от огня
- Немного выросла погрузка черных металлов на РЖД
- О состоянии российского рынка труб
- Каслинские металлурги отлили скульптуры для памятника метростроевцам
- Сталелитейные компании обсудили перспективы отрасли
- 88% клиентов компании ЕВРАЗ Металл Инпром довольны её сервисом
- Газпром – главный закупщик ТБД


