Какими свойствами обладают амфотерные гидроксиды
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Анонимный вопрос · 5 марта 2019
5,0 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
Амфотерные гидроксиды — это гидроксиды, которые повторяют свойства кислот и оснований ⚗️
????К амфотерным относятся следующие гидроксиды:
????большинство гидроксидов d-элементов (хрома(III), железа, цинка, и др.);
????ряд гидроксидов p-элементов (алюминия, галлия, олова, свинца и др.);
????из гидроксидов s-элементов амфотерным является гидроксид бериллия;
????ХИМИЧЕСКИЕ СВОЙСТВА, СОВПАДАЮЩИЕ С ОСНОВАНИЯМИ
????Реагируют с кислотами
▫️Al(OH)3 + 3HCl = AlCl3 + 3H2O
????Реагируют с кислотными оксидами
▫️2Al(OH)3 + 3SiO2 = Al2(SiO3)3 + 3H2O
????ХИМИЧЕСКИЕ СВОЙСТВА, СОВПАДАЮЩИЕ С КИСЛОТАМИ
????Реагируют со щелочами
1) В растворе:
▫️Al(OH)3 + NaOH = Na[Al(OH)4]
2) При сплавлении:
▫️Al(OH)3 + NaOH = NaAlO2 + 2H2O
????Реагируют с основными оксидами
▫️2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
????Реагируют с солями
▫️2Al(OH)3 + Na2CO3 = 2NaAlO2 + CO2 + 3H2O
????Одно из общих свойств — разложение при нагревании:
▫️2Fe(OH)3 = Fe2O3 + 3H2O
Какими способами доказывается амфотерный характер соединений?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Амфотерные соединения — это вещества, которые ведут себя, как кислоты и как основания????
Возьмем Al(OH)3. Как доказать, что он амфотерный? ????
????Добавим в него кислоту HCl
Al(OH)3+3HCl=3H2O+AlCl3
Гидроксид алюминия реагирует с кислотой подобно основаниям)
????Теперь возьмём щёлочь NaOH
Al(OH)3+NaOH=Na[Al(OH)4]
Мы видим, что он реагирует основаниями, как кислоты)
Делаем вывод, что он амфотерный
Как определить растворимость кислых солей?
Есть такая таблица растворимости. Это справочный материал его выдают на ЕГЭ экзаменах и тд.
Допустим нужно определить растворимости следующих кислых солей, это соли в которых есть катион, анион и катион водорода: гидрокарбонат натрия ( сода пищевая), дигидрофосфат стронция и гидросульфат свинца. Для этого запишем их формулы и посмотрим какие у них анионы и катионы:
NaHCO3 => Na+ и HCO3-
Sr(H2PO4)2=> Sr2+ и 2H2PO4-
Pb(HSO4)2 => Pb2+ и 2HSO4-
Теперь смотрим в волшебную таблицу
Ищем катион ( это тот что с плюсиком) Na+ и потом смотрим анион( с минусом) HCO3- там стоит буква Р значит растворимо. А вот дигидрофосфат стронция, не растворим, там стоит буква Н. Со свинцом аналогично. Вообще по этой таблице можно посмотреть растворимость как и кислот ( там катион H+), так и оснований (OH-), да и вообще любых солей.
Какая структурная формула оловянистой кислоты (H2SnO2)?
ALBA synchrotron, postdoc
Sn(OH)2 в свободном виде не существует. Бывает либо гель гидрата неопределённого состава, либо оксогидроксид Sn6O4(OH)4. Он состоит из кластеров состава Sn6O8, соединенных между собой водородными связями (на картинке не показаны).
Как перевести гидроксильное число в количество гидроксильных групп?
Researcher, Institute of Physics, University of Tartu
При ацилировании чего-то с гидроксильными группами уксусным ангидридом получается, что сколько гидроксильных групп (в молях), столько и уксусной кислоты (в молях):
(CH3O)2O + HOR = (CH3O)OR + CH3COOH
Потом на нейтрализацию этого количества уксусной кислоты (в молях) пойдет равное количество КОН (в молях). То есть, количество гидроксильных групп (в молях) равно количеству КОН (в молях).
Проблема только в том, что гидроксильным числом называется количество КОН в миллиграммах, а не в молях, которое пошло на нейтрализацию уксусной кислоты, образовавшийся после ацилирования 1 грамма исследуемого вещества избытком ангидрида. То есть нужно взять молярную массу КОН (40.1 г/моль) и поделить количество КОН в миллиграммах на 1000 и на молярную массу КОН. Результатом будет количество КОН в молях, которое равно количеству гидроксильных групп (в молях) в 1 грамме исходном веществе.
Для определения количества гидроксильных групп в молекуле исходного вещества нужно теперь узнать количество моль этого вещества в 1 грамме. Для этого нужно взять молярную массу этого вещества и поделить 1 грамм на эту молярную массу.
Таким образом, узнать из гидроксильного числа количество ОН групп в молекуле исследуемого вещества можно только зная молярную массу этого исследуемого вещества. Если не знать молярную массу, то можно только определить количество штук ОН-групп в 1 грамме вещества.
Что такое MgOHCl? Как можно получить это вещество?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????MgOHCl????
✅гидроксохлорид магния
✅это основная соль,так как имеет в своём составе ОН — группу
✅получение :
Mg(OH)2+HCl➡️MgOHCl+H2O
✅Основные соли являются продуктом неполного замещения гидроксидных групп на кислотный остаток
Основания, их классификация, свойства, получение
Основания — это сложные вещества, при диссоциации которых образуются ионы металла или аммония и гидроксид-ионы ОН-. NaOH <=> Na+ + ОН- | Основания — это вещества, принимающие протоны. NH3 + H+ = NH4+ |
1. Какие из перечисленных веществ относятся к основаниям: LiOH, CH3COOH, Fe(OH)2, CH3NH2, H2SO3, Mg(OH)2?
Классификация оснований
Признаки классификации | Группы оснований | Примеры |
1. Природа веществ | Неорганические | NaOH гидроксид натрия |
Органические | CH3NH2 метиламин | |
2. Состав веществ (наличие кислорода) | Бескислородные | NH3 -аммиак |
Кислородсодержащие | Cu(OH)2 -гидроксид меди (II) | |
3. Кислотность оснований (по числу гидроксильных групп) | Однокислотные | KOH — гидроксид калия |
Двухкислотные | Ca(OH)2 — гидроксид кальция | |
4. Степень электролитической диссоциации | Слабые | Fe(OH)2 — гидроксид железа (II) |
Сильные (щелочи) | NaOH гидроксид натрия | |
5. Растворимость в воде | Растворимые (щелочи) | NaOH гидроксид натрия |
Нерастворимые | Cu(OH)2 -гидроксид меди (II) | |
6. Летучесть | Летучие | NH3 -аммиак |
Нелетучие | Cu(OH)2 -гидроксид меди (II) | |
7. Устойчивость к нагреванию | Устойчивые | KOH — гидроксид калия |
Неустойчивые | Cu(OH)2 -гидроксид меди (II) |
2. Охарактеризуйте гидроксид кальция Сa(OH)2 по всем признакам классификации.
ПОЛУЧЕНИЕ
Получение растворимых оснований (щелочей) | Получение нерастворимых оснований |
1. Реакцией обмена (если один из продуктов выпадает в осадок): Na2SO4 + Вa(OH)2 = ВaSO4↓ + 2NaOH | Нерастворимые основания получают реакцией обмена между раствором соли и раствором щелочи: CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaCl |
2. Растворимые основания (щелочи) можно получить взаимодействием щелочного и щелочно-земельного металла или их оксидов с водой: CaO + H2O = Ca(OH)2 | |
3. Электролизом водного раствора соли хлоридов щелочных металлов (в качестве побочного продукта образуется хлор): 2NaCl + 2H2O = 2NaOH + H2 + Cl2 (действием электрического тока) |
3. Даны вещества: Fe(OH)2, Ca(OH)2, LiOH, Al(OH)3. Какие вещества образуются при взаимодействии металлов с водой, а какие — действием щелочи на раствор соли?
Химические свойства оснований
1. Диссоциация оснований с образованием гидроксид-ионов ОН-:
NaOH <=> Na+ + OH-
LiOH <=> Li+ + OH-
Наличие гидроксид-ионов в растворе щелочи можно определить при помощи кислотно-основных индикаторов.
2. Взаимодействие с кислотами с образованием соли (реакция нейтрализации):
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
3. Взаимодействие щелочей с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 = Na2SiO3 + H2O (при нагревании)
Ca(OH)2 + CO2 = CaCO3↓ + H2O
4. Взаимодействие раствора щелочи с растворами различных солей с образованием нерастворимого основания:
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
Cu2+ + 2OH- = Cu(OH)2 ↓
5. Разложение нерастворимых оснований при нагревании с образованием оксида металла и воды:
Cu(OH)2 = CuO + H2O (при нагревании)
6. Взаимодействие растворов щелочи с некоторыми неметаллами:
2NaOH + Cl2 = NaCl + NaClO + H2O (на холоде)
6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H2O (при нагревании)
2NaOH + Si = Na2SiO3 + 2H2
Взаимодействие щелочи с некоторыми металлами (образующие амфотерные соединения).
??? 4. Даны вещества: CaO, SO2, Ba(OH)2, HClO4, KCl, CuCl2.
а) Какие из перечисленных веществ реагируют с гидроксидом натрия?
б) Напишите уравнения возможных реакций.
в) Какая из приведенных реакций относится к реакции нейтрализации?
5. Какие вещества разлагаются при нагревании: Fe(OH)2, NaOH, Al(OH)3, Fe(OH)3, Ba(OH)2? Напишите уравнения возможных реакций.
6.
В трех пробирках даны растворы хлорида натрия, соляной кислоты,
гидроксида натрия. Как можно распознать эти растворы химическим
способом?
7.
Какая масса щелочи NaOH должна находиться в растворе для реакции с 16 г
сульфата меди (II), чтобы получить осадок гидроксида меди(II)?
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды, которые при диссоциации образуют одновременно и катионы Н+, и гидроксид-ионы ОН-.
Амфотерные гидроксиды соответствуют амфотерным оксидам. Например, Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2 и другие.
1) Взаимодействие амфотерных гидроксидов с кислотами:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
2) Взаимодействие амфотерных гидроксидов со щелочью:
Al(OН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Zn(OН)2 + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
3) Проявляют свойства нерастворимых оснований — разлагаются при нагревании с образованием оксида и воды:
2Al(OH)3 → Al2O3 + 3H2O
??? 8. а) Приведите примеры реакций, доказывающие свойства гидроксида цинка.
б) В какой из приведенных реакций гидроксид цинка проявляется себя как кислота?
в) В какой из приведенных реакций гидроксид цинка проявляется себя как основание?
г) Напишите уравнение реакции получения гидроксида цинка.
Ответы на вопросы, которые вы встретили в конспекте, вы можете отправить в отдельное задание.
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
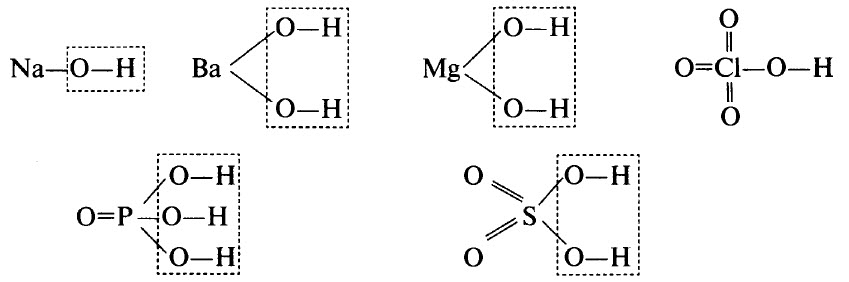
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
