Какими свойствами обладает сахароза

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 апреля 2019;
проверки требуют 8 правок.
Эта статья — о химическом веществе. О пищевом продукте см. Сахар.
| Сахароза | |
|---|---|
| Систематическое наименование | (2R,3R,4S,5S,6R)-2-[(2S,3S,4S,5R)-3,4-дигидрокси-2,5-бис(гидроксиметил)оксолан-2-ил]окси-6-(гидроксиметил)оксан-3,4,5-триол |
| Сокращения | α-D-глюкопиранозил-(1,2)-β-D-фруктофуранозид |
| Традиционные названия | свекловичный сахар, тростниковый сахар |
| Хим. формула | C12H22O11 |
| Состояние | Твёрдое, кристаллическое |
| Молярная масса | 342,2965 ± 0,0144 г/моль |
| Плотность | 1,587 г/см³ |
| Температура | |
| • плавления | 186 °C |
| • разложения | 367 ± 1 °F[1] и 320 ± 1 °F[1] |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 211,5 г/100 мл |
| Рег. номер CAS | 57-50-1 |
| PubChem | 5988 |
| Рег. номер EINECS | 200-334-9 |
| SMILES | OC1C(OC(CO)C(O)C1O) |
| InChI | 1S/C12H22O11/c13-1-4-6(16)8(18)9(19)11(21-4)23-12(3-15)10(20)7(17)5(2-14)22-12/h4-11,13-20H,1-3H2/t4-,5-,6-,7-,8+,9-,10+,11-,12+/m1/s1 CZMRCDWAGMRECN-UGDNZRGBSA-N |
| RTECS | WN6500000 |
| ChEBI | 17992 |
| ChemSpider | 5768 |
| NFPA 704 | 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
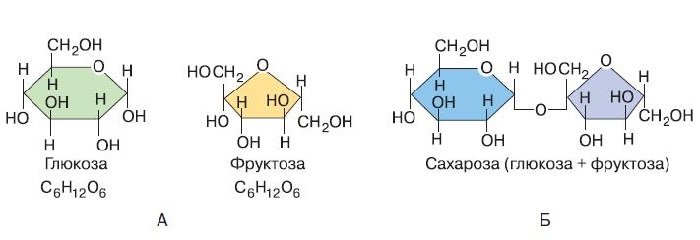
Сахаро́за (сукро́за, тростниковый сахар) C12H22O11, в быту просто сахар, — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы.
Сахароза является весьма распространённым в природе дисахаридом. Она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
Сахароза, попадая в кишечник, быстро гидролизуется альфа-глюкозидазой тонкой кишки на глюкозу и фруктозу, которые затем всасываются в кровь. Ингибиторы альфа-глюкозидазы, такие, как акарбоза, тормозят расщепление и всасывание сахарозы, а также и других углеводов, гидролизуемых альфа-глюкозидазой, в частности, крахмала. Это используется в лечении сахарного диабета 2-го типа[2].
Физические свойства[править | править код]
В чистом виде — бесцветные моноклинные кристаллы. При застывании расплавленной сахарозы образуется аморфная прозрачная масса — карамель. Сахароза имеет высокую растворимость. Растворимость (в граммах на 100 грамм растворителя): в воде 179 (0 °C) и 487 (100 °C), в этаноле 0,9 (20 °C). Малорастворима в метаноле. Не растворима в диэтиловом эфире. Плотность 1,5879 г/см3 (15 °C). Удельное вращение для D-линии натрия: 66,53 (вода; 35 г/100г; 20 °C). Температура плавления 186℃.
Химические свойства[править | править код]
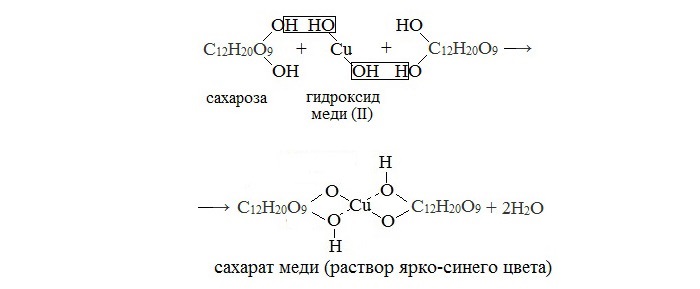
Не проявляет восстанавливающих свойств — не реагирует с реактивами Толленса, Фелинга и Бенедикта. Не образует открытую форму, поэтому не проявляет свойств альдегидов и кетонов. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди(II), образуется ярко-синий раствор сахарата меди. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра(I) она не дает реакцию «серебряного зеркала», при нагревании с гидроксидом меди(II) не образует красного оксида меди(I). Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
Реакция сахарозы с водой[править | править код]
Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор, то появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди(II) до оксида меди(I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
Реакция сахарозы с гидроксидом меди(II)[править | править код]
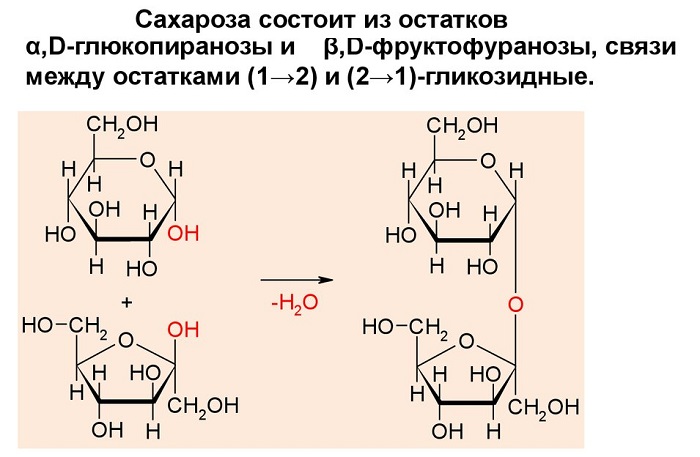
Поскольку связь между остатками моносахаридов в сахарозе образована засчет обоих гликозидных гидроксилов, это вещество не обладает восстановительными свойствами. При добавлении раствора сахарозы к осадку гидроксида меди (II) он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди (II) до оксида меди (I).
Природные и антропогенные источники[править | править код]
Содержится в сахарном тростнике, сахарной свёкле (до 28 % сухого вещества), соках растений и плодах (например, берёзы, клёна, дыни и моркови).
Источник получения сахарозы — из свёклы или из тростника, определяют по соотношению содержания стабильных изотопов углерода 12C и 13C. Сахарная свёкла имеет C3-механизм усвоения углекислого газа (через фосфоглицериновую кислоту) и предпочтительно поглощает изотоп 12C; сахарный тростник имеет C4-механизм поглощения углекислого газа (через щавелевоуксусную кислоту) и предпочтительно поглощает изотоп 13C.
Мировое производство в 1990 году — 110 000 000 тонн.
Галерея[править | править код]
Статичное 3D-изображение
молекулы сахарозыКристаллы коричневого
(нерафинированного тростникового) сахара
Примечания[править | править код]
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11.
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Сахароза. Строение
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
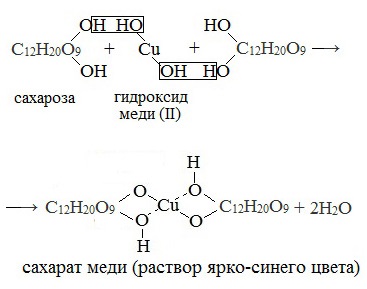
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»![]()
Реакция с гидроксидом меди (II)![]()
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
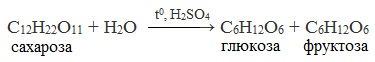
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):

Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
Получение сахарозы
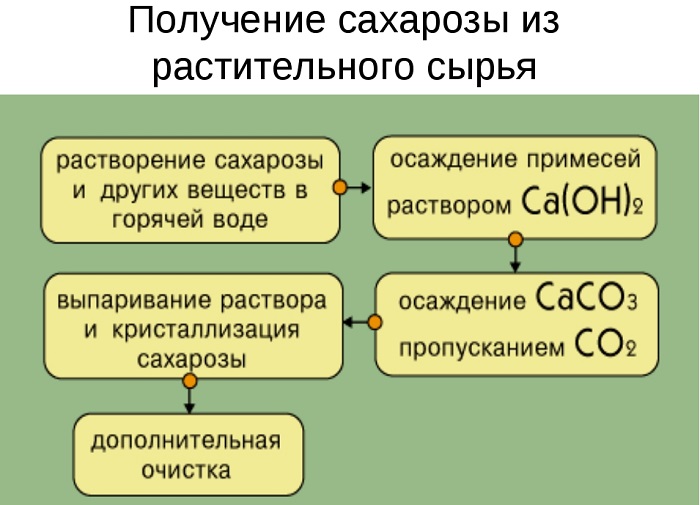
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.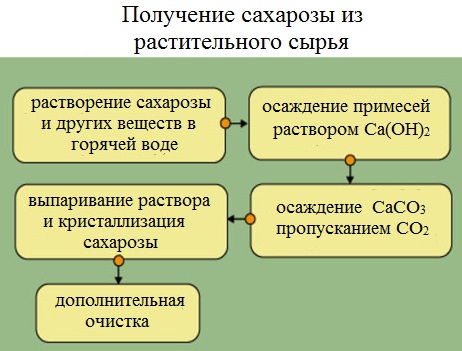
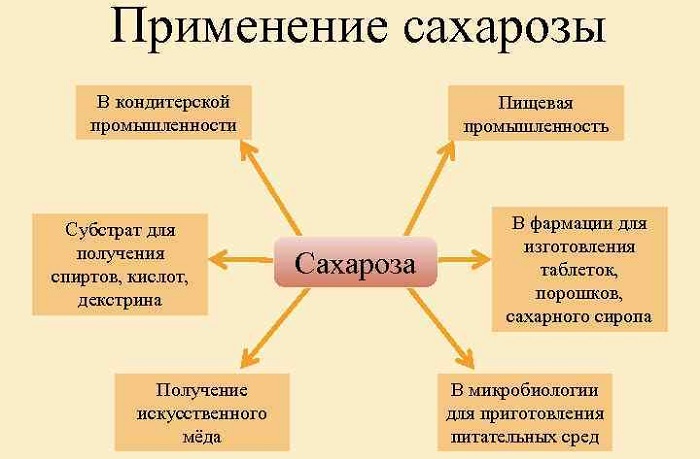
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Углеводы
Олигосахариды. Дисахариды
Сахароза — органическое вещество с кристаллической решеткой. Другое название — сахар. Это дисахарид, образованный остатками двух моносахаридов — фруктозы и глюкозы.
Узнаем больше о сахарозе, ее строении, формуле, физических и химических свойствах и о том, какую пользу играет она для живых организмов.
Формула и строение сахарозы
Структурная формула — C12H22O11, хотя она происходит от соединения двух простых сахаров, таких как глюкоза и фруктоза.
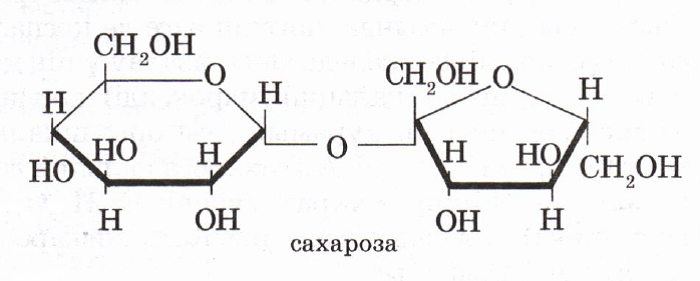
Два кольца этих сахаров объединены отдельным атомом кислорода, соединенным с двумя атомами углерода в цепочке. Другое расширение атома в молекуле также присутствует, главным образом, в комбинациях кислорода и водорода.
Связь между моносахаридами имеет O-глюкозидный тип. Кроме того, эта связь является дикарбонильной.
Физические свойства
По своим физическим свойствам она обладает сладким вкусом, может кристаллизоваться и растворима в воде.
Когда сахароза достигает желудка, она подвергается кислотному гидролизу и разлагается на части: на глюкозу и фруктозу. Остальная часть сахарозы переходит в тонкий кишечник, где ферментная сахароза преобразует ее в глюкозу и фруктозу.
Подчеркиваются ее специфические свойства в качестве питательного вещества для организма человека: она легко усваивается и не выделяет токсичных веществ. Это означает, что сахароза обладает как свойствами глюкозы, так и свойствами фруктозы, что означает, что она является источником энергии для организма.

Существует множество противоречий по поводу вреда, наносимого потреблением сахарозы, и несколько теорий по этому поводу. Основные дебаты сосредоточены на развитии кариеса, диабета, ожирения, атеросклероза и других патологий.
Интересно, что сахароза является триболюминесцентной, производящей свет механическим действием.
Благодаря низкой температуре плавления 1860С она очень быстро становится жидкой, очень легко прилипает к контейнеру, в котором она находится, может запросто обжечь кожу, если не соблюдать меры безопасности. Температура кипения раствора равна 101,40С.
Основные свойства описаны в таблице:
Физические свойства сахарозы | |
Молярная масса | 342,3 г/моль |
Температура плавления | 1860С |
Растворимость | 211,5 г / 100 мл |
Плотность | 1,587 г/см3 |
Химические свойства
В молекуле сахарозы есть гидроксильные группы. Рассмотрим основные уравнения химических реакций сахарозы.
Реакция гидролиза
Сахароза способна подвергаться гидролизу, во время которого она распадается на моносахариды (глюкозу и фруктозу):
C12H22O11
+ H2O → C6H12O6
+ C6H12O6.
Реакции окисления
Дисахариды, которые сохраняют полуацетальный гидроксил, называются восстанавливающими. Дисахариды без полуацетального гидроксила называются невосстанавлиающими. Сахароза не является альдегидом.
Пример каталитического окисления сахарозы кислородом воздуха:
C12H22O11
+ 12 O2 → 12 CO2 + 11 H2O.
Качественная реакция с гидроксидом меди
Как провести лабораторный опыт:
лабораторное оборудование: пробирка, горелка;
реагенты: водный раствор сахарозы, гидроксид меди (II);
действия: залейте раствор сахарозы в пробирку, добавьте гидроксид меди (II), разогрейте пробирку над горелкой:
C12H22O11
+ 2 Cu (OH)2 → ярко-синее окрашивание;
Замечания: синий осадок не изменил цвет, несмотря на подачу энергии в виде тепла;
Вывод: сахароза не обладает восстановительными свойствами.
Нахождение сахарозы в природе
Она обычно извлекается из сахарного тростника, свеклы или кукурузы.

Сахарный тростник
Другими коммерческими (незначительными) источниками являются сладкий сорго и кленовый сироп.
Получение сахарозы
Сахароза извлекается из сырья, в котором она содержится, а затем очищается и кристаллизуется.
Применение и биологическая роль сахарозы
Широкое применение сахарозы обусловлено ее способностью к подслащению и свойствами функциональной консистенции. По этой причине она важна для структуры некоторых продуктов питания, особенно кондитерских изделий.
Также является вспомогательным компонентом в сохранении пищи, будучи добавкой, широко используемой в приготовлении так называемой нездоровой пищи.
В проросших семенах растений жиры и белки, находящиеся на хранении, превращаются в сахарозу для транспортировки в процессе развития растений.
Главная функция сахарозы в организме человека — она помогает вырабатывать энергию, необходимую для функционирования различных органов.
Сахароза — это просто сахар из сахарницы. Белые кристаллы, используемые для подслащивания. Узнай где содержится и каков риск чрезмерного потребления.
Сахароза — что это?
С химической точки зрения сахароза представляет собой дисахарид, состоящий из одной молекулы глюкозы и одной фруктозы, связанной так называемой гликозидной связью. Из-за сырья, из которого она получена, также называют свекольным или тростниковым сахаром. В обычном повседневном смысле сахароза — это просто сахар или белые кристаллы, которые вы добавляете в чай.

Это соединение обычно используется для подслащивания сладостей, напитков, тортов. В природе она встречается преимущественно в плодах.
На упаковке пищевых продуктов сахароза отмечена в таблице питания как простой сахар вместе с другими соединениями, которые относятся к этой группе.
Свойства, пищевая ценность и калорийность сахарозы
Сахароза имеет форму белых кристаллов, которые очень хорошо растворяются в воде. Очищенный белый сахар массой 100 г содержит 99,8 г чистой сахарозы.
Коричневый сахар, полученный из сахарного тростника, менее очищен. По этой причине он содержит небольшое количество витаминов из группы B, однако, его пищевая ценность незначительно выше вопреки распространенному мнению.
- Одна чайная ложка белого сахара содержит 20 ккал
- 1 столовая ложка белого сахара содержит 49 ккал
Подумайте, стоит ли подсластить чай? Сахароза добавляется в напитки и другие блюда, но это пустые калории. Посмотрите, что происходит, когда вы пьете 2 чая каждый день, подслащенные 2 чайными ложками сахара.
- 2 чайные ложки сахара — 40 ккал.
- 2 чая с 2 чайными ложками сахара дают в общей сложности 80 ккал.
- В течение месяца вы едите дополнительно 2400 ккал.
- Вы получите килограмм в жировой ткани, если съедите на 7000 ккал больше, чем нужно.
- Выпивая столько же чая, через 3 месяца получите лишний килограмм при взвешивании!
Подумайте об обратном процессе сейчас. Что произойдет, если вы перестанете подслащивать или уменьшите количество сахара вдвое? Если вы добавите ограничение к употреблению сладостей и газированных напитков, эффект может быть потрясающим, даже если вы ничего не измените в диете! Вы похудеете без каких-либо усилий!
Применение и возникновение сахарозы
Сахароза в природе встречается главным образом во фруктах, хотя доминирующим фруктовым сахаром является фруктоза. Вам не нужно бояться простого сахара в свежих фруктах.
Самыми богатыми сахарозой являются:
- финики,
- манго,
- ананас,
- абрикосы,
- нектарины,
- персики,
- дыня.
Это соединение используется в пищевой промышленности для подслащивания не только продуктов из группы сладостей и газированных напитков. Следующее продукты также подслащены сахарозой:
- фруктовые йогурты,
- сухие завтраки,
- сиропы от кашля,
- подслащенные сухофрукты,
- консервированные фрукты,
- джемы, варенье и повидло.
В последнем случае сахар также является консервантом, который ограничивает развитие микроорганизмов, ответственных за порчу продукта. Большое количество сахарозы также содержит кленовый сироп и патока.
Вредна ли сахароза?
Человеку не нужна сахароза для жизни, кроме той, которую он ест в свежих фруктах. Её избыток очень вреден для здоровья. По этой причине сахар следует максимально ограничить. Большое количество сахара способствует:
- ожирению,
- резистентности к инсулину и диабету II типа,
- болезням сердца,
- разрушению зубов,
- остеопорозу,
- расстройствам кишечной микрофлоры,
- ускоренному старению кожи,
- эректильной дисфункции,
- перепадам настроения.
Согласно стандартам, добавленный сахар может составлять максимум 10% от суточной потребности в калориях, но эксперты подчеркивают, что это количество должно быть ограничено 5%. Это означает, что если вы потребляете 2000 ккал в день, вы можете съесть только 5 чайных ложек сахара из всех продуктов, которые его обеспечивают. А не только сахар из сахарницы!
Чем заменить белый сахар?
Если у вас есть проблема с отказом от подслащивания, замените столовый сахар на ксилит или эритрит. Оба соединения — это так называемые безопасные для человека сахарные спирты. Ксилит содержит 40% калорийного сахара, а эритрит совсем не дает калорий. Оба соединения выглядят и на вкус точно такие же, как сахароза.
Единственная разница — это легкое чувство холода на языке, которое остается после еды. Вы также можете использовать их для выпечки. Ксилит, употребляемый в чрезмерных количествах, может вызвать слабительный эффект, поэтому стоит сочетать использование обоих соединений на домашней кухне.
