Какими свойствами обладает метанол
Метанол это химическое вещество, называемое древесным или метиловым спиртом. Его получение не является сложным, поскольку он относится к одноатомным продуктам. Использование в алкогольных напитках может привести к пищевому отравлению. Он также может образовывать взрывоопасные смеси при температуре 8 градусов по Цельсию.
Чтобы правильно понимать суть происходящего, стоит обратить внимание на название вещества. В его составе 4 атома водорода и по одному атому углерода и кислорода.
Молекулярная формула выглядит так — CH3OH.
Плотность находится на отметке 0,8101 г/см3.
Структура отображается в таблице следующим образом:
Название вещества | Число атомов | Процент содержания массы | Молярный вес каждого по отдельности |
O2 — кислород | 1 | 49,9% | 16 |
H2 — водород | 4 | 37,5% | 1,008 |
С — углерод | 1 | 12,6% | 12,011 |
История открытия
Впервые это вещество обнаружил Роберт Бойль. В 1661 г. он успешно завершил первую сухую перегонку древесины. В чистом виде метанол получилось выделить только через 170 лет.
В 1834 г. два французских химика установили его химическую формулу. А еще через 23 года впервые получили через омыление метилхлорида.
Промышленность занимается его выпуском в крупных масштабах. Причем способов для этого довольно много. Одним из самых востребованных является синтезирование метана.
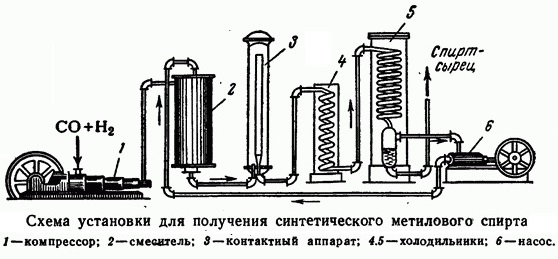
Процесс реакции связан с неполным окислением и образованием формы эфира. Еще один способ, разрешенный стандартами ГОСТ, связан с разложением солевых отложений муравьиной кислоты.
Применение метилового спирта
Органическая химия использует его как растворитель. Нефтегазовая и техническая промышленность с его помощью предотвращает появление кристаллических соединений. Это связано с низкой температурой порога замерзания.
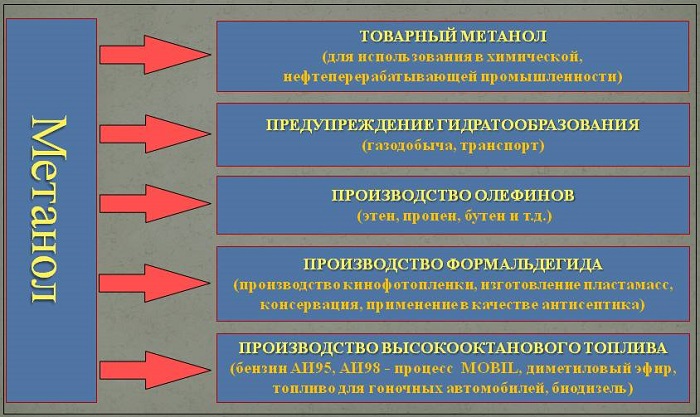
В домашних условиях синтез подразумевает окрашивание с помощью лакокрасочных продуктов. Ведь их получение и начальная консистенция зависит от нескольких составляющих.
Насчет суррогатного алкоголя стоит понять одну простую вещь. При попадании в организм, вред неизбежен и необратим вообще. Вероятность отравления и смертельного исходя очень высока.
Физические свойства
По сути, метанол это бесцветная жидкость. Теплопроводные свойства древесного спирта в два раза меньше, чем у бензина. Участвует в образовании взрывоопасных веществ из-за собственной горючести. Температура кипения метанола 64,70С.

Температура горения начинается от 460 градусов. Смешивается с различными жидкостями без каких-либо проблем. Таким способом получения добиваются образования веществ на жидкой основе, не содержащих алифатические углеводы. Азеотропные смеси появляются после тщательного смешивания с ацетоном или дихлорэтаном. Очень токсичен.
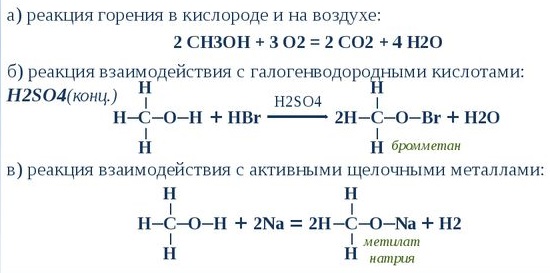
Химические свойства и реакции
Как и горючие смеси, метанол имеет собственное октановое число, даже в газообразном состоянии. Оно равняется 111 единицам, что допускает использование в двигателях внутреннего сгорания. Причем это получается даже в состоянии метилового спирта.

Также возможен вариант замены водорода щелочными металлами. Сложные эфиры получаются при взаимодействии с карбоновыми кислотами или минеральными. Положительно реагирует на галогениды фосфора.
Нахождение в природе
Очень редко такое вещество можно обнаружить в свободном состоянии. Даже если удается случайно наткнуться, то количество будет крайне мало. Зато компоненты для производства находятся практически везде. Это растительные масла, различные породы деревьев, почвы и даже минералов.
Класс опасности древесного спирта
Для человека даже 10 мг уже смертельное отравление. А поскольку одним из результатов станет получение слепоты, то класс опасности (по ГОСТ 12.1.007-76) — 3. Не важно, жидкое состояние или газообразное. Классификационный код FT1, вторая группа упаковок.
Влияние на человеческий организм
Патологические изменения наступают после превышения допустимой нормы. Но слепота это только начало. Дальнейшие действия приведут к поражению участков головного мозга, полному нарушению работы мочевыводящих органов.
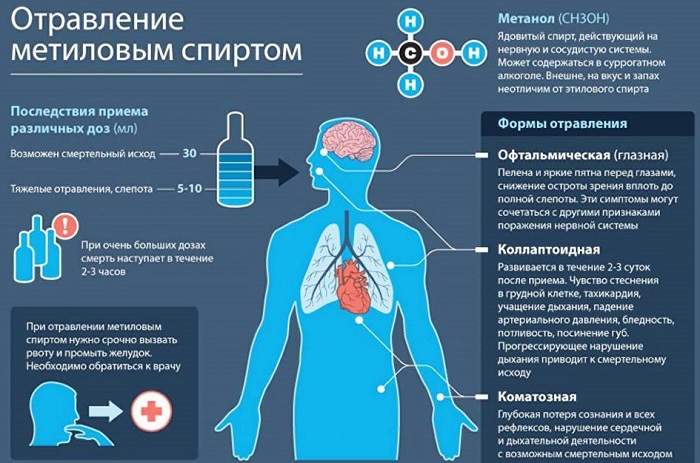
Моментальная смерть наступает при содержании в организме до 2 граммов на каждый килограмм веса. Это вызвано тем, что одноатомный спирт окисляется до яда формальдегид, который применялся раньше в качестве бесшумного убийцы. Он сразу парализует нервную систему и воздействует на белковые соединения. При этом токсический эффект появляется только через несколько часов.
Заключение
В высокоразвитых странах метанол добавляют в топливо для автомобилей. Ведь благодаря его свойствам и взаимодействию с горючими веществами, получается экологически чистый продукт. В Российской Федерации использование в качестве товаров для потребителей запрещено по закону. Очень много случаев отравления с летальным исходом.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объёмная и массовая энергоёмкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей, работающих на метаноле с более высоким октановым числом, чем бензин, имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
Отдельно следует отметить увеличение индикаторного КПД при работе классического ДВС на метаноле по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха с топливом | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Недостатки
- Метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС. Это относится в основном к метанолу-сырцу, содержащему значительные количества примесей муравьиной кислоты и формальдегида. Технически чистый метанол, содержащий воду, начинает реагировать с алюминием при температуре выше 50 °C, а с обычной углеродистой сталью не реагирует вовсе.
- Гидрофильность. Метанол втягивает воду, что является причиной расслоения топливных смесей бензин-метанол.
- Метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например, плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- Уменьшенная летучесть при холодной погоде: моторы, работающие на чистом метаноле, могут иметь проблемы с запуском при температуре ниже +10 °C и отличаться повышенным расходом топлива до достижения рабочей температуры. Данная проблема однако, легко решается добавлением в метанол 10—25 % бензина.
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование «метакол» (methacoal). Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоемкость. С экологической точки зрения такое топливо имеет меньший «углеродный след», чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.

Свойства метанола и его реакции
Метанол — бесцветная жидкость с алкогольным запахом (запах этилового спирта). Температура кипения +64,7 °C.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4∙7H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой. Температура кипения водных растворов метанола:
| Молярная доля метанола % | Т кип. °C, 760 мм. рт. ст. |
|---|---|
| 0 | 100 |
| 5 | 92,8 |
| 10 | 88,3 |
| 15 | 84,8 |
| 20 | 82 |
| 25 | 80,1 |
| 30 | 78,2 |
| 35 | 76,8 |
| 40 | 75,6 |
| 45 | 74,5 |
| 50 | 73,5 |
| 55 | 72,4 |
| 60 | 71,6 |
| 65 | 70,7 |
| 70 | 69,8 |
| 75 | 68,9 |
| 80 | 68 |
| 85 | 67,1 |
| 90 | 66,3 |
| 95 | 65,4 |
| 100 | 64,6 |
Метанол дает со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2CH3OH; LiCl ∙ 3CH3OH; MgCl2 ∙ 6CH3OH; CaCl2 ∙ 4CH3OH представляет собой шестисторонние кристаллы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение BaO ∙ 2CH3OH ∙ 2H2O получается в виде блестящих призм при растворении BaO в водном метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6CH3OH; 3KOH ∙ 5CH3OH (Геттиг). При действии металлических калия и натрия легко даёт алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накалённую трубку получается C2H2 и другие продукты (Бертло). При пропускании паров метанола над накалённым цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2CH3OH+O2=2HCHO+2H2O. При действии хлористого цинка и высокой температуры метанол даёт воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырём в запаянной трубке до 300°, даёт моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно формиат, ацетат и, наконец, карбонат калия.
Концентрированная серная кислота даёт метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с метанолом даёт метиловый эфир. При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы даёт хлористый метил CH3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол даёт CO2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль CH2(OCH3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
Нахождение в природе
В свободном состоянии метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты C6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты C6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5—3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип. 56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
Токсичность

Метанол — опаснейший яд, приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению (одно из последствий — слепота), попадание в организм более 80-150 миллилитров метанола (1-2 миллилитра чистого метанола на килограмм тела) обычно смертельно. LD50 для животных — от единиц до десятка г/кг. Токсический эффект метанола развивается на протяжении нескольких часов, и эффективные антидоты способны уменьшить наносимый вред. Опасен для жизни не только чистый метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
В США максимальное допустимое суточное употребление метанола (референтная доза), подразумевая несвязанное с какими-либо эффектами на здоровье, установлено в размере 2 мг на кг веса тела (с 1988 года).
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м³ (у изопропилового спирта 10 мг/м³, у этанола — 1000 мг/м³), ПДК в воздухе населенных мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³).
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой.
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида, который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками. Происходит так называемый летальный синтез.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. Йодоформная реакция: с этиловым спиртом выпадет йодоформ жёлтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола).
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола.
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление 1,2-дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно.
Отравления метанолом довольно часты. Так, в США в течение 2013 года зафиксировано 1747 случаев.
Массовые отравления метанолом
Известно множество массовых отравлений метанолом. Источником метанола могут быть фальсифицированные незамерзающие жидкости для автомобилей, контрафактный алкоголь, метанол, выдаваемый за этиловый спирт.
- Массовое отравление метанолом в Испании в начале 1963 года; официальное число погибших 51 человек, однако существуют оценки в диапазоне от 1000 до 5000 человек.
- Массовое отравление метанолом в Бангалоре (Индия) в июле 1981 года. Число погибших — 308 человек.
- Массовое отравление вином с добавкой метанола в Италии весной 1986 года; погибли 23 человека.
- Массовое отравление метанолом в Сальвадоре в октябре 2000 года вызвало смерть 122 человек. Власти подозревали теракт, поскольку в спиртных напитках на заводах-производителях метанол при расследовании инцидента не был выявлен.
- Массовое отравление метанолом 9—10 сентября 2001 года в городе Пярну (Эстония); 68 человек погибли.
- Массовое отравление метанолом в Чехии, Польше и Словакии в сентябре 2012 года; 51 человек погиб.
- Массовое отравление метанолом 17-20 декабря 2016 года в Иркутске (Россия). Число погибших — 78 человек.
Спирты | |
|---|---|
| (0°) | Метанол |
| Первичные спирты (1°) | Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол · Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) | трет-Бутанол · 2-Метилбутан-2-ол |
Основные виды органического топлива | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ископаемое |
| ||||||||
| Возобновляемое и биологическое |
| ||||||||
| Искусственное |
| ||||||||
