Какими свойствами характеризуется ковалентная связь
Ковалентная связь — химическая связь, образованная обобществлением пары валентных электронных облаков. Обеспечивающие связь электроны называются общей электронной парой.
Св-ва ковалентной связи: направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Ионная связь.
Ионный тип связи возможен только между атомами, которые резко отличаются по свойствам. Резкое отличие в свойствах элементов приводит к тому, что атом металла полностью теряет свои валентные электроны, а атом неметалла присоединяет их. образовавшиеся положительно и отрицательно заряженный ионы в молекулах и кристаллической решетки силами электростатического притяжения. Такая связь называется ионной.
Пример образование молекулы NaCL в газовой фазе.
Неспецифические виды связи.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов иинтерметаллических соединений.
Механизм металлической связи: Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Другие свойства: Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами.
Дата добавления: 2016-11-12; просмотров: 5509 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
1. Насыщаемость— способность атомов образовывать ограниченное число ковалентных связей. Например, нельзя присоединить еще один атом водорода к молекуле H2 или HCl так как спин электрона водорода окажется параллельным спину одного из электронов в связующей электронной паре и будет происходить отталкивание водорода. Благодаря насыщаемости связей молекулы имеют определенный состав: H2, а не H3; HCl, а не H2Cl и т.д.
2. Направленностьковалентной связи определяет пространственную структуру молекул. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах.
Рассмотрим это на примере образования HCl. Как известно, ковалентная связь возникает в направлении максимального перекрывания электронных облаков (орбиталей) вдоль линии взаимодействующих атомов: (рис. 3). При образовании молекулы HCl происходит перекрывание s— орбитали атома водорода с р-орбиталью атома хлора и молекула имеет линейную форму.
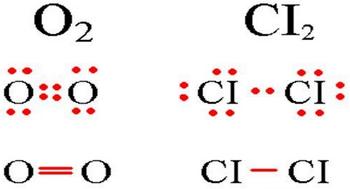
3.Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, например, Н — Н, О = О, Cl — Cl, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома и в этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность (ЭО). Чем выше ЭО у атома, тем вероятнее смещение электронной пары в сторону ядра этого атома.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома, и атом получает заряд, называемый эффективным зарядом атома δ‾. У второго атома повышается плотность положительного заряда δ+. Вследствие этого возникает диполь, представляющий собой нейтральную частицу с одинаковыми по величине положительными и отрицательными зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя μсв, равный произведению эффективного заряда на длину диполя:
Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный,дативный.
· При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном.
· По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов.
· Атомы, внешняя электронная оболочка которых состоит только из s— и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Примером проявления дативного механизма при образования связи служит взаимодействие двух атомов хлора.
34 билет
Ионная связь — это химическая связь, образованная за счет электростатического притяжения между катионами и анионами. Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому «молекулой» ионного соединения следует считать весь кристалл.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена — приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними. Ионной моделью химической связи широко пользуются для описания свойств многих веществ, в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами. Это обусловлено простотой описания таких соединений: считают, что они построены из несжимаемых заряженных сфер, отвечающих катионам и анионам. При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания — минимальными.Водородная связь — это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н … В (чертой обозначена ковалентная связь, тремя точками — водородная связь).
35 — 36билет
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами: высокими электропроводностью и теплопроводностью, способностью хорошо отражать свет (что обуславливает их блеск и непрозрачность), возможностью принимать нужную форму под воздействием внешних сил (пластичностью). Существует и другое определение металлов – это химические элементы, характеризующиеся способностью отдавать внешние (валентные) электроны.
Ковалентная связь – определение, характеристика. Что такое ковалентная связь?
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
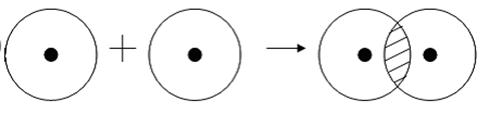
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.

Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Covalent Bond.
История
С момента открытия атомов и молекул исследователи долгое время задумывались над вопросом, какие силы объединяют микрочастицы в молекуле.
В 1897 году Джозеф Джон Томсон выдвинул теорию, что атомы удерживаются рядом благодаря переносу электронов от одного атома к другому и образованию электронных связей. И был прав. Вклад Томсона в науку был отмечен Нобелевской премией в 1906 году за «изучение прохождения электрического тока через газы».
Исследования продолжились, и в 1916 году американский физико-химик Гильберт Ньютон Льюис объяснил это явление, предложив теорию электронной химической связи. В своих опытах ученый заметил, что наиболее устойчивы при взаимодействии электронные оболочки атомов благородных газов. А атомы других веществ стремятся сделать свою энергетическую оболочку похожей на оболочку благородного газа, расположенного в том же периоде. И для этого присоединяют или отдают электроны. Познакомиться с биографией ученого можно в учебнике
Химия 8 класс под редакцией В.В. Еремина на странице 218.
Исследователь предложил графическую модель структуры молекулы, в которой электроны обозначены точками, а связи черточками.
Правило октета
Льюис сформулировал принцип «октета». Согласно этому правилу, при создании молекулы атомы стараются достигнуть восьмиэлектронной валентной оболочки, попарно объединяя электроны, находящиеся на внешней орбитали. По важности это открытие сопоставимо с открытием периодического закона Д.И. Менделеевым.
Заглянем в Периодическую таблицу. В первом периоде находятся водород и гелий. Общее у этих двух газов — одна орбиталь. А вот количество электронов различно: у водорода один, у гелия два. Как мы помним, на первой орбитали у любого элемента могут поместиться всего лишь два электрона. И поскольку орбиталь гелия максимально заполнена — это инертный газ, который не вступает в химические реакции. А вот водород ищет себе пару и объединяется в двухатомные молекулы H2 или образует соединения с другими элементами. В остальных периодах на внешней орбитали могут разместиться восемь электронов.

Химия. 8 класс. Задачник
Задачник включает как типовые расчетные задачи, так и нестандартные задачи повышенной сложности; задания и упражнения, развивающие учебные умения, творческие и аналитические способности учащихся. Задачи сгруппированы по темам, изучаемым в 8 классе основной школы, в порядке возрастания их сложности: от простых расчетных до поисковых олимпиадных.
Купить
Механизмы образования связи
Взаимодействие, возникающее при образовании общих электронных пар, называется ковалентная химическая связь. При образовании химической связи выделяется энергия в количестве, необходимом для разъединения атомов на расстояние, при котором взаимодействие стало бы невозможным. Такой тип связи характерен для большинства соединений.
Взаимодействие между атомами различных веществ может происходить двумя способами.
- В первом варианте два атома, у которых на внешнем энергетическом уровне находится по одному свободному электрону, образуют общую пару. Такой механизм взаимодействия называют обменным.
- В некоторых случаях у одного атома есть пара электронов, а у другого свободная орбиталь, которую он предоставляет для взаимодействия. Такой механизм называют донорно-акцепторным.
От электроотрицательности атомов и их способности притягивать электроны зависит, какая ковалентная связь образуется в молекуле.
В месте перекрывания электронных облаков создается зона повышенной электронной плотности. Если электроотрицательность элементов равна, электронное облако находится на одинаковом расстоянии от центров атомов, входящих в электронную пару, и образуется ковалентная неполярная связь.
Если электроотрицательность различна, происходит сдвиг электронного облака в сторону центра с большей электроотрицательностью, то есть образуются молекула с двумя полюсами (диполь). Самый простой пример диполя — молекула воды. Данный тип связи и есть ковалентная полярная связь.
Ионная связь — вариант крайне полярной ковалентной связи.
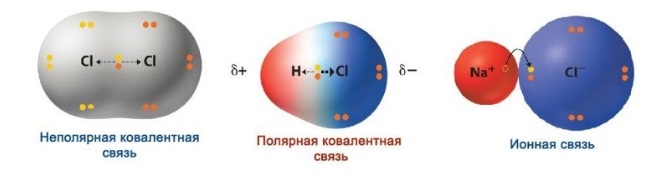
Помимо полярности, ковалентная связь соединения характеризуется и другими параметрами:
- Длиной связи — чем меньше длина, тем прочнее связь.
- Энергией связи — чем больше выделяется энергии при образовании молекулы, тем стабильнее молекула.
- Кратностью связи — число общих электронных пар между атомами. Кратность связи такова, что обеспечивает заполнение внешней электронной оболочки до 8 электронов у обоих атомов. Чем больше кратность связи, тем прочнее ковалентная связь молекулы.
Примеры и задачи
Чтобы закрепить тему, разберем задачу из учебника
Химия 8 класс под редакцией В.В. Еремина.
Даны три электронные формулы:
![]() .
.
Какие из перечисленных ниже формул веществ соответствуют каждой из них: NH3, HCl, O2, F2, N2, H2, HBr, Cl2?
Начнем с задания под буквой а.
Поскольку буквенные обозначения элементов разные, следовательно, и вещества в состав молекулы входят разные. Значит, можем вычеркнуть O2, F2, N2, H2 и Cl2.
В состав молекулы входят два атома различных веществ, соответственно, NH3, в молекулу которого входит 4 атома, также вычеркиваем.
У нас остаются HCl и HBr.
И Cl и Br являются элементами VII группы Периодической таблицы, и на внешнем энергетическом слое у них 7 электронов. Значит, оба вещества подходят.
С остальными двумя примерами попробуйте справиться сами.
#ADVERTISING_INSERT#
