Какими свойствами будет обладать полипептид гидрофильными или гидрофобными
Подпишись на наш Instagram, если хочешь сдать экзамены на отлично!
@shpory_2020_
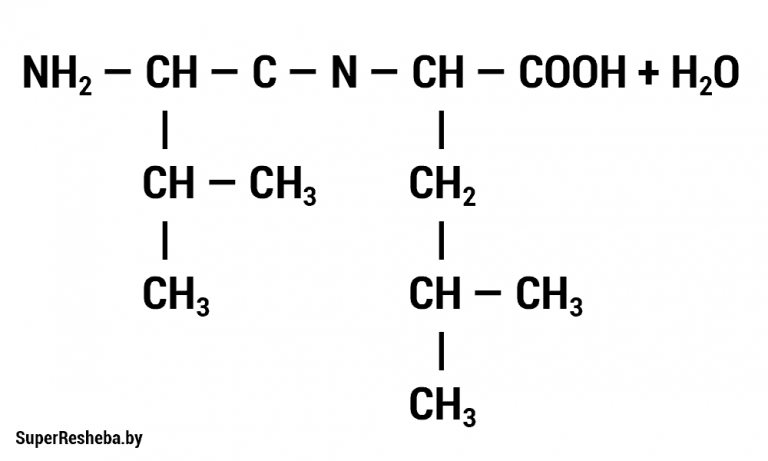
1. Запишите формулу дипептида, образованного двумя молекулами аминокислот.

2. В состав полипептида входят следующие аминокислоты: аланин, лизин, глутаминовая кислота. Какими свойствами будет обладать полипептид — гидрофильными или гидрофобными? Ответ поясните. Формулы данных аминокислот приведены в учебнике (с. 19, рис. 6).
Полипептид будет гидрофильным.
3. Альбумин сыворотки крови человека имеет относительную молекулярную массу 68 400. Определите количество аминокислотных остатков в молекуле этого белка, принимая во внимание, что средняя относительная молекулярная масса одной аминокислоты равна 120.
$dfrac{68400}{120} = 570$ (аминокислотных остатков).
4. Определите, сколько остатков глюкозы содержится в моле- куле гликогена, если его относительная молекулярная масса составляет примерно $1.62 · 10^6.$
$1.62 · dfrac{10^6}{162} = 10 000$ (остатков глюкозы).
5. Рассчитайте, сколько граммов глицерина было израсходовано клетками организма на синтез жира, если известно, что при этом было затрачено 21 моль высших карбоновых кислот.
На 1 моль глицерина приходится 3 моль кислот. Было использовано 7 моль глицерина. $M(mathrm{C_3H_8O_3}) = 92$ г/моль.
6. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 20 %. Определите процентное содержание остальных нуклеотидов в этой ДНК.
Гуаниловых кислот — 20 %; адениловых — 30 %; тимидиловых — 30 %.
7. Фрагмент молекулы ДНК содержит 280 остатков цитидиловых нуклеотидов, что составляет 14 % от общего количества нуклеотидов. Определите длину данного фрагмента молекулы ДНК.
Ц + Г = $560;$ А + Т = $72 % = 1440;$ $dfrac{560 + 1440}{2} = 1000;$ длина фрагмента равна $340$ нм.
8. Фрагмент молекулы ДНК состоит из 5760 нуклеотидов, из них 1125 тимидиловых нуклеотидов. Определите количество адениловых, гуаниловых и цитидиловых нуклеотидов в данном фрагменте молекулы ДНК.
А = Т = $1125;$ $5760 — 1125 — 1125 = 3510;$ Г = Ц = $dfrac{3510}{2} = 1755.$
9. Длина фрагмента молекулы ДНК равна 68 нм, что составляет 10 % от длины всей молекулы. На долю адениловых нуклеотидов в данной молекуле ДНК приходится 12 %. Определите относительную молекулярную массу фрагмента молекулы ДНК, принимая во внимание, что относительная молекулярная масса одного нуклеотида равна 354, и число всех видов нуклеотидов в данной молекуле ДНК.
$dfrac{68,нм}{0.34,нм} = 200;$ $200 · 354 = 70 800.$
10. У исследователя есть три молекулы ДНК одинаковой длины. Известно, что содержание тимидиловых нуклеотидов (Т) в первом образце составляет 20 % от общего числа нуклеотидов, во втором — 36 %, в третьем — 8 %. Исследователь начал нагревать данные молекулы ДНК, постепенно повышая температуру. При этом происходило отделение комплементарных цепей друг от друга — так называемое плавление ДНК. Какой образец начал плавиться первым, а какой расплавился в последнюю очередь? Почему?
Поскольку во втором образце содержится меньше Г–Ц (потому как больше тимидиловых нуклеотидов), он начал плавится первым, а в последнюю очередь расплавился третий, где содержание Г–Ц наибольшее (тимидиловых нуклеотидов наименьшее).
Капелька росы на гидрофобной поверхности листа
Капли воды на гидрофобной поверхности травы
Не следует путать с гидрофобией — боязнью воды.
Гидрофо́бность (от др.-греч. ὕδωρ «вода» + φόβος «боязнь, страх») — физическое свойство молекулы, «стремление» избежать контакта с водой[1]. Сама молекула в этом случае называется гидрофо́бной.
Гидрофобные молекулы обычно неполярны и «предпочитают» находиться среди других нейтральных молекул и неполярных растворителей. Поэтому вода на гидрофобной поверхности, обладающей высоким значением угла смачивания, собирается в капли. А при добавлении в воду гидрофобных жидкостей, в зависимости от плотности, они собираются в изолированные сгустки, либо распределяются по поверхности воды, как происходит с нефтью.
Гидрофобными являются молекулы алканов, масел, жиров и других подобных материалов. Гидрофобные материалы используются для очистки воды от нефти, удаления разливов нефти и химических процессов разделения полярных и неполярных веществ.
Слово «гидрофобный» часто используется в качестве синонима к слову «липофильный» — «жиролюбивый», хотя это не вполне корректно. Действительно, гидрофобные вещества в целом липофильны, но среди них есть и исключения — например, силиконы, фторопласт.
Химические основы[править | править код]
Согласно термодинамике, материя стремится к состоянию с минимальной энергией, а связывание понижает химическую энергию. Молекулы воды поляризованы и способны образовывать между собой водородные связи, чем объясняются многие уникальные свойства воды. В то же время, гидрофобные молекулы не поляризованы и не способны образовывать водородные связи, поэтому вода отталкивает такие молекулы, предпочитая образовывать связи внутри себя. Именно этот эффект определяет гидрофобное взаимодействие, называемое так не совсем корректно, так как его источником является взаимодействие гидрофильных молекул воды между собой.[2] Так, две несмешивающиеся фазы (гидрофильная и гидрофобная) будут находиться в таком состоянии, где поверхность их контакта будет минимальной. Данный эффект можно наблюдать в явлении разделения фаз, происходящем, например, при расслоении водно-масляной эмульсии.
Сверхгидрофобность[править | править код]
Капля на поверхности лотоса.
Сверхгидрофобные материалы имеют поверхности, чрезвычайно несклонные к смачиванию (с углом контакта с водой, превышающим 150°). Многие из подобных материалов, обнаруженных в природе, подчиняются закону Кассье и являются двухфазными на субмикронном уровне, причем одним из компонентов является воздух. Эффект лотоса основан на этом принципе. Примером сверхгидрофобного материала-биомиметика в нанотехнологии является нанопин-плёнка (англ.)русск.. Показано, что поверхность пентоксида ванадия может переключаться между сверхгидрофобностью (англ.)русск. и сверхгидрофильностью под действием УФ излучения[3]. Согласно этому исследованию, любую поверхность можно наделить подобным свойством путём нанесения на неё суспензии розеткообразных частиц V2O5, например, с помощью струйного принтера. Тут гидрофобность также вызывается межслойными воздушными полостями (разделёнными расстояниями 2.1 нм). Механизм действия УФ излучения состоит в создании пар «электрон-дырка», в которых дырки реагируют с атомами кислорода в кристаллической решетке, создавая кислородные вакансии на поверхности, а электроны восстанавливают V5+ до V3+. Кислородные вакансии закрываются водой и такое поглощение воды поверхности ванадия делает её гидрофильной. При продолжительном пребывании в темноте вода замещается кислородом и гидрофильность утрачивается.
См. также[править | править код]
- Гидрофильность
- Гидрофобное покрытие
- Флотация
- Эффект сальвинии
Примечания[править | править код]
- ↑ Aryeh Ben-Na’im Hydrophobic Interaction Plenum Press, New York (ISBN 0-306-40222-X)
- ↑ Goss, K. U. and R. P. Schwarzenbach (2003): «Rules of Thumb for Assessing Equilibrium Partitioning of Organic Compounds: Successes and Pitfalls.» JOURNAL OF CHEMICAL EDUCATION 80(4): 450—455. Link to abstract
- ↑ UV-Driven Reversible Switching of a Roselike Vanadium Oxide Film between Superhydrophobicity and Superhydrophilicity Ho Sun Lim, Donghoon Kwak, Dong Yun Lee, Seung Goo Lee, and Kilwon Cho J. Am. Chem. Soc.; 2007; 129(14) pp 4128 — 4129; (Communication) doi:10.1021/ja0692579
Литература[править | править код]
- Чугунов, А. О. Физическая водобоязнь / А. О. Чугунов, А. А. Полянский, Р. Г. Ефремов // Природа. — 2013. — Вып. 1169, № 1. — С. 24-34.
Ссылки[править | править код]
- Webtool to calculate and plot the hydrophobicity of proteins.
- [wetenschap.infonu.nl/scheikunde/18559-hydrofobe-interactie-chromatografie.html Hydrophobicity applied — hydrophobic interaction chromatography (dutch)]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
ЛИПИДЫ И МЕМБРАНЫ
В отличие от белков или углеводов, липиды не имеют никакой общей формулы. Это просто собирательное название всех гидрофобных биологически активных соединий. Вот, например, холестерин, спирт с огромной гидрофобной частью. Его производные — стероидные гормоны, которые вырабатываются у человека корой надпочечников и половыми железами. Все они относятся к липидам.
Заодно начнем привыкать к тому, что такие сложные формулы, как правило, не рисуют целиком, до каждого атома. На подобной формуле любой уголок обозначает атом углерода, у которого все свободные валентности по умолчанию заполнены атомами водорода. А если убрать единственную здесь двойную связь, то оставшееся ядро из четырех колец (трех шестиугольников и одного пятиугольника) будет называться замечательным словом “циклопентанпергидрофенантрен”. Это и есть основа для создания разнообразных стероидов, формулами которых загромождать изложение не будем.
Другая важная группа липидов — жирные кислоты, то есть карбоновые кислоты с длинными (10-20 атомов углерода и больше) углеводородными “хвостами”. Чем длиннее “хвост”, тем хуже кислота растворяется в воде. Жирные кислоты, у которых в цепочке более 12 атомов углерода, называют высшими.
Жирные кислоты бывают насыщенные (без двойных связей в углеводородной цепочке) или ненасыщенные (с двойными связями). Насыщенные высшие жирные кислоты при комнатной температуре — твердые вещества, а ненасыщенные — жидкости. Связано это с более компактной упаковкой насыщенных «хвостов», в которых нет создаваемых двойными связями изломов и изгибов.
Несколько примеров жирных кислот: линолевая, олеиновая, пальмитиновая, стеариновая, линоленовая. Ненасыщенные жирные кислоты особенно распространены у растений (например, в растительных маслах).
У насыщенных жирных кислот «хвосты» прямые, у ненасыщенных изогнутые в местах двойных связей. Из-за этого молекула может приобрести причудливую форму, особенно если двойных связей несколько. На картинке — модель молекулы линоленовой кислоты, у которой в «хвосте» три двойных связи.
В водном растворе молекулы жирных кислот и их солей образуют мицеллы — шарообразные скопления, где гидрофобные “хвосты” обращены внутрь, минимизируя контакт с водой, а гидрофильные “головки” — наружу, поскольку они-то взаимодействуют с водой хорошо. Это довольно обычное поведение вещества, в молекуле которого есть одновременно гидрофобная и гидрофильная группы.
Жирные кислоты, а вернее их соли, постоянно используются человеком в качестве моющих средств. На картинке — один из самых распространенных компонентов мыла, стеарат натрия (соль стеариновой кислоты). Четко выделена гидрофильная головка, а остальная часть молекулы представляет собой гидрофобный хвост.
Механизм моющего действия мыла следующий. В сосуде слева молекулы мыла просто образуют мицеллу. В сосуде справа они растворяют свои углеводородные хвосты в капле “грязи” (которая, как правило, гидрофобна) и разбивают ее на мелкие капельки, которые легко смыть. Вещества с такой активностью называются детергентами.
Детергенты бывают очень разными по химической структуре; их гидрофильные части могут быть положительно заряженными, отрицательно заряженными или вовсе незаряженными, а просто полярными. Но молекула любого детергента обязательно включает гидрофобный «хвост» и гидрофильную «головку». Довольно много соединений такого типа входит в состав живых организмов.
Вспомним, что любая карбоновая кислота может образовать с любым спиртом сложный эфир. При этом от кислоты отщепится -OH, от спирта -H, они образуют воду, а остатки кислоты и спирта замыкаются в единую молекулу со сложноэфирной группой -CO-O- посредине. Спиртом, участвующим в этой реакции, вполне может быть и глицерин, у которого гидроксильных групп три. Сложный эфир глицерина и трех жирных кислот называется жиром.
Типичный пример жира, в данном случае ненасыщенного (из трех остатков жирных кислот ненасыщенных тут два). Растительные масла — жидкие, потому что в них больше ненасыщенных жиров, чем у животных. Хотя в целом и насыщенные, и ненасыщенные жирные кислоты есть и у тех и у других, различается только их вклад.
Жиры — ценные источники энергии, именно поэтому они часто запасаются в клетках соединительной ткани у животных, как вот, например, у суслика.
А теперь познакомимся с еще одним важным для нас соединением — фосфорной кислотой (H3PO4). Напомним, что валентность фосфора — 5. На картинке присутствуют два способа изображения молекулы: графическая формула, игнорирующая пространственное расположение связей, и структурная, показывающая его. Вновь будем иметь в виду, что “фосфорная кислота” и “фосфат” (то есть ее соль) в биохимии практически синонимы, в подавляющем большинстве случаев эти понятия свободно заменяются друг на друга.
Сложный эфир глицерина, двух жирных кислот и фосфорной кислоты называется фосфолипидом. Можно сказать, что фосфолипид — это как бы жир, у которого вместо одного из остатков жирных кислот тем же способом присоединен фосфат. Такая молекула состоит из гидрофильной “головки” (включающей остатки глицерина и фосфата) и двух гидрофобных “хвостов” (жирных кислот). При фосфате бывают еще дополнительные боковые цепи, у разных фосфолипидов разные.
Один из самых распространенных фосфолипидов — фосфатидилхолин. Он приведен только в качестве примера. В других фосфолипидах на месте холина может быть аминокислота серин или что-нибудь еще.
Именно из фосфолипидов в основном состоят клеточные мембраны. Тут используется их физическое свойство: собираться в воде в двойной слой гидрофобными “хвостами” внутрь и гидрофильными “головками” наружу. Замкнутый пузырек, образованный таким двойным слоем молекул, называется везикулой. Вся клеточная мембрана — это в некотором смысле сильно разросшаяся везикула.
На картинке показано, как на границе гидрофильного раствора (вода) и гидрофобного (масло) молекулы фосфолипидов ориентируются хвостами в сторону масла, а головками в сторону воды. Если же никакого масла поблизости нет, то молекулы фосфолипидов располагаются головками в сторону воды, а хвостами друг к другу, и получается двойной слой, который сразу замыкается в везикулу, чтобы не было неустойчивых свободных краев. Это чисто физическое явление, которое запросто может иметь место и вне живых клеток.
Вот схема того, как фосфолипиды «собираются» в клеточную мембрану. Молекула фосфолипида нарисована двумя способами — во всех деталях (в качестве примера тут взят уже знакомый нам фосфатидилхолин) и в виде головки с двумя хвостиками. Таким молекулы собираются в двойной слой хвостиками друг к другу, головками к воде. Справа — простейшая схема участка типичной мембраны.
На самом деле биологические мембраны никогда не состоят только из одних фосфолипидов. Типичная клеточная мембрана — фосфолипидный бислой во встроенными в него интегральными белками, которые обычно являются или рецепторными (принимают сигналы из внешней среды и передают их внутрь клетки), или транспортными (переносят те или иные молекулы с одной стороны мембраны на другую). Часть белка, проходящая сквозь образованный «хвостами» внутренний слой мембраны, как правило, представляет собой альфа-спираль, целиком состоящую из гидрофобных аминокислот, боковые цепи которых торчат наружу. Если белок достаточно сложный, таких альфа-спиралей вполне может быть несколько. Кроме того, к мембранным белкам снаружи часто прикреплены ковалентными связями дополнительные цепочки, состоящие не из аминокислот, а из углеводов. Они бывают нужны в первую очередь для взаимодействия между клетками.
Тут мы видим кое-какие дополнительные детали. Во-первых, кроме фосфолипидов в мембране есть холестерин — его молекулы раскрашены желтым (если сравнить с уже знакомой нам формулой холестерина, видно, что каждая молекула своей гидроксильной группой обращена к воде, а массивной гидрофобной частью внутрь мембраны). Во-вторых, изнутри ко многим интегральным белкам прикреплены элементы цитоскелета — внутриклеточной системы опорных структур, тоже состоящей из белков. Но обе эти особенности есть далеко не у всех клеток.
В целом можно назвать как минимум три основные функции липидов: энергетическая (жиры), структурная (фосфолипиды, холестерин) и сигнальная (стероиды). Но надо иметь в виду, что липиды в силу самой природы этого сборного понятия крайне разнообразны, даже при том, что они (в отличие от белков) не являются полимерами. Мы обсудили далеко не все их группы.
